AcrR 突变介导鼠伤寒沙门菌耐药的调控
2022-12-09李小军李胜利樊帅奇邓翔杰孙亚伟
李小军,李胜利,樊帅奇,邓翔杰,孙亚伟
(1.河南省济源市动物卫生监督所,河南 济源 454650;2.河南科技学院动物科技学院,河南 新乡 453003)
沙门菌是引发食物中毒的一类重要病原菌,每年该菌导致全球约9 380万人感染,15.5万人死亡[1]。鼠伤寒沙门菌是沙门菌一个重要血清型,是临床沙门菌病的主要病原。目前,治疗沙门菌病的首选药物是 β-内酰胺类药物和氟喹诺酮类药物。然而,由于抗菌药的不合理使用和误用,多重耐药鼠伤寒沙门菌的出现和广泛传播已使沙门菌病治疗面临更大的挑战[2]。
多重耐药泵是细胞膜内的一类膜蛋白,它可借助ATP酶水解和细胞膜两侧的质子反向转运提供动力,把进入细胞内的药物、去污剂和细胞内代谢产物排至细胞外。在鼠伤寒沙门菌体内,AcrAB-TolC是最重要的多重耐药泵之一。当其在敏感鼠伤寒沙门菌SL1344中失活后,体外用环丙沙星不能筛选出氟喹诺酮类耐药突变体[3]。当其在临床多重耐药鼠伤寒沙门菌BN10055和543SA98中失活后,突变体对萘啶酸、环丙沙星、氯霉素、氟苯尼考和四环素的最小抑菌浓度(Minimum inhibition concentration,MIC)降低8~64倍,表型由耐药转变为中介或敏感[4]。细菌多重耐药产生过程中,AcrAB-TolC是组成性表达,其表达水平主要受RamRA、MarRA、SoxRS 和AcrR调控。其中,RamRA是最重要的调控体系。已证实,RamA能够直接结合在acrA和tolC启动子区提高该基因表达[5]。ramR基因位于ramA基因上游,其转录方向与ramA基因相反。临床鼠伤寒沙门菌中,当RamR发生突变或RamR与外排泵底物(溴化乙锭、罗丹明6G和吲哚)结合后,RamR从ramA启动子区解离,RamA表达,acrAB表达水平增加,细菌对药物敏感性下降[6-7]。AcrR是AcrAB-TolC的一个负调控蛋白,其蛋白编码序列位于acrAB开放阅读框上游,转录方向与acrAB相反。目前,AcrR突变、缺失、转录提前终止,IS插入等已在大肠杆菌、肺炎克雷伯菌和流感嗜血杆菌染色体内发现,这些基因变化导致了acrAB表达水平增加,细菌对药物敏感性下降[8-10]。尽管上述研究已证实了AcrR在临床多重耐药菌中的作用,然而它在沙门菌中的相关报道却非常少。
2004年,Hsueh等从猪和人体内分离的环丙沙星耐药霍乱沙门菌中首次发现AcrR突变(Gln78Stp),但鼠伤寒沙门菌的AcrR没有发生变化[11]。另外,由鸽子分离的1株敏感鼠伤寒沙门菌 BN18,体外用环丙沙星筛选2株多重耐药菌BN18/41和BN18/71,其AcrR序列在第75位异亮氨酸(Ile) 第76位谷氨酸(Glu)后出现1个75Ile-76Glu重复。用敏感菌BN18的acrR在该突变体内互补后,麻保沙星、环丙沙星、四环素和氯霉素对细菌的MICs下降4倍[12]。目前AcrR在临床鼠伤寒沙门菌中是否发挥作用还未见报道。
为了阐明临床鼠伤寒沙门菌多重耐药机制,本试验首先检测多重耐药泵抑制剂在4株临床菌对不同药物敏感性中作用,并通过实时荧光定量PCR(Real time RT-PCR)检测细菌内主要多重耐药泵基因相对表达水平;其次,失活细菌内主要多重耐药泵及其调控蛋白,比较蛋白失活前后细菌MICs变化,确定该蛋白在细菌多重耐药中作用;最后,测序分析细菌耐药相关蛋白基因序列,选取发生突变的耐药泵相关蛋白并在临床菌中过表达,确定该蛋白在多重耐药调控中的作用。
1 材料与方法
1.1 菌株和质粒 鼠伤寒沙门菌CVCC541(命名为ST),购自中国兽医药品监察所;临床鼠伤寒沙门菌CST1、CST2、CST3和 CST4,分别从不同地区不同病鸡的肝脏中分离,均通过生化及PCR测序鉴定为鼠伤寒沙门菌。大肠杆菌DH5α,本实验室保存菌;原核表达质粒 pET-32a,购自Novagen公司;用于基因失活质粒:pKD4,pKD46和pCP20,均购自耶鲁大学大肠杆菌菌种中心。
1.2 药品及试剂 阿莫西林 (Amoxicillin,AMO)、头孢噻呋钠(Ceftiofur sodium,CF)、头孢噻肟 (Cefotaxim,CTX)、盐酸四环素 (Tetracycline hydrochloride,TET)、多西环素 (Deoxycycline,DOX)、氟苯尼考(Florfenicol,FLO)、环丙沙星(Ciprofloxacin,CIP)、恩诺沙星 (Enrofloxacin,ENR) 和加替沙星 (Gatifloxacin,GAT),均购自中国兽医药品监察所;多重耐药泵抑制剂苯丙氨酸-精氨酸-β-萘胺(Phenylalanine arginine beta-naphthylamide,PAβN)和羰基氰化物间氯苯腙 (Carbonyl cyanide m-chlorophenylhydrazone,CCCP),均购自西格玛奥德里奇(上海)贸易有限公司 (Sigma-Aldrich);质粒小量提取试剂盒和凝胶回收试剂盒,均购自天根生化科技(北京)有限公司;PCR 2×Taq预混体系和DNA Marker,均购自康为世纪生物科技股份有限公司;细菌总RNA提取试剂盒,购自美国普洛麦格公司(Promega);Superscript Ⅲ 反转录酶,购自美国英杰生命技术有限公司(Invitrogen);2×SYBR Green Supermix,购自宝生物工程(大连)有限公司;胰蛋白胨、酵母提取物、MH培养基和营养琼脂,均购自青岛高科技工业园海博生物技术有限公司;NaCl、Na2HPO4、KCl和KH2PO4,均购自中国医药集团有限公司。
1.3 主要仪器设备 低温离心机(型号:7146)、微量核酸蛋白浓度测定仪(型号:NanoDrop),美国赛默飞世尔科技(Thermo Scientific);电转仪(型号:Gene Pulser Xcell)、荧光定量PCR仪(型号:CFX96),美国Bio-Rad公司;梯度基因扩增仪(型号:Biometra Tone 96G),德国耶拿公司;生物安全柜(型号:BHC-1300IIA2),苏州金净净化设备科技有限公司。
1.4 引物设计 鼠伤寒沙门菌相关引物均依据NCBI公布的SalmonellatyphimuriumLT2 (GenBank登录号:NC_003197) 基因组序列,利用Primer primer 5软件设计,由武汉金开瑞生物工程有限公司合成。试验所用引物信息见表1。
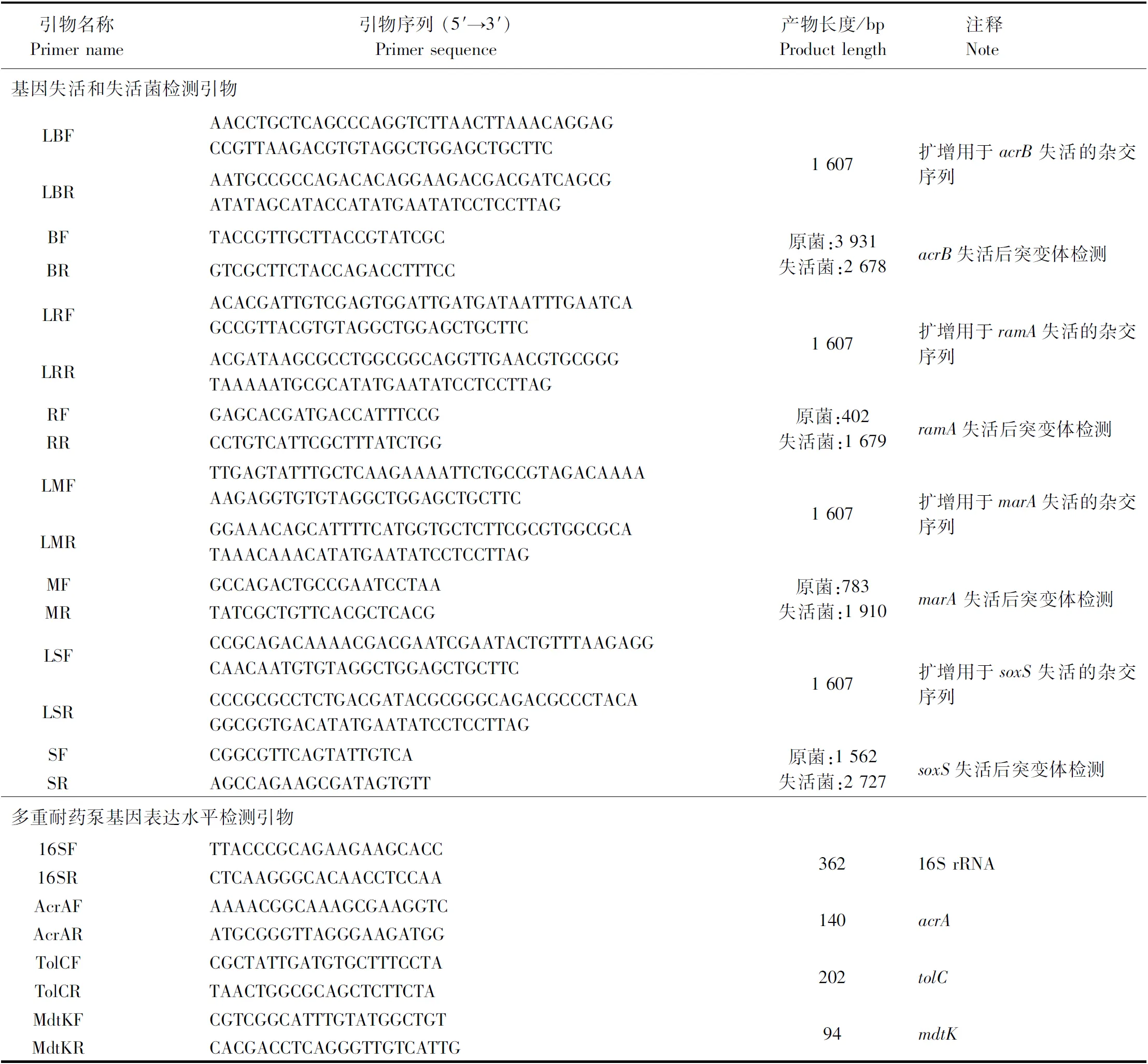
表1 引物信息

注:下划线:AcrR表达用引物携带的酶切位点
1.5 基因失活及噬菌体转导 按照黄慧等[13]方法构建ST的acrB、ramA、marA和soxS基因失活菌,同源重组打靶DNA片段扩增引物和基因失活菌检测引物均见表1。基因失活菌阳性PCR扩增产物纯化后送武汉金开瑞生物工程有限公司测序。
通过 P22噬菌体将基因失活菌中失活目的片段按照已报道的试验方法传导给临床菌[14]。(1)制备携带基因失活序列的噬菌体。将100 μL的P22噬菌体与10 mL对数生长期的基因失活菌混合,37 ℃、220 r/min振荡培养6~8 h。细菌裂解后,加入100 μL 氯仿,继续振荡培养20 min。随后,将菌液6 500 r/min离心20 min,弃去细胞碎片,吸取上清液以 0.22 μm滤膜过滤即得携带失活基因片段的噬菌体,4 ℃保存备用。(2)噬菌体转导。无菌操作台内吸取临床鼠伤寒沙门菌过夜培养物200 μL分别加入到3个1.5 mL离心管内,分别加入1、5 μL和20 μL携带失活基因片段的噬菌体,同时设置1管不加噬菌体作为空白对照,1管仅加入20 μL携带失活序列的噬菌体作为阴性对照。将5个离心管37 ℃静止20 min,随后每个离心管加入LB液体培养基,使其总体积为1 mL。将5个离心管于37 ℃、220 r/min培养45 min,菌液6 500 r/min离心5 min 弃上清,用200 μL LB液体培养基悬浮沉淀,分别涂布于含有50 μg/mL 卡那霉素的LB平板上,37 ℃培养过夜。(3)阳性转导子鉴定。挑取筛选平板的单克隆菌在含有卡那霉素(50 μg/mL)的LB液体培养基内过夜培养后,利用基因失活菌检测引物 (表1)进行PCR检测,随后将阳性PCR纯化产物送武汉金开瑞生物工程有限公司测序。检测不同抗菌药物对测序确证的acrB失活菌、ramA失活菌、marA失活菌和soxS失活菌的MICs。
1.6 MICs检测 具体方法按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准[15]。挑取待测菌 (表2) 单克隆,由LB液体培养基培养至对数期,稀释菌液使其在MH液体中的浓度为1×105~5×105CFU/mL。将稀释菌液添加入96孔微量板中,将不同浓度的抗菌药物溶液进行2倍倍比稀释,放置于37 ℃培养16~18 h,观察结果以眼观无细菌生长所在孔的药物浓度值即为该药物的MICs。另外,检测在多重耐药泵抑制剂 PAβN(工作浓度,20 mg/L)或CCCP(工作浓度,70 mg/L)存在时药物对ST、CST1、CST2、CST3和CST4的MICs。本试验中每次检测均以大肠杆菌ATCC25922为质控菌,每个试验重复3次,任何2次试验数值差异均不超过1个梯度,试验结果取3次平均值。
1.7 多重耐药泵基因表达水平检测 取2 mL对数生长期的ST、CST1、CST2、CST3和CST4菌液,按照细菌总RNA提取试剂盒按照说明书步骤提取总RNA。获得的总RNA经DNA酶消化后,使用16S rRNA引物(表1)通过PCR检测总RNA提取物中DNA是否消化完全,并利用NanoDrop One/OneC微量核酸蛋白浓度测定仪测定总RNA浓度。
利用Superscript Ⅲ 反转录酶将1 μg 总RNA按照说明书步骤体外反转录为cDNA。随后,取1 μL cDNA为模板,与荧光定量检测引物和2×SYBR Green Supermix 在冰上避光混合,通过荧光定量PCR仪检测cDNA中各基因信使RNA (mRNA) 的Ct值。扩增体系(25 μL):2×SYBR Green Supermix 12.5 μL,上、下游引物各1 μL,cDNA模板 1 μL,超纯水 9.5 μL。扩增程序:预变性,95 ℃ 30 s;变性,95 ℃ 5 s;退火及延伸,59 ℃ 20 s,共40个循环;充分延伸,72 ℃ 10 min;降温,16 ℃ 30 min。每个样品3个重复,最少检测3次。所获Ct值通过 2-ΔΔCt方法计算临床菌所测基因(表1)相对ST菌的变化倍数。
1.8 喹诺酮耐药决定区和多重耐药泵调控蛋白序列检测 以临床菌CST1、CST2、CST3和CST4菌液为模板,PCR扩增其各自喹诺酮耐药决定区(gyrA、gyrB、parC和parE)和多重耐药泵调控蛋白编码区(ramRA、marRA、soxRS和acrR)基因序列。PCR扩增体系(50 μL):2×PCR Mixture 25 μL,上、下游引物各1 μL,菌液1 μL,ddH2O 22 μL。PCR扩增程序:预变性,95 ℃ 3 min;变性,95 ℃ 30 s;退火,30 s (退火温度:gyrA、gyrB、parC和parE为55 ℃;ramRA、marRA和acrR为53 ℃;soxRS为59 ℃),共 30个循环;充分延伸,72 ℃ 10 min;降温,16 ℃ 30 min。PCR产物纯化后送武汉金开瑞生物工程有限公司测序。
1.9 AcrR表达载体构建及互补 以ST菌液为模板,按1.8方法扩增acrR基因序列。随后,以纯化的acrR序列为模板利用引物AR32F和AR32R(表1)扩增其开放阅读框。纯化后的PCR产物通过BamHⅠ和XhoⅠ双酶切,其回收产物与同样双酶切的pET-32a载体连接。连接产物电转DH5α感受态细胞,转化子在含有100 μg/mL 氨苄青霉素的LB平板上筛选。筛选的转化子通过PCR扩增测序确定阳性重组质粒。最后,将阳性重组质粒电转入临床菌CST2、CST3和CST4中并诱导表达,检测AcrR过表达后所测药物对上述细菌的MICs。
2 结果
2.1 多重耐药泵抑制剂对MICs的影响 多重耐药泵抑制剂PAβN和CCCP存在时,不同抗菌药物对鼠伤寒沙门菌的MICs见表2。PAβN导致盐酸四环素、多西环素、加替沙星和恩诺沙星对ST、CST1、CST2、CST3和CST4的MICs下降3.00~26.67倍;氟苯尼考对CST1和CST2的MICs分别下降3.00倍和5.19倍;环丙沙星对CST3的MICs下降6.25倍。另外,CCCP导致氟苯尼考对ST、CST1和CST2的MICs下降4.67~5.19倍;盐酸四环素对ST、CST1和CST3的MICs下降6.00~13.32倍;多西环素对ST和CST1的MICs分别下降8.04倍和3.20倍;但CCCP 没有导致所测药物对CST4的MICs发生明显改变。
2.2 多重耐药泵基因相对表达水平 临床菌相对ST多重耐药泵基因表达水平结果见图1。4株临床菌acrA表达水平相对ST增加了3~9倍。CST2、CST3和CST4中,多重耐药泵编码基因acrF、mdfA和emrB表达水平也增加5~15倍。但外膜通道蛋白编码基因tolC仅在CST1和CST4中表达水平增加3倍以上。mdtK仅在CST2中表达水平增加3倍以上。

图1 临床鼠伤寒沙门菌多重耐药泵基因相对表达水平
2.3 AcrB及其调控蛋白在药物敏感性中作用 MICs测定结果见表2。acrB缺失导致所测药物除阿莫西林外对ST和CST1的MICs下降3.33~80.00倍;所测药物除阿莫西林和环丙沙星外对CST4的MICs下降3.54~37.66倍;头孢噻呋钠、头孢噻肟、盐酸四环素和多西环素对CST2和CST3的MICs下降3.00~26.75倍。当ramA、marA和soxS基因在细菌中被分别失活后,所有药物对基因失活前后细菌的MICs变化均没有超过3倍。
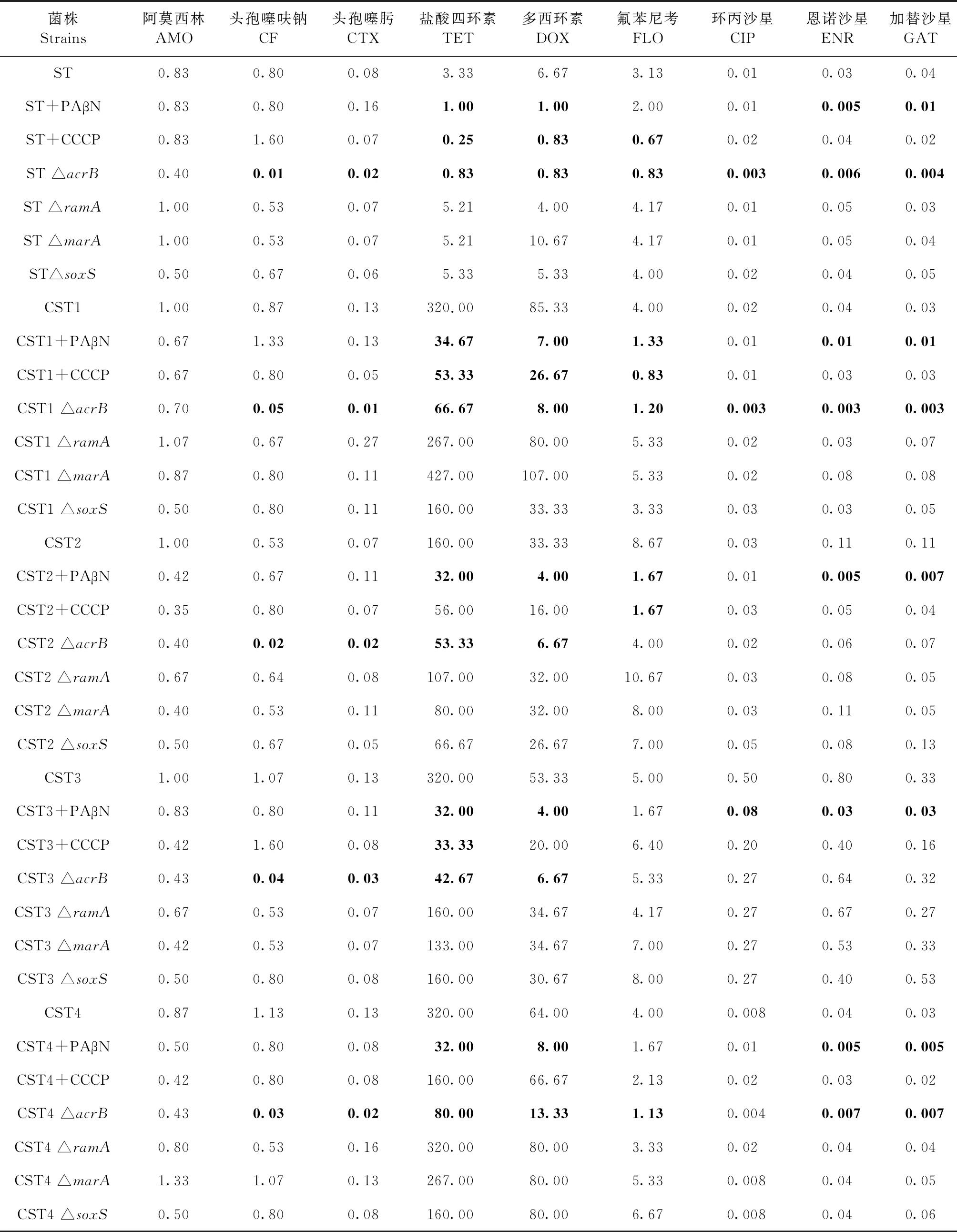
表2 鼠伤寒沙门菌在多重耐药泵抑制剂、多重耐药泵AcrB和多重耐药泵调控蛋白存在或缺失时MICs
2.4 喹诺酮耐药决定区和多重耐药泵调控蛋白靶位点突变 序列检测结果见表3。4株临床菌在GyrA均出现Gly133→Glu突变。CST2在ParC出现了Thr57→Ser突变,CST3在GyrA和ParC分别出现了Asp87→Gly和Thr57→Ser突变。另外,CST2、CST3 和CST4的AcrR也发现了突变。其中,CST2和CST3 的AcrR在第216位氨基酸发生了突变(Ser→Ala);CST4中acrR第235位碱基G缺失,导致其在第267位形成TAA终止密码子,acrR基因转录提前终止。CST4中acrR基因序列经NCBI中BLAST对比,没有发现100%同源序列,上传至NCBI数据库获得序列号为ON614636。另外,AcrAB其他相关调控蛋白(RamRA、MarRA和SoxRS) 均未出现突变。

表3 临床菌喹诺酮耐药决定区和多重耐药泵调控蛋白AcrR靶位点突变
2.5 AcrR表达载体构建及互补 ST菌acrR基因通过pET-32a载体构建重组质粒pET-32a-acrR,该质粒在临床菌CST2、CST3和CST4中过表达后,盐酸四环素对CST2的MICs下降3.00倍,头孢噻呋钠、盐酸四环素和多西环素对CST3的MICs下降3.98~21.40倍;恩诺沙星和加替沙星对CST4的MICs分别下降4.00倍和3.00倍 (表4)。

表4 临床菌及其过表达AcrR后MICs
3 讨论
多重耐药泵抑制剂PAβN能够抑制AcrAB和AcrEF表达,导致多个药物对细菌的MICs显著下降[16]。本试验发现,PAβN导致盐酸四环素、多西环素、恩诺沙星和加替沙星对ST、CST1、CST2、CST3和CST4的MICs下降3.00~26.67倍;头孢噻呋钠和头孢噻肟MICs没有发生明显改变。Nikaido等研究显示,鼠伤寒沙门菌AcrB能够外排 β-内酰胺类药物且外排能力与该药物含有亲脂侧链的比例有关[17]。试验发现,当acrB在ST、CST1、CST2、CST3和CST4中失活后,头孢噻呋钠和头孢噻肟对所有失活菌的MICs下降3.50~80.00倍。推测PAβN不能有效增加头孢噻呋钠和头孢噻肟敏感性的原因是这2个抗菌药与AcrB结合能力较强或它们与AcrB结合位点和PAβN与AcrB结合位点不同,故PAβN与AcrB结合后不影响2个抗菌药物外排。Lamers等研究发现,10 mg/L PAβN很难有效增加 β-内酰胺类药物对铜绿假单胞菌的敏感性,当PAβN浓度为25 mg/L 或 50 mg/L时可显著增加该类药物对铜绿假单胞菌的敏感性,但该增效作用是由于PAβN增加了细胞膜对 β-内酰胺类药物的通透性而非抑制多重耐药泵表达[18]。CCCP是 H+螯合剂,它通过结合H+降低细胞膜两侧离子浓度差,减少耐药泵转运药物动力从而抑制细菌多重耐药。在鼠伤寒沙门菌体内,MATE家族MdtK依赖Na+反向转运提供的动力将药物从细胞内排至细胞质间隙[19]。同时,MFS家族MdfA依赖H+和其他质子(Na+或K+)反向转运提供的动力将药物从细胞内排至细胞外,特别是在外排中性药物(如氯霉素)时主要依赖Na+或K+反向转运提供的动力[20]。本试验临床菌CST2、CST3和CST4中mdfA和CST2中mdtK表达水平相对ST显著增加,这可能是CCCP对这3株临床菌抑制作用减弱甚至消除的主要原因。
细菌对喹诺酮类的耐药机制主要包括喹诺酮耐药决定区靶位点突变、活性多重耐药泵和质粒介导。本试验中的临床鼠伤寒沙门菌CST2在ParC发生了Thr57→Ser突变,CST3除上述的ParC突变外,在GyrA还发生了Asp87→Gly突变,这些突变在已报道的临床鼠伤寒沙门菌都曾检测到,它们可导致氟喹诺酮类药物敏感性降低[21]。另外,4株临床菌在GyrA都出现了Gly133→Glu突变,该突变在伤寒沙门菌中常见,而在鼠伤寒沙门菌中并不常见[22]。比利时对全国沙门菌的耐药性调研结果显示,1 200余株鼠伤寒沙门菌GyrA携带Gly133→Glu突变,该突变不导致鼠伤寒沙门菌对喹诺酮类药物敏感性发生改变[23]。
AcrR是AcrAB的负调控蛋白之一,它以同源二聚体形式与所调控DNA结合,抑制基因表达。鼠伤寒沙门菌AcrR晶体结构学研究表明,每个AcrR单体由N端的DNA结合域(Met1-Lys55)和C端的底物结合域(Ser56-Ala210) 构成。其中,C端底物结合域第4个 α螺旋中的第67位谷氨酸(Glu)与第7个α螺旋中的第130位甘氨酸(Gln)可形成氢建,该氢键对维持AcrR底物结合位点的稳定性发挥重要作用。当AcrR与底物结合后,蛋白C端底物结合域空间结构发生改变,导致其N端的DNA结合域发生改变,AcrR从基因序列上解离,受抑制基因的表达水平增加[24]。对临床多重耐药大肠杆菌的研究发现,AcrR突变检出率要高于MarA和SoxS,其序列与鼠伤寒沙门菌AcrR序列比较,2个序列N端209个氨基酸表现89%同源性,剩余的19个氨基酸仅有1个相同[25]。目前在临床鼠伤寒沙门菌中AcrR突变很少被发现,其在多重耐药鼠伤寒沙门菌中的作用还不清楚。本试验在临床鼠伤寒沙门菌CST2、CST3和CST4中发现AcrR突变,当ST的acrR基因在这3株菌中过表达后,盐酸四环素对CST2,头孢噻呋钠、盐酸四环素和多西环素对CST3,恩诺沙星和加替沙星对CST4的MICs均显著下降,说明AcrR参与了临床鼠伤寒沙门菌多重耐药的调控,该结论丰富了临床鼠伤寒沙门菌多重耐药机制研究的数据。
总之,本试验发现AcrB是临床鼠伤寒沙门菌多重耐药的主要原因,负调控蛋白AcrR突变导致其从acrAB启动子区解离,acrAB表达水平增加,细菌多重耐药性增强,这可能是临床鼠伤寒沙门菌多重耐药的主要分子机制。
