海兰灰蛋鸡GM-CSF毕赤酵母表达及生物活性鉴定
2022-12-08王黎霞张建军
王黎霞,张 鹏,张建军,安 健
(1.北京农业职业学院畜牧兽医系,北京 房山 102442 ;2.北京农学院动物科学技术学院 国家级动物类实验示范中心,北京 昌平 102206)
粒细胞巨噬细胞集落刺激因子(Granulocyte macrophagocyte colony stimulating factor,GM-CSF)在集落刺激因子家族中有重要作用[1],其能激发造血干细胞和不同类型的生血祖细胞增生和异化[2],增强DNA疫苗对被免疫动物的保护效果[3],提升单抗原的免疫力,增强白介素-2的生成,活化CD4+T细胞,增加抗体的分泌,同时增强CD8+T细胞活性。
人源GM-CSF和鼠源GM-CSF在毕赤酵母表达的研究报告较多[4-5],国内外毕赤酵母表达鸡重组GM-CSF(rchGM-CSF)及其活性测定的报道罕见,为此,本试验设计PCR引物对海兰灰蛋鸡GM-CSF(chGM-CSF)基因进行序列改造,删除N端的信号肽基因序列,选择毕赤酵母真核表达系统进行rchGM-CSF的表达,利用淋巴细胞增殖试验测定其免疫促进效果,为细胞因子佐剂的研制提供理论支持。
1 材料与方法
1.1 材料 质粒小提试剂盒、DNA胶回收试剂盒,均为Axygen公司产品;pGEM-T克隆质粒、表达质粒pPICZαA、毕赤酵母GS115,均为Promega公司产品;T4 DNA限制性内切酶EcoR I、NotI、连接酶,均为TaKaRa公司产品;羊抗鼠IgG-HRP、浓缩型DAB试剂盒、RPMI1640、淋巴细胞分离液、WST-1细胞增殖检测试剂盒,均为碧云天公司产品;His Ab-1、鼠抗His单克隆抗体、Ni-NTA HIS·Bind Resin、Ni-NTA Buffer Kit、Chromatography Columns,均为Novagen公司产品。
1.2 方法
1.2.1chGM-CSF去信号肽的编码区(Coding sequences,CDS)扩增 据GenBank数据库chGM-CSF基因序列设计引物、克隆、测序,并与GenBank数据库中chGM-CSF基因片段进行序列比对,确定为chGM-CSF基因,利用SignalP 3.0数据库和SignalP-HMM算法预测序列的信号肽,通过Primer Premier 5.0软件设计去信号肽的蛋白质CDS引物,预期片段大小为389 bp。上游引物:5′-CCGAATTCTACTCCTGCTGCTACAAAGT-3′,下游引物:5′-GCGGCCGCTTGGATGCAGTCTTTCTC-3′。反应体系(50 μL):pGEX-6p-1/chGM-CSF 1 μL,10×Buffer 5 μL,上游引物1 μL,下游引物1 μL,TaqDNA聚合酶0.2 μL,dNTP 2 μL,灭菌超纯水39.8 μL。PCR扩增程序:94 ℃预变性1 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸8 min,4 ℃结束反应。PCR产物送生工生物工程(上海)股份有限公司测序,测序结果与GenBank数据库中chGM-CSF基因比对,确定信号肽CDS是否去掉。
1.2.2 重组质粒构建、转化JM109菌和阳性菌筛选 将chGM-CSF基因PCR产物及pPICZαA质粒用EcoR I和NotI双酶切,1%琼脂糖凝胶电泳检测酶切结果。将纯化的片段与质粒连接,构建毕赤酵母表达质粒pPICZαA/chGM-CSF,转化JM109菌,克隆、筛选,小量提取质粒,EcoR I、NotI酶切和PCR鉴定。
1.2.3 重组质粒电转化毕赤酵母和阳性酵母克隆筛选 将1.2.2中筛选的阳性菌扩大培养,纯化重组质粒pPICZαA/chGM-CSF,电转化毕赤酵母GS115,同时,设空质粒电转化对照组作为后续诱导表达的对照。电转化的毕赤酵母用Zeocin抗生素筛选,对阳性单菌扩大培养,提取空质粒电转化组和pPICZαA/chGM-CSF电转化组的毕赤酵母质粒,用AOX通用引物进行PCR鉴定。
1.2.4 rchGM-CSF小规模诱导表达及鉴定 分为4个组,A组:重组质粒转化的毕赤酵母甲醇未诱导培养36 h对照组;B组:未经转化的毕赤酵母甲醇诱导培养2 d对照组;C组:空质粒转化毕赤酵母甲醇诱导培养2 d对照组;D组:重组质粒转化的毕赤酵母甲醇诱导1~4 d试验组,收集各组培养上清,SDS-PAGE后硝酸银染色,以抗His单抗为一抗通过Western blot鉴定rchGM-CSF的表达。
1.2.5 rchGM-CSF的大量表达及纯化 大规模诱导表达rchGM-CSF,收集第3天培养液200 mL,离心分离上清,采用超滤法除盐浓缩为5 mL,Ni-NTA柱纯化[6],SDS-PAGE后硝酸银染色鉴定,并以抗His单抗为一抗进行Western blot鉴定。
1.2.6 rchGM-CSF生物活性鉴定 利用分光光度计在280 nm处对重组蛋白浓度进行测定,调整重组蛋白浓度为20 μg/mL,按1∶5、1∶25、1∶125、1∶625比例稀释,同时设不加rchGM-CSF的细胞对照。无菌取健康鸡脾脏,剪碎成1 mm3的小块,按常规方法分离淋巴细胞[7],调节淋巴细胞终浓度为3.0×106个/mL;取50 μL淋巴细胞悬液加入96孔细胞板中,用MTT试验鉴定不同稀释倍数的rchGM-CSF的生物活性[7]。
2 结果
2.1chGM-CSF去信号肽的CDS扩增 分析克隆得到的chGM-CSF基因,发现其具有潜在的信号肽,信号肽位于5′端的72 bp。重新设计引物,PCR得到chGM-CSF新序列长度为389 bp,与GenBank数据库中chGM-CSF基因序列比对结果显示,新序列在GAATTC酶切位点后缺失了72 bp,表明信号肽被成功去掉。
2.2 重组质粒构建、转化JM109菌和阳性菌筛选 将双酶切后回收纯化的pPICZαA质粒与chGM-CSF片段连接,连接产物转化JM109菌、筛选阳性克隆、培养,小量提取质粒,经PCR和酶切鉴定,结果显示,重组表达质粒pPICZαA/chGM-CSF构建成功(图1)。

图1 pPICZαA/chGM-CSF的PCR鉴定(A)和双酶切鉴定(B)
2.3 重组质粒电转化毕赤酵母和阳性酵母克隆筛选 重组表达质粒(试验组)和空质粒(对照组)分别电转化毕赤酵母GS115,在含100 μg/mL Zeocin YPD固体培养基上筛选毕赤酵母菌落,用AOX通用引物对其进行PCR扩增并电泳鉴定,结果显示,重组表达质粒转化的毕赤酵母出现930 bp的条带,空质粒转化的毕赤酵母出现591 bp的条带,说明筛选的毕赤酵母为阳性重组克隆(图2)。
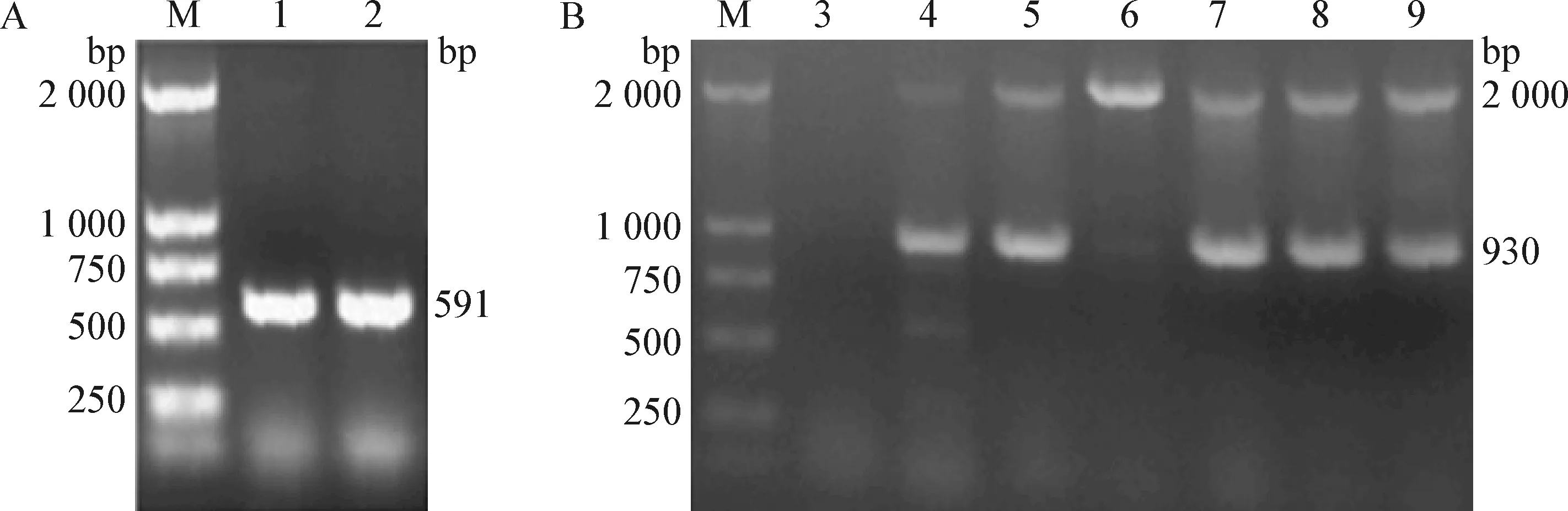
图2 电转pPICZαA对照组(A)和电转pPICZαA/chGM-CSF试验组(B)酵母菌落的PCR鉴定
2.4 rchGM-CSF小规模诱导表达及鉴定 收集各对照组(A组、B组和C组)和试验组(D组)的培养上清,SDS-PAGE后硝酸银染色发现,第1~4天D组的诱导表达的培养上清在20 kDa处有1条清晰的条带,各对照组无该条带(图3A),说明甲醇诱导了重组质粒转化的毕赤酵母表达了rchGM-CSF。灰度扫描分析发现,第3天和第4天 rchGM-CSF表达量最多。采用Western blot鉴定发现,D组有1条20 kDa的蛋白条带(图3B),说明rchGM-CSF由甲醇诱导表达成功。

图3 培养上清的SDS-PAGE鉴定(A)和Western blot鉴定(B)
2.5 rchGM-CSF的大量表达及纯化 分离毕赤酵母培养物200 mL,离心收集上清液,浓缩后Ni-NTA柱纯化,纯化后的rchGM-CSF经SDS-PAGE和硝酸银染色鉴定显示,rchGM-CSF被第2~3根柱长体积的洗脱液洗脱纯化,大小为20 kDa和17 kDa(图4A),经Western blot鉴定,条带大小也是20 kDa和17 kDa(图4B),表达量分析表明,诱导表达第3天,rchGM-CSF在上清中表达量达5 mg/L。

图4 纯化rchGM-CSF的SDS-PAGE鉴定(A)和Western blot鉴定(B)
2.6 rchGM-CSF生物活性鉴定 MTT试验结果显示,rchGM-CSF按1∶5稀释与按1∶25、1∶125、1∶625稀释及细胞对照相比,可极显著地促进淋巴细胞增殖(P<0.01);按1∶25稀释与按1∶125、1∶625稀释及细胞对照相比,可显著地促进淋巴细胞增殖(P<0.05)。结果表明,纯化的rchGM-CSF有较好的生物活性(图5)。
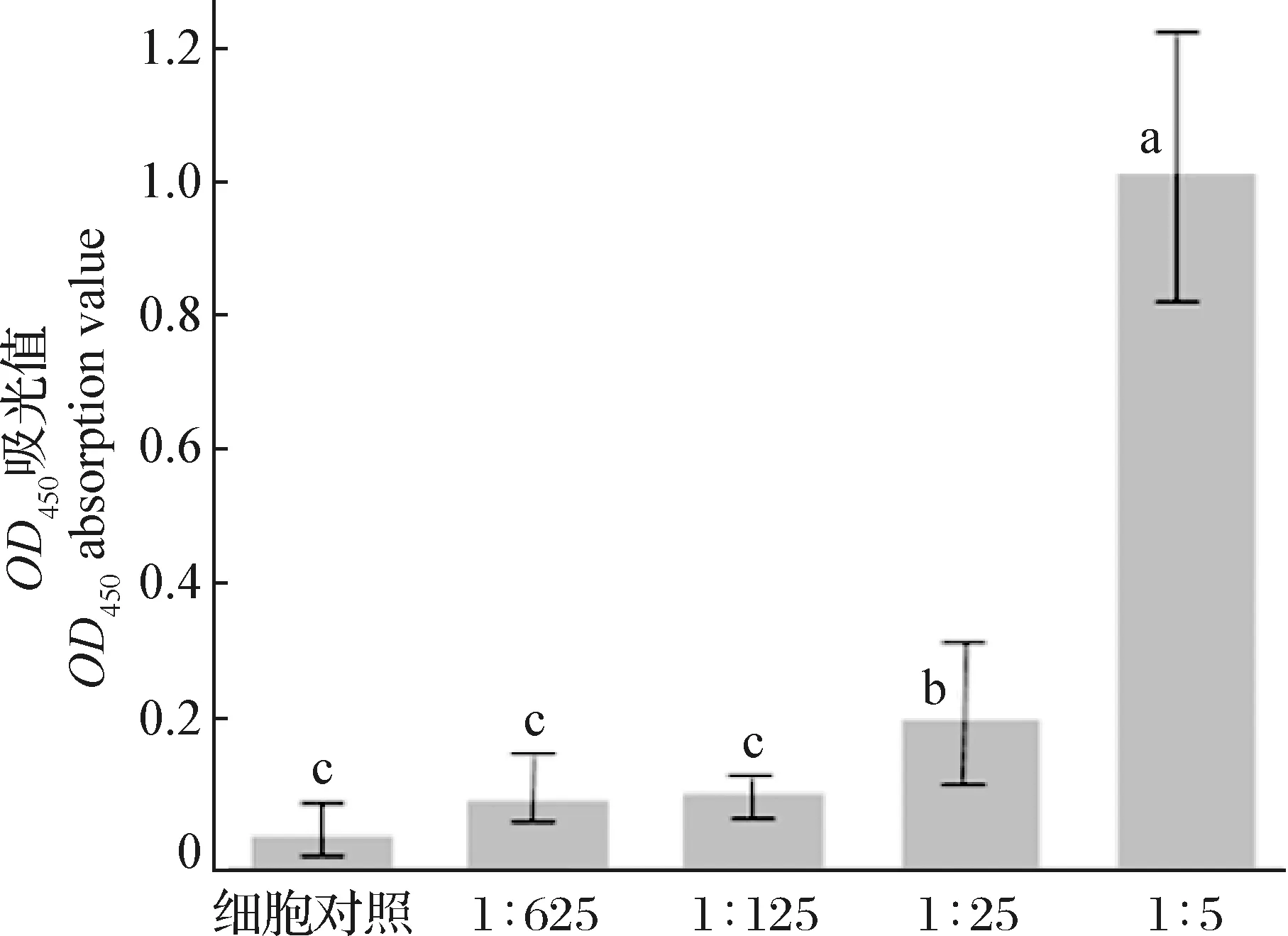
图5 MTT法鉴定rchGM-CSF生物活性
3 讨论
目前,蛋白异源表达系统有经过改造的昆虫细胞系、改造后大肠埃希菌工程菌、哺乳动物细胞系、酵母菌和鸡柔嫩艾美耳球虫等[8]。与原核表达系统相比,真核表达系统的优势是异源蛋白可进行糖基化和甲基化等的修饰[9]。本试验利用带有6His标签的pPICZαA质粒,在甲醇存在时表达外源基因。rchGM-CSF可被His亲和柱吸附,混杂的蛋白则不能被吸附而被洗脱,再用高浓度咪唑洗脱液将吸附柱上的His异源蛋白洗脱,在洗脱液中得到纯化的rchGM-CSF。本试验中甲醇诱导第3天的培养液的rchGM-CSF表达量达5 mg/L,可以满足对rchGM-CSF的活性功能的研究,具有重要的实践意义。
Srinivasa等研究发现,毕赤酵母表达的人和小鼠等动物的GM-CSF都具有不同数量的氨基酸被糖基化,其分子量要比预测的大,SDS-PAGE和Western blot鉴定时,条带的大小比理论值大3~5 kDa[4]。本试验也发现,rchGM-CSF的分子量也有增大。经His亲和柱纯化后,得到的2个条带都能与His单抗发生特异性反应,分子量较大、数量较多的条带是糖基化的结果,分子量较小、数量较少的条带与预期的蛋白理论大小相符,说明大部分异源蛋白都被糖基化。对小规模诱导表达的上清液进行SDS-PAGE和Western blot鉴定的结果中并没有小条带,可能是没有纯化浓缩的上清液中未糖基化蛋白的浓度低,没有达到可检出的浓度,而纯化浓缩后,蛋白的浓度增大,才出现可见的显色而被发现。
GM-CSF是一种决定性的细胞因子,参与多种免疫反应,皮肤给予GM-CSF后,注射位的表皮树突状细胞显著增多,1周左右达到峰值,部分表皮树突状细胞还可进入皮下淋巴组织[10]。同时,GM-CSF还可显著地增加核酸疫苗的免疫效果[11]。Dranoff等研究发现,小鼠GM-CSF可增强抗肿瘤核酸疫苗的效力,进而减少肿瘤细胞[5]。与单独使用痘病毒DNA相比,小鼠GM-CSF的DNA与痘病毒DNA联合使用可明显提升抗体滴度和IFN-γ的浓度,更进一步增强了细胞毒T淋巴细胞(Cytotoxic T lymphocyte,Tc)的功能[12]。在疟疾DNA疫苗中也发现了较为一致的结果[13]。GM-CSF与C型病毒性肝炎DNA联合免疫,能显著增强体液免疫和细胞免疫[14]。Somasundaram等研究发现,GM-CSF能增强伪狂犬病病毒DNA疫苗刺激机体产生更高水平的IgG1和IgG2,鼻腔排毒量显著下降,缩短排毒时间[15]。
GM-CSF与其他细胞因子同时使用,可显著增强DNA疫苗的免疫效果。GM-CSF、IL-2与B型肝炎病毒DNA疫苗联合应用,可增强昆明小鼠的Thl型细胞反应,IgGl和IgG2α滴度显著升高,通过溶细胞反应可明显减少细胞数量[16]。猪GM-CSF与CD40联合,可增强核酸疫苗的免疫效果,提高β-gal抗体IgG、IgG2a的水平[17],也可促进Tc显著增殖[18]。本试验也发现,rchGM-CSF按1∶5稀释能极显著地促进淋巴细胞增殖,按1∶25稀释能够显著地促进淋巴细胞增殖。
综上,本试验采用毕赤酵母作为表达系统工具,获得了鸡重组GM-CSF,结果表明,该异源蛋白促进了淋巴细胞增殖,说明其具备增强免疫的作用,为其作为免疫佐剂的进一步研究提供了理论支持。
