华东地区沙门菌流行病学及耐药性分析
2019-06-11吴晓君王少辉杨登辉田明星于圣青
吴晓君,王少辉,杨登辉,王 栋,田明星,丁 铲,高 崧,于圣青
(1.扬州大学兽医学院,扬州 225009;2.中国农业科学院上海兽医研究所,上海 200241)
沙门菌(Salmonella)属肠杆菌科,是一种很常见的革兰阴性杆菌,宿主十分广泛。沙门菌感染人和动物后引发沙门菌病,临床症状主要是败血症和胃肠炎等中毒症状。据统计,世界各地由沙门菌引起的食物中毒位居榜首[1-2]。近年来,美国[3]、澳大利亚[4]、瑞士[5]等国家爆发了不同规模的沙门菌感染。沙门菌还可引起多种畜禽疾病[6-7],如鸡白痢、鸡伤寒、鸡副伤寒、猪副伤寒等,给养殖业带来严重的经济损失。因此,有效地鉴定和控制沙门菌的传播已成为重中之重。本研究对华东地区养殖场中沙门菌的流行情况及其耐药性进行了分析,为预防和控制沙门菌的流行及传播提供参考。
1 材料和方法
1.1 试剂、材料和仪器 2×PCRmix、DNA Marker购自北京康为世纪生物科技有限公司;药敏片购自杭州天和微生物试剂有限公司;PCR仪购自ABI公司;核酸电泳仪及全自动凝胶成像处理系统购自上海天能科技有限公司;4℃台式离心机及小型高速离心机购自Eppendorf公司。
1.2 病料来源 2015年4月~2017年6月于上海市、江苏省、安徽省、浙江省等地4家猪场、2家鸡场采集粪便样品和肛拭子样品共285份。
1.3 引物设计 根据GenBank中公布的沙门菌基因组,设计沙门菌鉴定引物、血清学鉴定引物及毒力基因检测引物(表1)。引物均由英潍捷基(上海)贸易有限公司进行合成。
1.4 细菌的分离培养 将样品和肛拭子样品混于500 μL缓冲蛋白胨水培养基(BPW培养基)中,37℃培养增菌8~12 h;划线接种于沙门菌SS培养基上,37℃培养16~20 h;挑取疑似单菌落在平板上划线纯化,并挑取疑似单菌落接种于LB培养基中,37℃培养6~8 h,进行下一步鉴定。
1.5 沙门菌粗提DNA制备 取1 mL增菌液至无菌EP管中,18 000×g离心5 min,弃上清,加入100 μL灭菌去离子水,重悬沉淀,于沸水中加热10 min,18 000×g离心5 min,收集上清液,作为PCR反应模板。
1.6 沙门菌PCR鉴定 通过PCR扩增沙门菌invA基因鉴定沙门菌,PCR反应体系:2×PCR Master Mix 10 μL、引物invA-F/R(表1)各1 μL、模板(上1.5中所提DNA)1 μL,最后加灭菌超纯水至20 μL。同时设立阳、阴性对照。PCR反应条件:95℃预变性5 min;95℃变性 30 s,50℃ 退火 30 s,72℃延伸40 s,35个循环;72℃再延伸10 min。经1.0%琼脂糖凝胶电泳,紫外下拍照,记录结果。
1.7 血清学鉴定 根据沙门菌血清型特异性基因设计沙门菌血清学鉴定引物speC-F/R、glgC-F/R、sdfI-F/R、spy-F/R(表1)[8],建立PCR检测方法,对沙门菌临床分离株进行血清学鉴定。
1.8 毒力基因检测 根据本实验室建立的沙门菌毒力基因检测多重PCR方法[9],对48株沙门菌分离株的毒力因子进行多重PCR鉴定。
1.9 LD50测定 选取临床分离株1~7接种于LB培养基至对数生长前中期(OD600≈1.0),灭菌PBS洗涤菌体2次后稀释至含菌量为104~107/0.2 mL。选取140只6周龄ICR清洁级小鼠,随机分成28组,每组5只。临床分离株1接种1~4组,各组接种量依次为104、105、106、107CFU/只,临床分离株2~7以此类推。接种后连续观察记录14 d各组发病死亡情况,按改良寇氏法计算各菌株的LD50。
1.10 耐药性检测 采用纸片扩散法进行药敏试验。将所保存的沙门菌分离株分别在LB培养基中培养18~24 h,致密划线于琼脂平板表面,用无菌镊子将药敏片贴于培养基表面,37℃培养24 h后测抑菌圈直径,根据美国临床检验标准委员(CLSI)标准判定沙门菌临床分离株对药敏纸片的敏感性。
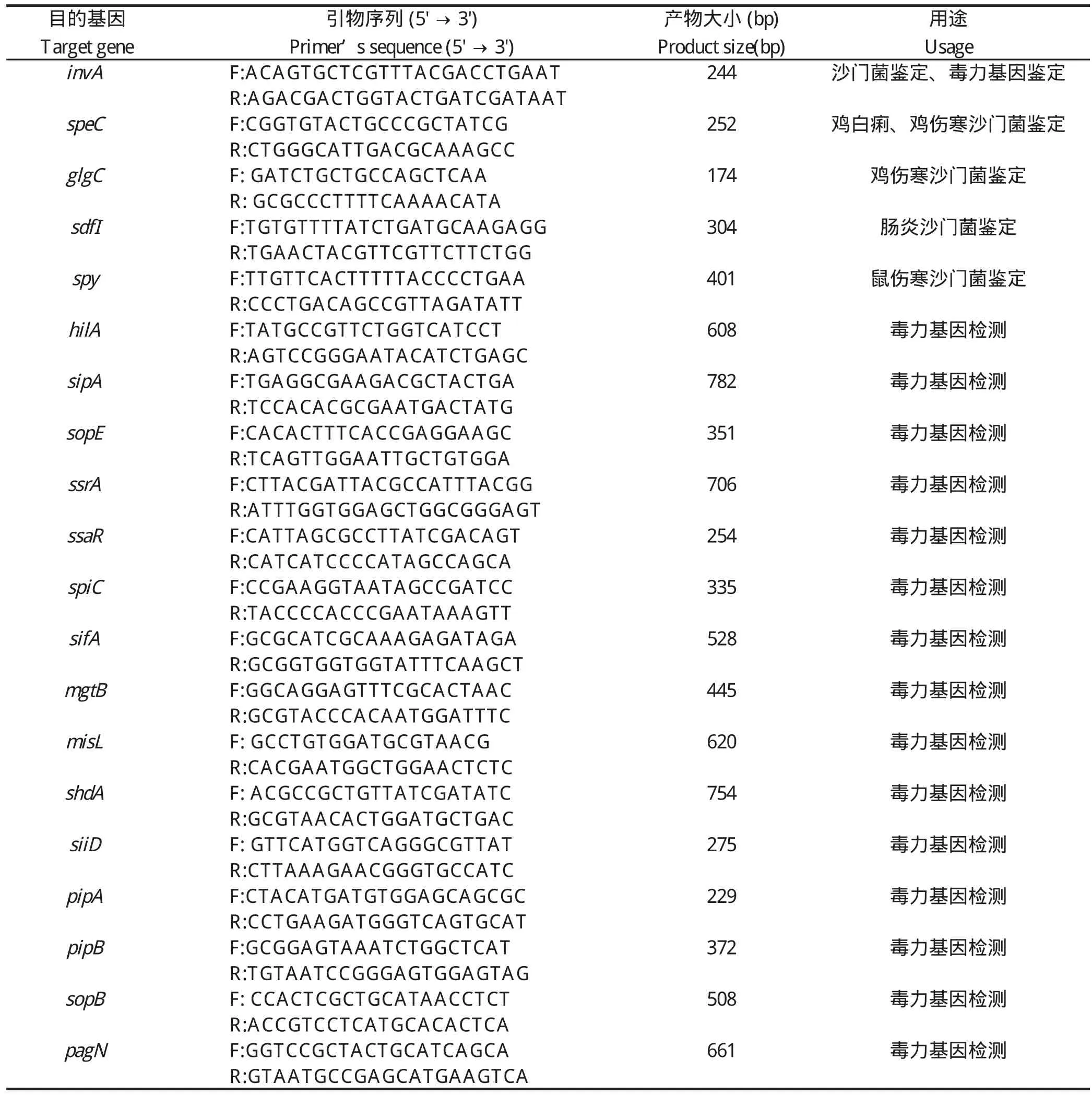
表1 本研究使用的引物Table 1 Primers used in this study
2 结果
2.1 沙门菌的分离鉴定 沙门菌在SS培养基上形成呈中间黑色、周围透明晕环的菌落,其他细菌大多呈无色菌落。从分离菌株中挑取可疑菌落,通过PCR(invA基因,244 bp)鉴定沙门菌48株,分离率为16.84%。其中猪场分离37株,分离率为12.98%;鸡场分离11株,分离率为3.85%。
2.2 血清学鉴定 对PCR鉴定呈阳性的菌株进行血清学鉴定,结果显示31株沙门菌属于鼠伤寒沙门菌,占64.58%,为主要血清型;肠炎沙门菌占6.25%(图2),未发现鸡伤寒和鸡白痢沙门菌,其他血清型占29.17%。
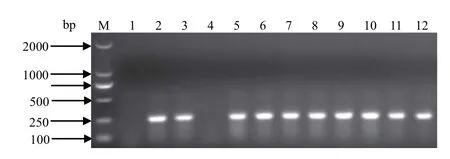
图1 沙门菌的PCR鉴定结果Fig. 1 Identifi cation of Salmonella by PCR amplifi cation
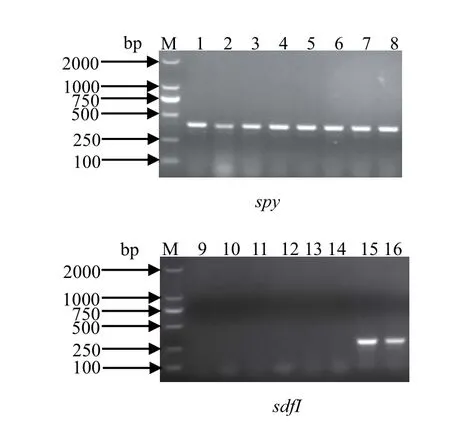
图2 沙门菌血清型鉴定结果Fig. 2 Identifi cation of Salmonella serotype by PCR
2.3 毒力基因检测 多重PCR和单基因PCR对48株沙门菌毒力基因的检测结果一致。检测结果显示,sopE基因分布率最低,仅有25%;其余15个毒力基因分布广泛,分别是:hilA(100%)、spiA(100%)、invA(100%)、ssrA(97.92%)、ssaR(100%)、spiC(100%)、sifA(100%)、mgtB(100%)、misL(100%)、shdA(100%)、siiD(97.92%)、pipA(100%)、pipB(100%)、sopB(100%)、pagN(100%)(表2)。
2.4 LD50测定 结果显示,临床分离株1-7的LD50分别为:1.26×104、1.26×104、5.01×104、5.01×104、5.01×104、1.26×105、2.00×105CFU(表3)。

表2 沙门菌毒力基因分布Table 2 Distribution of virulence genes in Salmonella
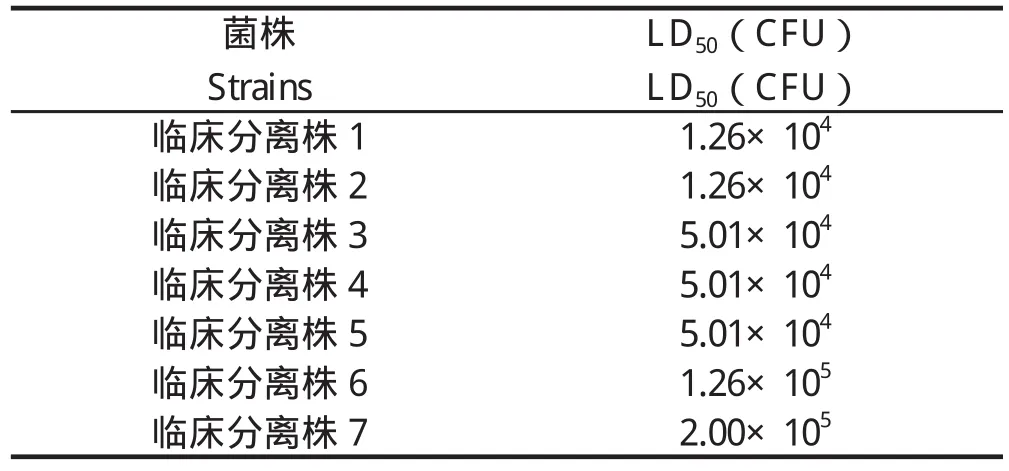
表3 沙门菌LD50测定Table 3 Salmonella LD50 determination
2.4 沙门菌耐药性检测 48株沙门菌对克林霉素、利福平、红霉素、四环素、新霉素、复方新诺明、大观霉素、阿奇霉素、氨 青霉素、氯霉素、头孢拉定、头孢噻吩、丙氟哌酸、菌必治的耐药性分别为100%、100%、97.92%、79.17%、62.5%、58.33%、56.25%、54.16%、47.92%、35.42%、25%、22.92%、22.92%、8.33%。
3讨论
沙门菌病是危害十分严重的人畜共患病,对人和动物都有不同程度的致病力。2010年以来,全球每年约有100万沙门菌感染病例,且有继续上升的趋势[10]。在美国和欧盟一些国家,沙门菌引起的食源性疾病高居首位,严重威胁人类的公共安全,另一方面,沙门菌对畜牧业也造成了不可估量的损失,制约着畜牧业的发展。
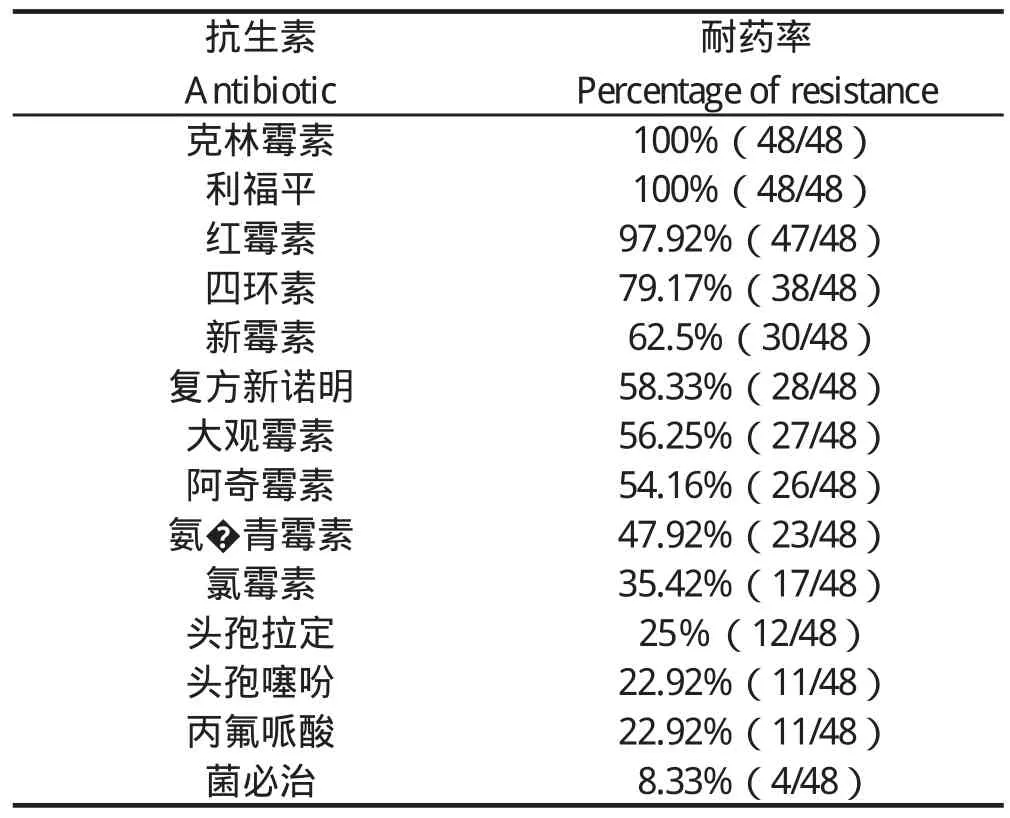
表4 沙门菌耐药性检测结果Table 4 Antibiotic sensitivity of Salmonella isolates
研究报道显示沙门菌血清型约有2500种,中国约有290种血清型[11-12]。本研究采用增菌、选择性培养基筛选、PCR鉴定的方法分析沙门菌在华东地区养殖场的分布情况。结果表明,华东地区养殖场中沙门菌的分离率高达16.84%;分离的菌株中,鼠伤寒沙门菌的流行是最为普遍的,约64.58%;肠炎沙门菌约6.25%;其他约29.17%;鸡白痢沙门菌、鸡伤寒沙门菌未分离到。查华等[13]2010~2012年分离到的沙门菌中,鸡白痢沙门菌为优势菌,说明华东地区流行的沙门菌血清型可能随着时间发生了改变,并且不同地区不同养殖场可能存在不同血清型沙门菌的流行。
目前已在不同血清型沙门菌中发现了23个毒力岛[14],分布在这些毒力岛上的毒力基因与沙门菌的致病性密切相关。因此,检测沙门菌的毒力基因分布,有助于分析沙门菌的致病力强弱。本研究选取沙门菌常见的毒力基因进行检测,结果显示大部分毒力基因均在沙门菌中广泛分布,提示沙门菌分离株毒力较强。另外,我们选取的7株临床分离株LD50均在1.26×104~2.00×105CFU之间,发病及死亡速度快,对小鼠具有较强毒力。
近年来,越来越多的沙门菌已成为多重耐药菌[15-18]。本研究采用纸片扩散法检测临床分离的沙门菌的耐药性。结果表明,沙门菌分离株对多数抗生素耐药,其中克林霉素、利福平的耐药率高达100%,耐药性十分严重,且各菌株均存在不同程度的多重耐药,这与李郁[19]、李茂辉[20]、蹇慧[21]等的研究结果一致。因此,针对细菌病的防控和治疗,必须合理地使用抗生素,否则,不仅难以控制细菌流行,反而极有可能导致超级细菌的出现,这将会对整个畜禽养殖产业,乃至人类食品的安全产生巨大威胁。
