全悬浮驯化MDBK细胞应用于牛病毒性腹泻、牛传染性鼻气管炎二联灭活疫苗的效果评估
2022-12-08杨青春刘国英范秀丽王秉昆李晓燕田志辉赵丽霞宋庆庆
杨青春,徐 凌,刘国英,范秀丽,王秉昆,王 凯,李晓燕 ,李 超,田志辉,陈 坚,赵丽霞,宋庆庆
(1.金宇保灵生物药品有限公司,内蒙古 呼和浩特 010030;2. 内蒙古医科大学附属医院,内蒙古 呼和浩特 010050)
牛病毒性腹泻(Bovine viral diarrhea,BVD)和牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR)是严重危害牛群健康的病毒性传染病,给养殖业带来很大危害[1-6]。研究发现,牛病毒性腹泻病毒(BVDV)和牛传染性鼻气管炎病毒(IBRV)共同感染健康细胞与只感染1种病毒相比会加剧细胞凋亡速度,因此,研发一种新型牛病毒性腹泻和牛传染性鼻气管炎(Bovine viral diarrhea and bovine rhinotracheitis,BVDV-IBRV)二联苗非常重要[7-8]。
传统贴壁细胞规模化培养病毒主要采用转瓶、细胞工厂或者微载体细胞培养方法,但是转瓶和细胞工厂存在工艺复杂、容易污染、批间差大、生产成本高、效率低下等诸多问题[9],微载体技术虽然提高了单位面积的细胞密度,但是也存在逐级放大困难、生产成本高等局限性[10]。所以能够驯化出1株全悬浮培养牛肾细胞(Madin-Darby bovine kidney cell,MDBK),在反应器中实现规模化培养BVDV和IBRV,不仅解决上述传统工艺中的诸多技术难题,而且能够节约成本、提高细胞饲养密度和病毒滴度,通过反应器逐级放大的工艺技术,实现病毒抗原生产的自动化,而且该技术也是目前规模化疫苗生产领域的前沿技术[11-12]。
本试验旨在驯化1株全悬浮无血清培养MDBK细胞株,在此基础上,采用反应器逐级放大模式生产BVDV和IBRV,制备BVDV-IBRV二联灭活苗,并通过免疫不同年龄阶段的黑白花奶牛,检测血清中BVDV和IBRV中和抗体效价,评价疫苗的免疫效果。
1 材料与方法
1.1 材料
1.1.1 细胞与种毒 MDBK细胞、BVDV(NMG株)和IBRV(LY株),均购自金宇保灵生物药品有限公司。
1.1.2 主要试剂 新生牛血清(NBS),购自金源康生物科技有限公司;DMEM干粉培养基和胰酶,均购自Gibco公司;低血清和无血清CD干粉培养基,均购自建顺生物科技有限公司。
1.1.3 主要仪器设备 B2-生物安全柜,香港力申发展有限公司产品;IC1000自动细胞计数仪,Countstar公司产品;二氧化碳恒温培养箱,Thermo公司产品;ISF1-XC恒温振荡培养箱,德国阿道夫科耐公司产品;XDS-1B倒置显微镜,卡萨帝公司产品;DASGIP四联平行反应器(5 L),Eppendorf(德国)公司产品;60 L和500 L生物反应器,均为北京清大天一科技有限公司产品。
1.2 MDBK低血清全悬浮细胞驯化
1.2.1 MDBK贴壁细胞降血清驯化 取对数生长期的MDBK贴壁细胞,按照常规方法连续传代,并将正常的MDBK贴壁细胞培养基(含10%新生牛血清的DMEM培养基)逐步按照低血清培养液(含3% 新生牛血清的CD培养基)含量占30%、50%和80%进行替换,期间观察细胞的生长情况,待细胞适应该密度后,才能再次提高低血清培养液的含量,直至最终全部替换为低血清培养液,并且保证细胞能连续稳定传代。
1.2.2 MDBK低血清细胞悬浮驯化 将1.2.1中驯化的贴壁细胞,经胰酶消化为单细胞悬液,用低血清培养液调整细胞密度为1×106个/mL,于37 ℃、5%CO2恒温摇床100~110 r/min培养,培养过程中会有细胞死亡,需要将1.2.1中驯化的细胞再次富集,直到悬浮细胞能够连续稳定传代,该细胞株即为MDBK低血清悬浮细胞。
1.2.3 MDBK无血清细胞悬浮驯化 将1.2.2中的细胞1 000 r/min 离心5 min,弃上清,按照1.2.1中方法对低血清悬浮细胞进行无血清悬浮培养,替换培养期间保证细胞能连续稳定传代,最终全部替换为无血清CD培养基,然后将细胞悬液通过70 μm滤膜截留细胞团块,继续培养,反复过滤培养,直到细胞结团缓解后再更换为40 μm滤膜,重复上述步骤,直至得到MDBK无血清全悬浮培养细胞株。
1.3 MDBK无血清悬浮株初始接种密度的确定 将1.2.3中获得的MDBK无血清悬浮细胞株离心,使用无血清CD培养基调整细胞密度为0.25×106、0.50×106、0.75×106个/mL 和1.00×106个/mL,置于37 ℃、5% CO2恒温摇床,100~110 r/min培养,每天记录细胞数量和细胞活力,直到细胞活力显著下降,确定细胞初始接种密度。
1.4 MDBK无血清全悬浮细胞连续传代 将1.2.3中获得的MDBK无血清悬浮细胞株离心后,使用无血清CD培养基调整初始密度为1.3中确定的密度,置于37 ℃、5%CO2恒温摇床,100~110 r/min培养48 h后,连续传代,每次传代初始密度均相同,记录细胞数量和细胞活力。
1.5 MDBK扩大培养与BVDV和IBRV的产毒
1.5.1 MDBK细胞逐级放大培养 将MDBK无血清悬浮细胞株用无血清CD培养基调整细胞密度为1.0×106个/mL,共8 L悬液,分别打入2个5 L反应器中,调节培养条件为温度37 ℃,溶氧40%~60%,pH 7.0~7.2,转速40~60 r/min,每天取样观察细胞数量和细胞活力,待细胞密度为8.0×106~8.2×106个/mL,活力为95%以上时,将培养细胞逐级放大于60~500 L反应器中。
1.5.2 BVDV和IBRV的接毒 (1)MDBK悬浮细胞接毒:取培养好的悬浮细胞加入到60 L反应器中,调整细胞密度为2×106个/mL,终体积为50 L,按照1%浓度分别接入BVDV和IBRV病毒液,培养条件同1.5.1,按照相同的方法将细胞扩大培养到500 L,接入BVDV和IBRV病毒液,取培养液加入4%的台盼蓝染色,观察并计算细胞活力,待细胞活力下降到60%~70%后,收获病毒液。(2)MDBK贴壁细胞接毒:将培养48 h的长成单层的MDBK细胞弃掉培养液后,更换含有2%新生牛血清的DMEM培养基,分别按照1.5%和2.0%的浓度分别接入BVDV和IBRV病毒液,待细胞病变达到80%以上时收获病毒液。
1.5.3 MDBK贴壁细胞和悬浮细胞培养BVDV和IBRV病毒滴度的测定 将收获的所有病毒样品用无血清DMEM培养基进行10倍梯度(1×10-1~1×10-7)稀释,将1×10-4~1×10-7稀释度的样品按0.1 mL/孔加入96孔板中,每个浓度做8个重复,同时设置对照组,即只加无血清DMEM培养基。将上述加入液体的孔均同步铺入MDBK贴壁细胞悬液0.1 mL,细胞密度为2×106个/mL,于37 ℃、5% CO2培养箱中培养并观察,记录有细胞病变的孔,按照Reed-Muench方法[13]计算BVDV和IBRV病毒滴度。
1.6 BVDV和IBRV二联苗免疫攻毒保护 将反应器收获的BVDV和IBRV病毒液制备成二联苗,按照2.00、1.00、0.50 mL/头和0.25 mL/头共4个剂量免疫健康易感牛,每个剂量组各颈部肌内免疫10头牛,一免后21 d以相同剂量进行二免,间隔14 d采血后攻毒,设置10头牛作为攻毒对照组(BVDV和IBRV分别攻毒,各攻5头),攻毒使用BVDV的病毒含量为3.00 lgTCID50/mL,IBRV的病毒含量为7.50 lgTCID50/mL,每种病毒分别按照10 mL滴鼻,攻毒结束后连续观察14 d,每日测定体温并采集鼻拭子检测排毒情况,按照1.6.1和1.6.2中BVD和IBR发病标准、评价动物发病情况。
1.6.1 BVD发病判定标准 体温升高到40 ℃以上,持续至少2 d;取攻毒后8~10 d的鼻拭子进行PCR检测,至少1 d的鼻拭子呈现BVDV核酸阳性,满足以上情况判定为发病;否则判定为未发病。
1.6.2 IBR发病判定标准 体温升高到40 ℃以上,持续至少2 d;取攻毒后8~10 d的鼻拭子进行PCR检测,至少1 d的鼻拭子呈现IBRV核酸阳性,满足以上情况判定为发病;否则判定为未发病。
1.7 BVDV和IBRV二联苗临床免疫效果评价 将反应器收获的BVDV和IBRV病毒液制备成二联苗,选择不同日龄阶段的牛只,包括犊牛(1~6月龄)、后备母牛(6~24月龄)和成年母牛(24月龄以上)各30头,分别作为犊牛免疫组、后备母牛免疫组和成年母牛免疫组,将以上各组动物首次免疫,每头牛2 mL,首免21 d后进行二免,间隔14 d后采集血清,另外随机选择不同日龄内未免疫牛,共采集30头牛血清作为空白对照组,根据参考文献[14]检测上述血清的BVDV和IBRV中和抗体效价。
1.8 统计分析 试验结果以“平均值±标准差”方式表示。采用 SPSS 22.0软件对数据进行统计分析,使用方差分析法进行差异显著性检验。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 MDBK低血清全悬浮细胞驯化 MDBK贴壁细胞由血清浓度为10%逐步降低为3%,再通过含3%血清的CD培养基驯化为1株能够稳定传代的低血清MDBK悬浮株,细胞状态如图1A所示,说明该细胞适应了低血清CD培养基,虽然结团率比较高,但是细胞生长速度较快,细胞状态较好。为了获得MDBK无血清悬浮株,由低血清培养液逐步替换为无血清悬浮培养液,再通过层层过滤筛选出了结团率低并能稳定传代的MDBK无血清悬浮株,其对数期细胞状态如图1B所示,该细胞株为分散的单个细胞,形态近似圆形、大小均一,胞质均匀透明,细胞边界明显,结团率明显降低。

图1 MDBK细胞逐步降血清驯化过程中细胞生长情况
2.2 MDBK无血清悬浮株初始接种密度的确定 MDBK无血清悬浮细胞4种起始密度相关的生长曲线如图2所示,若初始接种密度为0.25×106个/mL,细胞无法快速进入对数生长期,影响后期细胞生长速度;若初始接种密度为0.50×106个/mL和0.75×106个/mL,细胞均能正常进入对数期,而且细胞活力保持在90%并且可维持144 h以上;若起始接种密度为1.00×106个/mL,细胞培养至4 d后活力开始大幅下降,所以综合考虑,细胞最适接种密度在0.50×106~0.75×106个/mL,不得低于0.50×106个/mL。
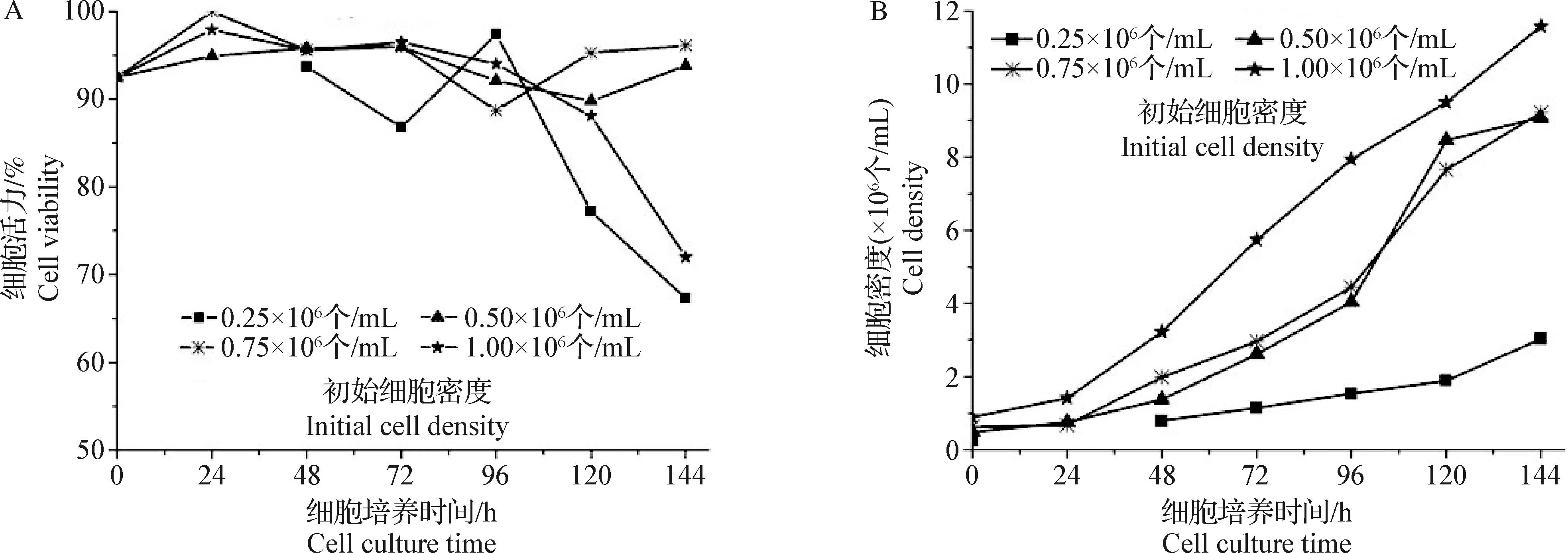
图2 MDBK细胞连续培养细胞活力和细胞密度
2.3 MDBK无血清全悬浮细胞连续传代 在MDBK无血清悬浮细胞接种密度为0.50×106个/mL基础上,培养2 d后传代,并连续传代10代以上,培养过程中细胞密度和活力如图3所示,呈现非常规律的细胞密度曲线,细胞活力维持在较高水平,并且每次传代后,细胞都能很快恢复生长速度,说明该MDBK无血清细胞悬浮株在初始密度为0.50×106个/mL时能够稳定连续传代。

图3 MDBK连续传代细胞密度和细胞活力
在连续放大培养过程中,细胞大小均一、形态近圆形、细胞透亮、状态良好,如图4所示,反应器中的细胞生长状态要好于摇瓶,主要由于反应器对于O2、CO2浓度和pH控制精度较高,能为细胞提供非常稳定的培养环境。

图4 MDBK细胞扩大培养前后细胞状态对比
2.4 MDBK扩大培养与BVDV和IBRV的产毒
2.4.1 MDBK扩大培养及BVDV和IBRV接毒 将状态良好的500 L MDBK悬浮细胞分别接种1% 的IBRV和BVDV病毒,培养3 d和5 d后,于显微镜下观察细胞状态,如图5所示,可以看出细胞界限模糊,透光度下降,台盼蓝染色后,死亡细胞增多,细胞活力明显下降,下降原因是病毒在细胞中大量增殖,造成细胞病变甚至死亡,说明这2种病毒能够侵染MDBK悬浮细胞。

图5 MDBK细胞扩大培养接毒后细胞状态
2.4.2 MDBK贴壁细胞和悬浮细胞培养BVDV和IBRV病毒滴度的测定 向贴壁MDBK细胞、60 L MDBK悬浮细胞以及扩大培养的500 L MDBK悬浮细胞分别接种BVDV和IBRV,测定收获病毒液的病毒滴度,结果如表1所示,60 L悬浮细胞产毒量几乎与贴壁细胞相同,而500 L扩大培养的病毒含量略微下降,主要原因可能是扩大细胞培养规模时,反应器控制精密度下降导致细胞活力略微下降。综上所述,MDBK悬浮细胞可以适应BVDV和IBRV病毒增殖。

表1 BVDV和IBRV在MDBK贴壁和悬浮细胞病毒滴度
2.5 BVDV和IBRV二联苗免疫攻毒保护 结果如表2所示,攻毒对照组中牛只BVDV和IBRV抗体水平均低于1∶2,攻毒后每头牛均出现了IBR和BVD的症状,发病率达100%,说明分别使用病毒含量为3.00 lgTCID50/mL BVDV和7.50 lgTCID50/mL IBRV的活病毒液10 mL感染牛能致其个体发病。免疫剂量为1.00 mL/头组中,BVDV攻毒结果显示仅有1头牛发病,4头牛未发病,免疫保护率为80%;IBRV攻毒结果显示,5头牛均未发病,免疫保护率为100%。所有免疫攻毒牛中和抗体结果显示,BVDV中和抗体效价≥1∶128的共有13头,攻毒后均未发病,免疫保护率为100%;IBRV中和抗体效价≥1∶64的共有14头,攻毒后均未发病,免疫保护率为100%,说明BVDV和IBRV二联苗攻毒保护和中和抗体滴度存在线性关系,临床可以应用抗体水平检测评价疫苗的免疫效果。

表2 BVDV和IBRV血清学与免疫攻毒保护的相关性
2.6 BVDV-IBRV 二联苗临床免疫效果评价 免疫组牛群二免后14 d,对不同年龄段的牛采集血清,并对样本中BVDV和IBRV中和抗体进行检测,中和抗体效价的平均值如表3所示,后备母牛免疫组和成年母牛免疫组IBRV中和抗体效价高于空白对照组,差异极显著(P<0.01),犊牛免疫组IBRV抗体效价显著高于空白对照组(P<0.05);各免疫组中BVDV中和抗体效价均极显著高于空白对照组(P<0.01),所以由BVDV-IBRV二联苗行业标准确定BVDV和IBRV中和抗体效价均能够达到免疫保护效果,IBRV免疫保护效果与奶牛的日龄有关,日龄较小的奶牛其免疫保护效果较差;而BVDV免疫保护效果与奶牛日龄关系不大。

表3 二免后奶牛群BVDV和IBRV的中和抗体效价
3 讨论
通过悬浮培养工艺制备抗原是未来生产兽用灭活疫苗主要的工艺流程,也是能够制备出优质、高滴度病毒抗原的主要工艺手段。但是,目前尚未找到1株能够适应BVDV和IBRV增殖的敏感悬浮细胞[15-16],故本试验通过贴壁-贴壁降血清-悬浮降血清-悬浮无血清3个过程[14],将对病毒敏感的MDBK贴壁细胞逐步适应无血清悬浮培养环境,最终获得了1株MDBK无血清悬浮细胞株,该细胞株生长速度非常快,在细胞密度为0.50×106个/mL的基础上,MDBK细胞传代时间为48 h,而且在漫长驯化过程中依旧没有改变细胞对BVDV和IBRV敏感的遗传特性,该细胞为大规模生产BVDV和IBRV提供了有利条件,实现抗原生产自动化,也对防控牛群中BVDV和IBRV隐形感染具有非常重大的意义。
MDBK悬浮株在由摇瓶逐级放大到500 L反应器过程中,生长稳定。按照1%的接毒剂量接入病毒后,能够稳定收获病毒液,但病毒收获时间需要摸索,收获太早病毒产生量未达到峰值,太晚病毒外壳会裂解、病毒失活,可以通过检测不同时间段病毒滴度,确认收获时间和收获时细胞活力[12]。另外,细胞状态好坏也与病毒滴度呈正相关,由于反应器自动化调节精度高,所以通过反应器制备抗原滴度明显比摇瓶高5~10倍[17]。另外悬浮培养的病毒滴度与传统贴壁工艺差距不大,而且反应器具有操作工艺简单、批间差异小、生产成本低、生产效率高、污染概率低等优点,所以反应器规模化制备病毒抗原可以替代传统贴壁工艺,也是未来疫苗工艺的重要发展趋势[18]。
综合BVDV-IBRV二联灭活疫苗的血清学和攻毒保护试验结果分析显示,对80%牛起到保护作用的BVDV中和抗体效价应不低于1∶128,对80%的牛起到保护作用的IBRV抗体效价应不低于1∶64,所以牛群BVDV和IBRV中和抗体分别≥1∶128和≥1∶64就可以保证免疫后动物能够有效地抵抗强毒攻击,这也可以为今后免疫持续期研究及疫苗免疫效果评价提供重要的数据参考。另外,相关研究也表明,高滴度的BVDV中和抗体能够起到有效保护效果[19]。但是不同年龄段奶牛在接种BVDV-IBRV二联灭活苗后,BVDV中和抗体效价水平一致,均达到较高的抗体滴度,对于IBRV抗体效价,犊牛抗体水平为1∶68,明显低于后备母牛和成年母牛,但也可以起到有一定的免疫保护作用,为了保证犊牛免疫保护效果,需要犊牛群多次接种以提高中和抗体效价。
本试验制备的BVDV-IBRV二联灭活疫苗能够有效防控我国BVD和IBR的传播和流行,为更好促进养牛业健康和快速发展提供了有力的技术支持。
