BMP-7/Smad1/5/8 信号通路在肾缺血后处理减轻大鼠肾缺血再灌注损伤中的作用*
2021-03-06徐先知黄元宏夏安周
张 舒,李 然,徐先知,黄元宏,夏安周
徐州医科大学药理学教研室,徐州 221004
急性肾损伤(acute kidney diseases,AKI)是临床常见的急危重症,具有较高发病率和死亡率,并可能参与慢性肾脏疾病的发生和发展[1]。肾缺血再灌注损伤(ischemia-reperfusion injury,IRI)是引起AKI 最常见的原因,在临床上常见于休克后微循环再通、肾移植、弥散性血管内凝血等[2]手术过程中,严重时可引起急性肾功能衰竭。因此,如何减轻肾缺血再灌注损伤一直是肾脏病领域的研究热点。
缺血后处理(ischemic postconditioning,IPostC)是近年发现的一种重要内源性保护机制,即长时间缺血后再灌注前短时间内反复短暂再缺血处理,可明显减轻缺血组织的缺血-再灌注损伤。多项研究已经证实,肾IPostC 对肾脏缺血再灌损伤具有明显的保护作用[3],但其确切机制仍不十分清楚。骨形态发生蛋白-7(bone morphorgenetic protein-7,BMP-7)在肾脏发育以及急、慢性肾脏损伤修复过程中起着重要的作用[4]。Smads 蛋白家族是BMP 信号转导通路中重要的胞浆递质,有研究表明,BMP-7 的肾保护作用与激活Smad1/5/8 信号通路密切相关[5]。子宫敏感性相关基因-1(uterine sensitization associated gene-1,USAG-1)是肾脏中表达丰富的BMP-7 拮抗剂,有研究结果发现,USAG-1 与许多肾脏疾病的发生发展以及预后密切相关[6]。
本研究采用大鼠肾IRI 模型,观察肾IPostC 时肾组织中BMP-7/Smad1/5/8 信号通路活性以及BMP-7 拮抗剂USAG-1 表达的变化,初步探讨BMP-7/Smad1/5/8 信号通路在肾IPostC 减轻肾缺血再灌注损伤中的作用,为临床肾缺血再灌注损伤的防治提供理论基础和治疗策略。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年雄性Sprague-Dawley(SD)大鼠,体重200~250 g,购自山东济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2018 0003。
1.1.2 试剂 血肌酐(SCr)试剂盒(CO11-1)和尿素氮(BUN)试剂盒(CO13-2)购自南京建成生物有限公司;BMP-7 多克隆抗体(ab56023)和USAG-1 多克隆抗体(ab99340)购自英国ABCAM 公司;p-Smad1/5/8 单克隆抗体(13820P)购自美国CST 公司;GAPDH 单克隆抗体(TA-08)购自北京中杉生物技术有限公司;山羊抗小鼠荧光二抗(V926-32210)和山羊抗兔荧光二抗(V926-32211)购自微科曼得生物工程有限公司;TUNEL 试剂盒(一步法)(C1008)购于碧云天生物技术研究所。
1.2 方法
1.2.1 实验分组 SD 大鼠随机分为假手术组(sham组);缺血再灌注损伤组(IR 组);缺血后处理组(IPostC 组)。每组又按再灌注不同时间分成再灌注1.5、3、6、12、24 h 共五个时间点亚组。每组6 只大鼠。
1.2.2 动物模型的制备及取材 sham 组大鼠称重后腹腔注射10%水合氯醛麻醉(0.3~0.35 mL/100 g),麻醉后俯卧位固定于手术台架上,于大鼠左侧肋腰点下行纵向切口,充分暴露左侧肾脏,使用玻璃分针分离左侧肾脏肾蒂,60 min 后关腹缝合。IR 组手术方法基本同sham 组,分离左侧肾脏肾蒂后,夹闭左侧肾蒂60 min,然后松开动脉夹,制备肾脏缺血再灌注损伤模型。IPostC 组操作同IR 组,恢复灌注前给予6 个循环10 s 再灌注/10 s 缺血处理,然后恢复灌注。动物处死前腹主动脉采血3 mL,上下轻轻颠倒混匀3~5 次,4 ℃下3000 r·min-1离心15 min,吸取血清并分装,-80 ℃保存。动物处死取左肾,然后沿冠状面将其切成背、腹两个部分,腹面肾分装于冻存管,-80 ℃冻存备用(用于Western Blot),背侧面置于4%的多聚甲醛固定24 h 以上,后依次进行脱水、透明、浸蜡,制成石蜡包块,制备肾组织切片。
1.2.3 肾功能的测定 分别采用苦味酸比色法和脲酶-波氏显色法测定大鼠SCr 和BUN 水平,检测步骤按试剂盒说明书进行操作。
1.2.4 细胞凋亡检测 切片依次在二甲苯Ⅰ、二甲苯Ⅱ中各脱蜡5~10 min,分别加100%、95%、80%、70%乙醇各5 min,纯水2 min;滴加20 μg·mL-1不含DNase 的蛋白酶K,20 ℃~37 ℃反应15~30 min;PBS冲洗10 min×2 次;加免疫染色强力通透液(P0097),室温孵育5 min;PBS 冲洗10 min×2 次;在每个样品上加入50 μL 含TdT 酶、荧光标记液的TUNEL 检测液,37℃避光孵育60 min;PBS 冲洗10 min×2 次;DAPI 染色1 min;PBS 冲洗10 min×2 次;用抗荧光淬灭剂封片后于荧光显微镜下观察细胞凋亡。细胞核呈亮绿色荧光即阳性细胞,每个样本观察5 个互不重叠的高倍镜视野,凋亡细胞核数与总细胞核数之比即为肾小管上皮细胞凋亡指数(AI)。
1.2.5 蛋白免疫印迹检测 BMP-7、USAG-1、Smad1/5/8 蛋白表达按照RIPA∶PMSF∶磷酸酶抑制剂=100∶1∶1 的比例配制裂解液,按照裂解液(mL)∶组织重量(mg)=10∶1 的比例作冰浴匀浆;冰上裂解30 min后12000×g、4 ℃下离心15 min;吸取上清液至离心管中,并用BCA 蛋白测定试剂盒检测蛋白浓度;在测完浓度的蛋白样本中加入上样缓冲液×5,于沸水中变性5~10 min;取样品蛋白(60~80 μg)在10%SDS-聚丙烯酰胺凝胶上电泳,半干转至硝酸纤维素膜上,转膜后用3%BSA 封闭液于摇床上摇动2 h,加入BMP-7(1∶1000)、USAG-1(1∶1000)或p-Smad1/5/8(1∶1000)一抗,置于4 ℃摇床中过夜;第二天室温平衡30 min 后,Washing buffer 洗涤5 min×3 次,加入山羊抗兔IgG,稀释比例为1∶10000,避光下室温孵育2 h 后,Washing buffer 避光洗涤5 min×3 次,最后一次用PBS 避光洗膜,以去除残留的吐温;用滤纸吸干NC 膜上残留液体,激光成像系统扫描NC膜,将所得条带图像用Image J 软件进行灰度分析。以BMP-7、USAG-1、p-Smad1/5/8 与GAPDH 光密度的比值表示目的蛋白相对表达含量。
1.3 统计学处理
采用SPSS 13.0 统计软件作数据处理,所有数据以均数±标准差()表示,数据符合方差齐性的采用单因素方差分析(one-way ANOVA),多组间比较LSD 检验;若数据不符合方差齐性,则采用Dunnett’s T3 检验。假设检验水准按α=0.05 判定。P<0.05 表示差异有统计学意义。
2 结果
2.1 肾IPostC 对大鼠SCr 和BUN 含量影响
与sham 组相比,IR 组各时间点SCr 和BUN 的水平均明显增高,差异具有统计学意义(P<0.05);与IR 组各对应时间点相比,IPostC 组SCr 和BUN 的水平均显著降低,差异具有统计学意义(P<0.05)。见图1。
2.2 肾IPostC 对肾组织BMP-7 和USAG-1 蛋白表达的影响

图1 各时间点大鼠SCr(A)和BUN(B)比较(,n=6)
免疫印迹检测结果见图2。sham 组BMP-7 蛋白高表达;IR 组各时间点BMP-7 蛋白表达量均低于sham 组,差异具有统计学意义(P<0.05),且表达水平随再灌注时间延长而逐渐下降,再灌注6 h 水平最低,随后逐渐升高,再灌注24 h 仍低于sham 组水平;与IR 组对应时间点相比,IPostC 组各时间点BMP-7 表达均显著升高,差异均具有统计学意义(P<0.05),且呈现先升高后逐渐降低的双向变化趋势,其中3h 时间点升高最明显(图2A、B)。sham 组有少量USAG-1 蛋白表达;与sham 组相比,IR 组再灌注各时间点USAG-1 蛋白表达水平均明显升高,差异具有统计学意义(P<0.05),且随再灌注时间延长,其表达水平逐渐升高,再灌注6 h 达到高峰,随后逐渐降低,再灌注24 h 仍明显高于sham 组;与IR 组对应时间点相比,IPostC 组USAG-1 表达均显著降低,差异均具有统计学意义(P<0.05),见图2C、D。
2.3 肾IPostC 对肾组织p-Smad1/5/8 蛋白表达的影响
免疫印迹检测结果见图3。与sham 组相比,IR组24 h 时间点p-Smad1/5/8 蛋白表达有所下调,差异具有统计学意义(P<0.05);与IR 组相比,IPostC组p-Smad1/5/8 蛋白表达明显增加,差异具有统计学意义(P<0.05)。
2.4 肾IPostC 对细胞凋亡的影响
sham 组肾组织中仅见个别肾小管上皮细胞凋亡;与sham 组相比,IR 组再灌注12 h、24 h 肾小管上皮细胞的凋亡较多,AI 增高(P<0.05);与IR 组对应时间点相比,IPostC 组肾小管上皮细胞凋亡明显减少,AI 较低。结果见图4A、B。Pearson 相关分析结果显示,p-Smad1/5/8 和凋亡指数AI 存在显著负相关,相关系数r 为-0.855(P<0.05,见图4C)。
3 讨论

图2 肾IPostC 对大鼠肾组织BMP-7 和USAG-1 蛋白表达的影响(,n=3)

图3 肾IPostC 对肾组织p-Smad1/5/8 蛋白表达的影响(,n=3)
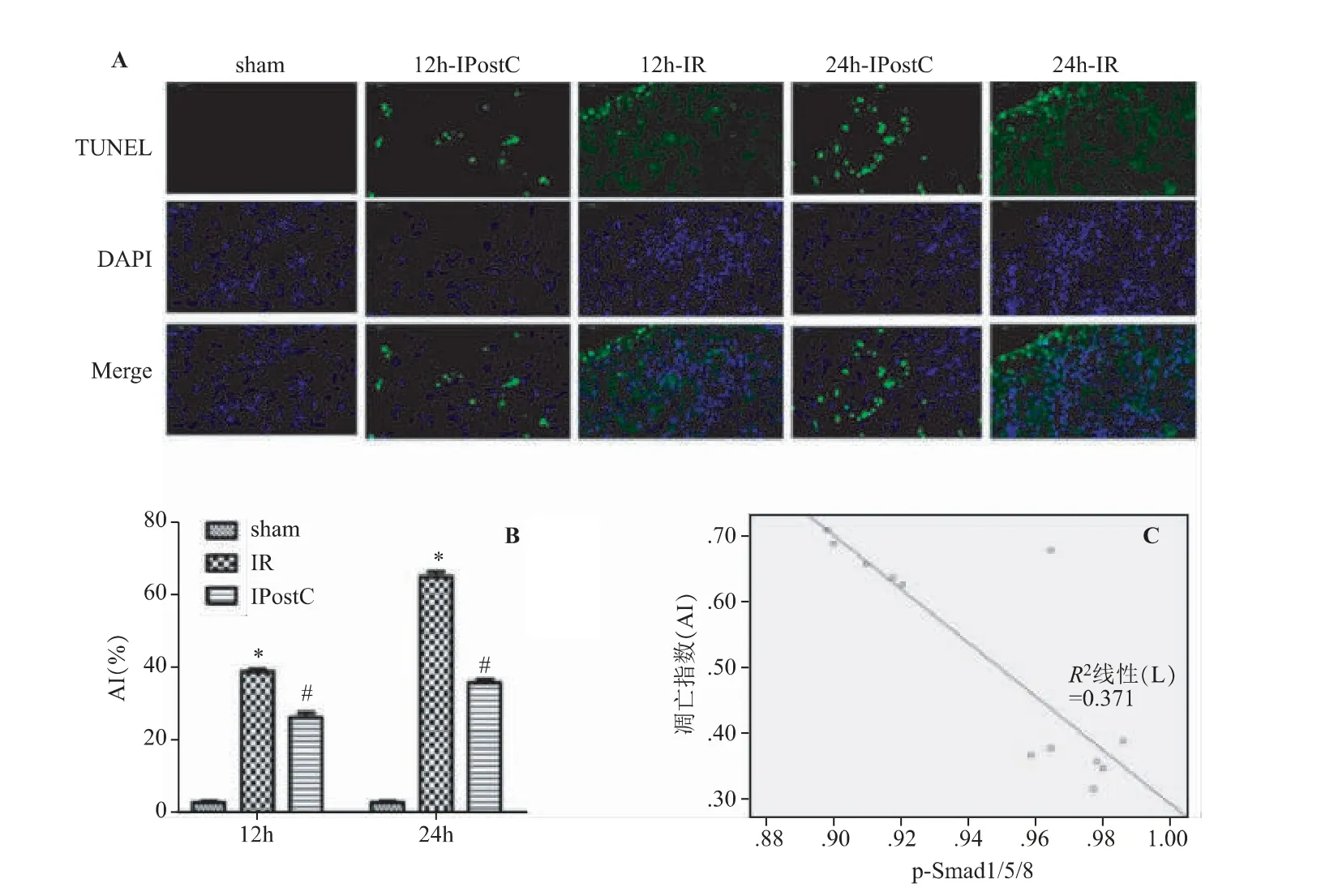
图4 肾IPostC 对细胞凋亡的影响(,n=3)
肾挤压伤、肾实质切开取石、肾肿瘤行部分肾切除术和肾脏移植等手术时,均可能发生IRI[2],严重时可导致急性肾功能衰竭。IPostC 对肾脏IRI 有一定的保护作用,但确切机制尚不清楚。因而建立理想的实验动物模型是研究肾IRI 发生机制以及IPostC 产生保护作用机制的关键环节。本实验结果显示,肾缺血60 min 后给予大鼠6 个循环10 s 再灌注/10 s 缺血处理,大鼠SCr 和BUN 的水平明显降低,进一步证实IPostC 可以有效地改善肾功能。对此解析肾IPostC 减轻肾IRI 似有如下原由:
BMP-7 是TGF-β1 超家族成员之一,在多种急、慢性肾脏疾病模型中,均发现肾组织中BMP-7及其受体的表达明显下调,且随着疾病进程而加重,当肾损伤恢复时BMP-7 的表达水平可以恢复到基准线水平[7]。当给予外源性BMP-7 则能减轻急、慢性肾损伤,加速肾功能的恢复和受损组织的修复[8]。本研究发现,IPostC 能明显提高了大鼠肾IRI 后肾组织BMP-7 蛋白表达,其中以再灌注3 h 和6 h 升高最为明显。故推测肾IPostC 可通过上调肾组织BMP-7 蛋白的表达而发挥其内源性保护作用。
近年来有关研究发现,内源性BMP-7 的活性不仅受其自身表达的影响,也受其拮抗剂的调节。另有研究发现,USAG-1 是大鼠肾中表达最丰富的BMP-7 特异性拮抗剂[7]。本实验显示,与BMP-7 变化趋势不同,IR 组USAG-1 蛋白的表达水平均随着再灌注时间的延长而上调。相反的是,与IR 组各对应时间点相比,IPostC 组USAG-1 蛋白的表达水平明显降低。由此判断,肾IPostC 除了上调BMP-7 表达外,还可通过下调肾组织BMP-7 内源性拮抗剂USAG-1 的表达,进而增强BMP-7 的生物学活性。
Smads 蛋白家族是BMP-7 信号转导通路中的重要胞浆递质,其中Smad1、Smad5 和Smad8 是胞内介导BMP 信号通路中重要的下游信号分子,在靶基因的转录中起着非常重要的作用。本实验结果表明,肾再灌注24 h 后,p-Smad1/5/8 表达水平明显低于sham 组,而IPostC 组p-Smad1/5/8 蛋白的表达量高于IR 组,这与BMP-7 变化趋势基本相一致。因此可以推测肾IPostC 的保护作用很可能与激活BMP-7/Smads 信号通路有关。
细胞凋亡是机体在受到生理和病理性刺激后,由基因控制的细胞自主有序的死亡。研究表明,肾小管上皮细胞的凋亡贯穿于急性肾IRI 修复整个过程,是肾小管上皮细胞死亡的最主要形式[9]。本实验采用TUNEL 染色检测细胞凋亡水平,结果显示,IR 组12h、24 h 时间点肾小管上皮细胞凋亡较多,AI 明显高于sham 组;与IR 组对应时间点相比,IPostC 组肾小管上皮细胞的凋亡明显减少,AI 较低。诸此表明,肾IPostC 可通过抑制肾小管上皮细胞凋亡来减轻肾IRI。此外,还对凋亡指数AI 和p-Smad1/5/8 蛋白表达水平作了相关性分析,结果显示,两者间存在显著的负相关性,提示Smad 蛋白信号转导可引起肾小管上皮细胞凋亡的变化。至于p-Smad1/5/8 蛋白是如何抑制肾小管上皮细胞的凋亡,尚需深入研究。
综上所述,本研究证实了肾IPostC 能够上调肾组织BMP-7 的表达,下调BMP-7 内源性拮抗剂USAG-1 的表达,进而通过激活BMP-7/Smad1/5/8信号通路来抑制肾小管上皮细胞凋亡,从而产生机体的内源性保护作用。
