UPLC-MS/MS 法同时检测人血清中5 种微量内源性激素*
2021-03-06刘紫薇朱怀军葛卫红
杨 娜,刘紫薇,王 敏,朱怀军,葛卫红**
1 南京大学医学院附属鼓楼医院药学部,南京 210008;2 中国药科大学,南京 210009
性激素检测是临床实验室检测项目中公认的难题,主要原因是其在血液中含量极低(通常在pmol·L-1水平)[1],且结构类似物众多[2],因此对方法的敏感度和特异度要求很高。在现阶段临床检测中免疫法多用于性激素的检测;但由于其易受其他内源性类固醇、脂质和基质效应的干扰,对血清中微量性激素测定的特异性和可靠性仍然存在疑惑。
在性激素检测中,雄激素、孕激素的检测对于临床包括多囊卵巢综合征[3]、不孕症[4]、高雄激素血症[5]等诸多疾病的诊断具有重要意义。然而,在临床研究中发现,传统免疫法用于高雄激素血症的差错率可高达1/3[3]。而质谱法由于其高灵敏度和特异性的优点,检测具有较高的准确性。本研究旨在建立快速、灵敏度高、稳定性好的UPLC-MS/MS 分析方法,用于同时检测人血清中包括睾酮(testosterone,T)、雄烯二酮(androstenedione,AD)、脱氢表雄酮(dehydroepiandrosterone,DHEA)、孕酮(progesterone,P)和17α-羟孕酮(17-α-hydoxy progesterone,17α-OHP)等在内的5 种内源性激素。本方法为临床血清样本的检测及相关疾病的诊断和研究提供了技术支持。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂 孕酮(P,纯度99.7%,批号:G130207)、17α-羟孕酮(17α-OHP,纯度99.5%,批号:G986202)、睾酮(T,纯度99.2%,批号:G157843)、雄烯二酮(AD,纯度99.3%,批号:G158946),均为德国DR.E 公司产品;脱氢表雄酮(DHEA,纯度99.9%,批号:00004099-176,美国ChromaDex);孕酮-d9[Pd9(IS),内标,纯度98%,批号:8-GBH-69-3,加拿大TRC 公司];盐酸羟胺(纯度99%,上海麦克林生化科技有限公司);叔丁基甲醚(阿拉丁公司);甲醇、乙腈(色谱纯,德国Merck 公司);纯化水。
1.1.2 主要仪器 ACQUITY UPLC I-Class/XEVO TQD 超高效液相质谱联用仪(美国Waters 公司)。
1.2 实验方法
1.2.1 色谱条件 Agilent ZORBAX Eclipse Plus Phenyl-Hexyl 色谱柱(2.1 mm×100 mm,3.5 μm);流动相:水相(A):0.1%甲酸水,有机相(B):乙腈(梯度洗脱程序:0.0~0.5min,40%B;0.5~3.0 min,40%~90%B;3.0~3.1 min,90%~40%B;3.1~5.0 min,40%B);柱温:40 ℃;流速:0.3 mL·min-1;整个运行时间:5 min;进样体积5 μL。
1.2.2 质谱条件 离子源:电喷雾离子源(ESI);正离子模式扫描;多重反应监测(MRM);毛细管电压为3.5 kV;脱溶剂气为氮气,脱溶剂温度为500 ℃,脱溶剂气流速为850 L·h-1;锥孔气流速为50 L·h-1;离子源温度为150 ℃;碰撞气为氩气;仪器工作站为MassLynx(version4.1)。各种相关离子见表1。
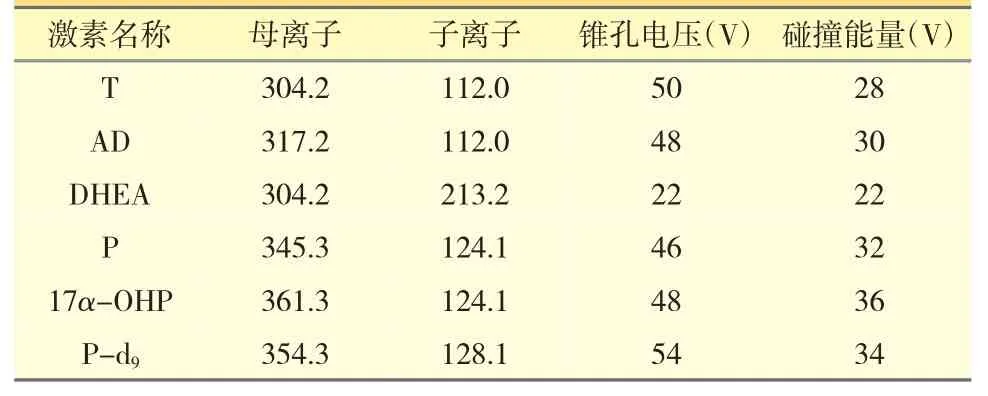
表1 MRM 模式离子参数
1.2.3 储备液和标准溶液配制 分别精密称取T、AD、DHEA、P、17α-OHP 对照品和同位素标记的内标P-d9(IS)粉末2 mg,置于10 mL 量瓶中,加入甲醇定容至刻度,颠倒摇匀配制成终浓度为200 μg·mL-1的储备液,-20 ℃储存。分别取各类激素储备液,依次用甲醇梯度稀释,分别配制成浓度为0.5、1、2、5、10、20、50、100、200、500、1000 ng·mL-1的激素混合标准溶液。取内标P-d9储备液,用甲醇溶液逐级稀释至10 ng·mL-1的内标溶液。
盐酸羟胺溶液的配制:精密称取盐酸羟胺适量,采用50%甲醇-水溶液(v/v),配制成浓度为100 mmol·L-1的盐酸羟胺溶液,置于-20 ℃储存。
1.2.4 空白血清的制备 取空白血清50 mL,按1%比例加入葡聚糖-活性炭,于37 ℃摇床振摇5 h 后4000 r·min-1离心15 min,得上清液于12000 r·min-1低温超速离心20min,取上层澄清液,即为空白血清。
1.2.5 血清样品的处理方法 取300 μL 血清样本,加入20 μL P-d9内标溶液(10 ng·mL-1)混匀,加入1.5 mL 甲基叔丁基醚溶液涡旋振荡10 min,并在4 ℃下12000 r·min-1离心5 min,转移上层有机相1.2 mL于真空浓缩装置中,40 ℃挥干。加入100 μL 盐酸羟胺溶液(100 mmol·L-1)于60 ℃水浴加热30 min 作衍生化。取出在冰浴静置,在4 ℃下12000 r·min-1离心5 min,转移上清液于进样瓶中,以5 μL 进样分析。
2 结果
2.1 分析方法优化
2.1.1 质谱条件优化 采用浓度为200 ng·mL-1的标准溶液,进行衍生化后,对T、AD、DHEA、P、17α-OHP 及内标的母离子、子离子、锥孔电压和碰撞能量进行逐一优化和确认,得到最佳的锥孔电压和碰撞能量。见表1。
通过对比峰强度,对离子源温度、脱溶剂气流量等进行逐步优化,使目标化合物具有最高灵敏度。5 种激素经衍生化处理后,极大提高了离子化效率,当进入质谱均能产生响应强度高且稳定性好的[M+H]+分子离子峰。
2.1.2 液相条件优化 分别采用甲醇和乙腈为有机相,进行梯度或等度洗脱条件的摸索,并对不同色谱柱的峰形进行对比考察。结果显示,以“1.2.1”色谱条件进行梯度洗脱,5 种激素和内标均显示良好的峰形,且具有较高灵敏度。本法在UPLC 液相系统下,分析时间为5 min,能够快速高效地分析目标雄激素和孕激素,达到较好的效果。
2.1.3 样品处理优化 采用葡聚糖-活性炭法能够高效去除人血清中内源性雌激素的干扰。血清样本前处理摸索试验发现蛋白沉淀法杂质干扰多,基质效应较高。液-液萃取法中叔丁基甲醚萃取法具有较好的提取回收率,目标激素的提取回收率变异均能控制在15%以内,并能保证较低的基质干扰。此外,本实验通过对衍生化的温度、时间、试剂浓度等进行优化,得到了理想的衍生化条件。
2.2 方法学验证
2.2.1 特异性 按“1.2.5”项下方法处理空白血清样本和加入各类激素对照品血清样本,如图1 所示。T、AD、DHEA、P、17α-OHP 和IS 的保留时间分别为2.04、1.99、1.92、2.55、1.98 和2.53 min。
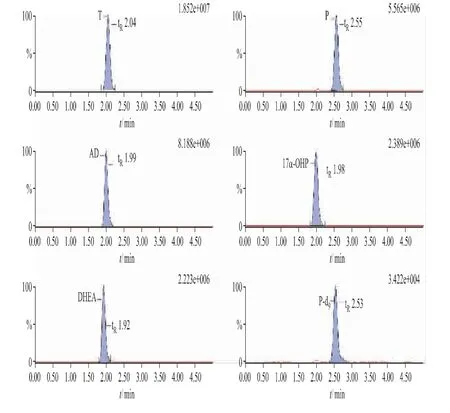
图1 UPLC-MS/MS 测定各激素及内标的典型色谱图
各待测物和内标峰形良好,空白血清在各激素离子通道下无干扰,各激素在该方法下特异性良好。
2.2.2 标准曲线和定量下限 取空白血清270 μL,分别加入含T、AD、DHEA、P、17α-OHP 混合标准溶液30 μL,使其血清中浓度分别为0.05、0.1、0.2、0.5、1、2、5、10、20、50、100 ng·mL-1,每个浓度3 个样本。按“1.2.5”项下方法处理样本,以检测目标激素峰面积和内标峰面积的比值为纵坐标Y,血清中各激素浓度为横坐标X(pg·mL-1),用加权最小二乘法计算回归方程(权重1/X)。得到各激素的标准曲线方程:T,Y=5.3×10-3X+0.13(r=0.9998);AD,Y=2.9×10-3X+0.081(r=0.9996);DHEA,Y=5.0×10-4X+0.029(r=0.9994);P,Y=1.7×10-3X-0.0085(r=0.9991);17α-OHP,Y=1.3×10-3X+0.013(r=0.9998)。
各激素在0.05~100 ng·mL-1范围内具有良好的线性,定量下限(LLOQ)均为50 pg·mL-1(S/N>10)。
2.2.3 精密度和准确度 取空白血清分别配制3 批含LLOQ,低、中、高浓度(0.05、0.1、2、80 ng·mL-1)的混合激素的血清样品,每个浓度平行6 份,按照“1.2.5”项下方法处理样本,分3 天连续检测,计算日内与日间精密度、准确度。由结果可知,精密度(RSD)与准确度(RE)均在15%以内,符合生物样本测定要求。见表2。
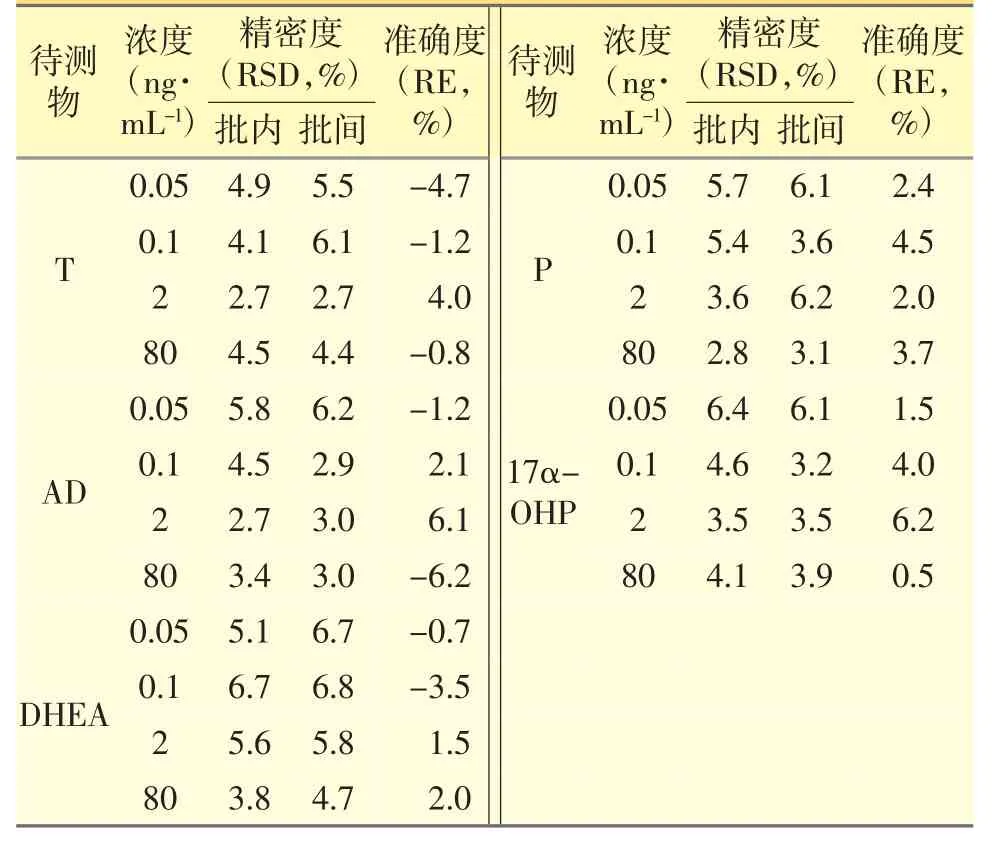
表2 精密度和准确度(n=6)
2.2.4 提取回收率和基质效应 配制含有终浓度为0.1、2、80 ng·mL-1混合激素的血清样本各6 份,按“1.2.5”项下方法处理血清样本,记录各激素峰面积A1和内标峰面积AIS1。另取空白血清,经甲基叔丁基醚萃取后、加入各激素混合标准溶液和内标溶液,处理后测得各激素峰面积A2和内标峰面积AIS2。取各激素混合标准溶液加入内标溶液后处理进样,测得各类激素的峰面积A3和内标峰面积AIS3。计算峰面积比值:f1=A1/AIS1,f2=A2/AIS2,求得同一浓度样本的比值平均值(f2)mean。计算相对提取回收率=f1/(f2)mean,并计算内标归一化基质因子=(A2/A3)/(AIS2/AIS3)及其RSD(%),结果见表3。
在5 种激素低、中、高浓度水平下,平均提取回收率在78.7%~106.8%,归一化基质因子在94.2~114.9。相对提取回收率和基质效应因子的RSD均<15%,符合生物样本定量分析要求。
2.2.5 稳定性 配制5 种激素低、中、高浓度(0.1、2、80 ng·mL-1)的血清样本,分别置于室温24 h、4 ℃自动进样盘放置24 h、反复冻融3 次、-70 ℃冷冻保存1 个月,每种处置方式每个浓度平行6 份,比较测定样本的精密度和准确度。结果显示,低、中、高浓度的精密度(RSD)和准确度(RE)均在±15%内,符合生物样本测定要求。

表3 提取回收率和基质效应(n=6)
2.2.6 实际血清样本分析 采用已建立的分析方法,对5 份血清样本进行检测,结果见表4。
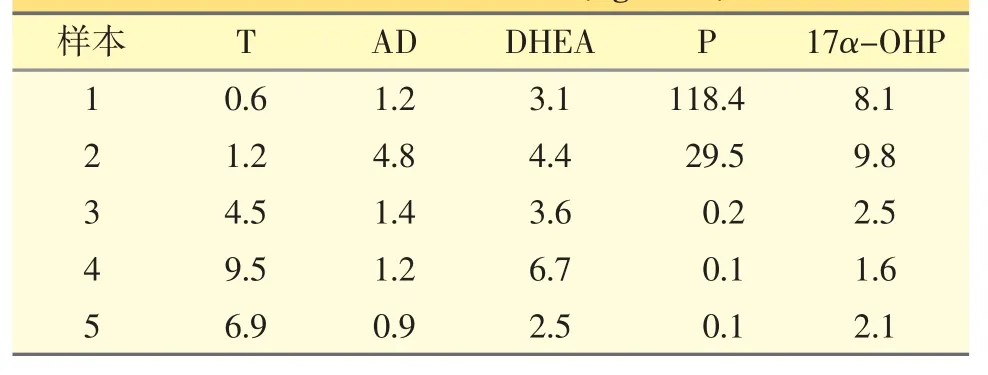
表4 血清样本的测定(ng·mL-1)
其中1、2 号样本为2 名怀孕女性,年龄分别为29、31 岁;3~5 号样本为3 名男性,年龄为24~36岁。由表4 可见,5 份血清样本中均可检测出不同浓度的T、AD、DHEA、P、17α-OHP,且存在明显个体差异。以上表明,本方法适用于临床血清样本中关键雄激素和孕激素的同时测定。
3 讨论
相比于免疫法,质谱法用于类固醇激素的测定具有很大优势。自20 世纪70 年代以来,质谱法被逐渐运用到类固醇激素的测定中[6]。其中,气相色谱-质谱联用法在激素测定领域的发展比液相色谱-质谱联用法更早[7]。研究证明,液相色谱-质谱联用法具有更高的选择性、灵敏度以及更加简单的前处理过程。然而,由于类固醇激素的结构特性,其在质谱中的离子化效率很低,常采用衍生化技术对其结构中的羟基、羰基等基团进行衍生化处理,以提高其在质谱中的离子化效率。其中,酰化衍生化常用于雌激素的测定[8]。
本研究通过盐酸羟胺肟化处理,极大增加了T、AD、DHEA、P、17α-OHP 在质谱中的离子化效率。该方法测定时间短(5 min),可同时定量5 种目标激素,且均为临床检测中用于肾上腺皮质增生、生殖功能障碍、高雄激素血症等疾病的关键检测品种,故本方法具有重要的临床应用价值。
研究表明,包含雌激素、孕激素和雄激素的性激素代谢网络是一个紧密关联的整体,以胆固醇为前体,首先经侧链缩短生成21 碳的孕激素,进一步去侧链代谢为19 碳的雄激素,再通过A 环芳香化生成18 碳雌激素。在肾上腺皮质功能相关疾病的状态下,孕激素和雄激素水平都显示出很大的改变。高雄激素血症被发现也可引起体内孕激素、雌激素水平的变化,同时引起不孕症的发生。传统的免疫检测法,受商品化试剂盒的影响,不能够全面、准确地了解不同个体性激素代谢的整体轮廓,故不能很好地提供个体化诊疗和用药服务。
本研究采用了UPLC-MS/MS 法结合衍生化技术建立了可快速、同时检测人血清中T、AD、DHEA、P 和17α-OHP 等5 种关键微量雄激素和孕激素的方法,结合本研究之前所建立的雌激素网络质谱测定方法[9],可对性激素代谢网络的整体定量描绘提供精准的服务,在疾病诊疗、发病风险分析和激素补充治疗的个体化策略制定中,具有一定的临床应用价值。
