高效液相色谱一测多评法测定酸枣仁中的2 个黄酮活性成分含量
2021-03-06李会军
倪 慧,李会军
中国药科大学天然药物活性组分与药效国家重点实验室,南京 210009
酸枣仁为鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chou 的干燥成熟种子[1]。黄酮类成分是酸枣仁的主要化学成分之一。在2015 年版《中国药典》中,酸枣仁“含量测定”项下黄酮类成分的检测指标为斯皮诺素。现代研究发现,除斯皮诺素外,酸枣仁中还含有6′′′-阿魏酰斯皮诺素这一含量较高、且具有较强生理活性的黄酮类成分。丁轲等[2]发现,在酸枣仁黄酮中抗氧化作用最强的组分是6′′′-阿魏酰斯皮诺素。宋伟等[3]通过3 种谱-效相关性分析方法,最终确认了6′′′-阿魏酰斯皮诺素是酸枣仁发挥解郁安神作用的有效成分之一。Qiao LD 等[4]发现,酸枣仁中的这2 种成分均能促进大鼠海马神经元中相关mRNA 的表达。因此,仅以斯皮诺素作为含量测定指标不能全面反映酸枣仁中黄酮类成分的内在质量,应该综合考虑斯皮诺素和6′′′-阿魏酰斯皮诺素等主要药理活性成分的含量,故酸枣仁的质量标准亟待修订提高。
“一测多评(QAMS)”法既符合中药多成分整体质量控制的要求,又解决了对照品缺乏、检测成本高的瓶颈问题[5],这已成为行业内认可度高、应用广泛的中药质量控制模式[6]。
据文献报道[7,8],酸枣仁的一测多评法,主要用于它的另一主要成分皂苷类的同时定量分析,或者采用特定的色谱条件,同时测定皂苷类和斯皮诺素的含量;而目前还没有酸枣仁主要黄酮类成分的QAMS 分析。故有必要建立酸枣仁中黄酮类成分的QAMS 质量控制方法,以全面评价酸枣仁的质量。
本研究建立以斯皮诺素为内参物、同步测定酸枣仁中斯皮诺素和6′′′-阿魏酰斯皮诺素2 个黄酮成分的一测多评法,并应用于29 批酸枣仁样品的含量测定中,以期能为酸枣仁药典标准的完善提供技术依据,进一步加强酸枣仁临床用药的安全有效性。
1 仪器与药品、试剂
Shimadzu LC-20A 高效液相色谱仪,包括LC-20AT 溶液传输单元,SIL-20A 自动进样器,SPD M20A 二极管阵列检测器,LC Solution 色谱工作站;Agilent 1260 高效液相色谱仪;Mettler Toledo ME104 电子天平;Sartorius BT125D 电子天平。
6′′′-阿魏酰斯皮诺素对照品(批号PS0477-0025,纯度>98%,成都普思生物科技股份有限公司);斯皮诺素对照品为本实验室自制,纯度>98%;乙醇、乙腈为色谱纯,其余试剂为分析纯;水为纯净水。
从河北、山东、陕西等酸枣仁主产地共收集了29 批药材(样品1~8,河北;样品9,安徽;样品10~17,山东;样品18~20、23,陕西;样品21~22,陕北;样品24~25,河南;样品26~27,山西;样品28,辽宁;样品29,甘肃),所有药材经中国药科大学刘慧娟老师鉴别为鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chou 的种子,样品保存于本校天然药物活性组分与药效国家重点实验室。
2 方法与结果
2.1 色谱条件与系统适应性
Shimadzu LC-20A 高效液相色谱仪;Shimadzu Inertsil ODS-3 色谱柱(4.6 mm×150 mm,5 μm);流动相:0.1%乙酸(A)-乙腈(B)(梯度洗脱:0~5 min,14%B,5~10min,14%~17%B,10~22min,17%~19%B,22~40 min,19%~19% B,40~42 min,19%~95% B);检测波长:335 nm;柱温:16 ℃;流速:1 mL·min-1;进样体积10 μL。色谱图见图1。
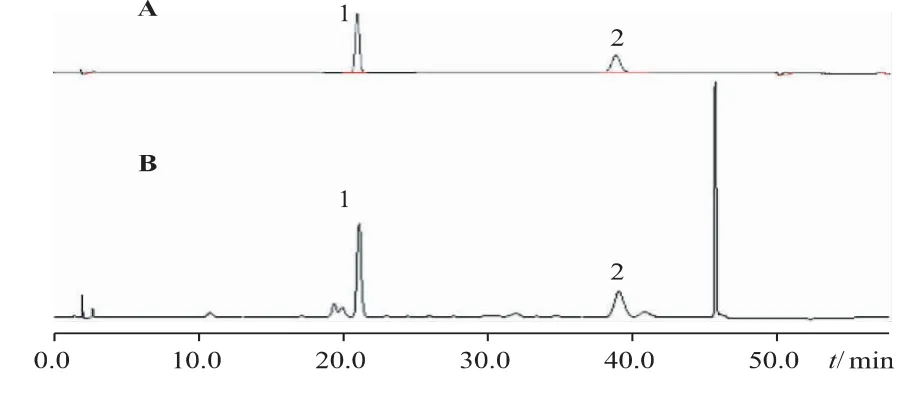
图1 酸枣仁对照品及样品高效液相色谱图
各色谱峰分离度>1.5,拖尾因子≈1.00,理论塔板数按6′′′-阿魏酰斯皮诺素峰计算不低于2000。
2.2 对照品溶液的制备
分别精密称取斯皮诺素对照品20.08 mg 和6′′′-阿魏酰斯皮诺素对照品10.04 mg,置20 mL 量瓶中,加甲醇溶解稀释至刻度,配制成质量浓度分别为1.004 mg·mL-1和0.502 mg·mL-1的混合溶液,即得1号混合对照品溶液;将该溶液分别稀释4/3、2、4、20、40、100 倍,制备得2 号~7 号混合对照品溶液。
2.3 供试品溶液的制备
取酸枣仁粉末(过四号筛)约1 g,精密称定,置索氏提取器中,加环己烷40 mL,加热回流3 h,弃去环己烷液,固体物挥去溶剂,转移至锥形瓶中,加入70%乙醇20 mL,称定重量,超声处理20 min,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 线性、检测限及定量限 分别精密吸取“2.2”项下7 个浓度的混合对照品溶液各10 μL,注入液相色谱仪,测定斯皮诺素和6′′′-阿魏酰斯皮诺素的峰面积。以质量浓度X(μg·mL-1)对峰面积Y(mAU)作线性回归处理,得到各成分的回归方程、r2及线性范围;同时,对混合对照品7 号逐级稀释,进样测定,各成分以信噪比为3 时的质量浓度为检测限,信噪比为10 时的质量浓度为定量限。由表1 的结果表明,2 个黄酮活性成分在较宽的质量浓度范围(100 倍)内有良好的线性,且有较高的灵敏度。
2.4.2 加样回收率试验 分别精密称取斯皮诺素对照品37.30 mg 和6′′′-阿魏酰斯皮诺素对照品11.45 mg,置50 mL 量瓶中,加甲醇溶解稀释至刻度,配制成质量浓度分别为0.7460 mg·mL-1和0.2290 mg·mL-1的混合对照品溶液。

表1 线性回归方程、检测限及定量限
平行称定0.5 g 样品9 份,置100 mL 具塞锥形瓶中。按照3 种不同浓度水平(低、中、高)将混合对照品溶液准确加入到每个具塞锥形瓶中,每个浓度平行3 份。取对照品的添加量分别为0.5 g 样品中对照品含量的80%(0.8 mL 混合对照品溶液)、100%(1.0 mL 混合对照品溶液)和120%(1.2 mL 混合对照品溶液),按照“2.3”项下方法制备供试品溶液。以对照品比较法计算各成分的测得量,并按照公式,计算各成分的加样回收率:
加样回收率=(测得量-样品含量)/加入量×100%
表2 结果显示,斯皮诺素和6′′′-阿魏酰斯皮诺素的加样回收率均在94%~106%,表明方法准确度良好。
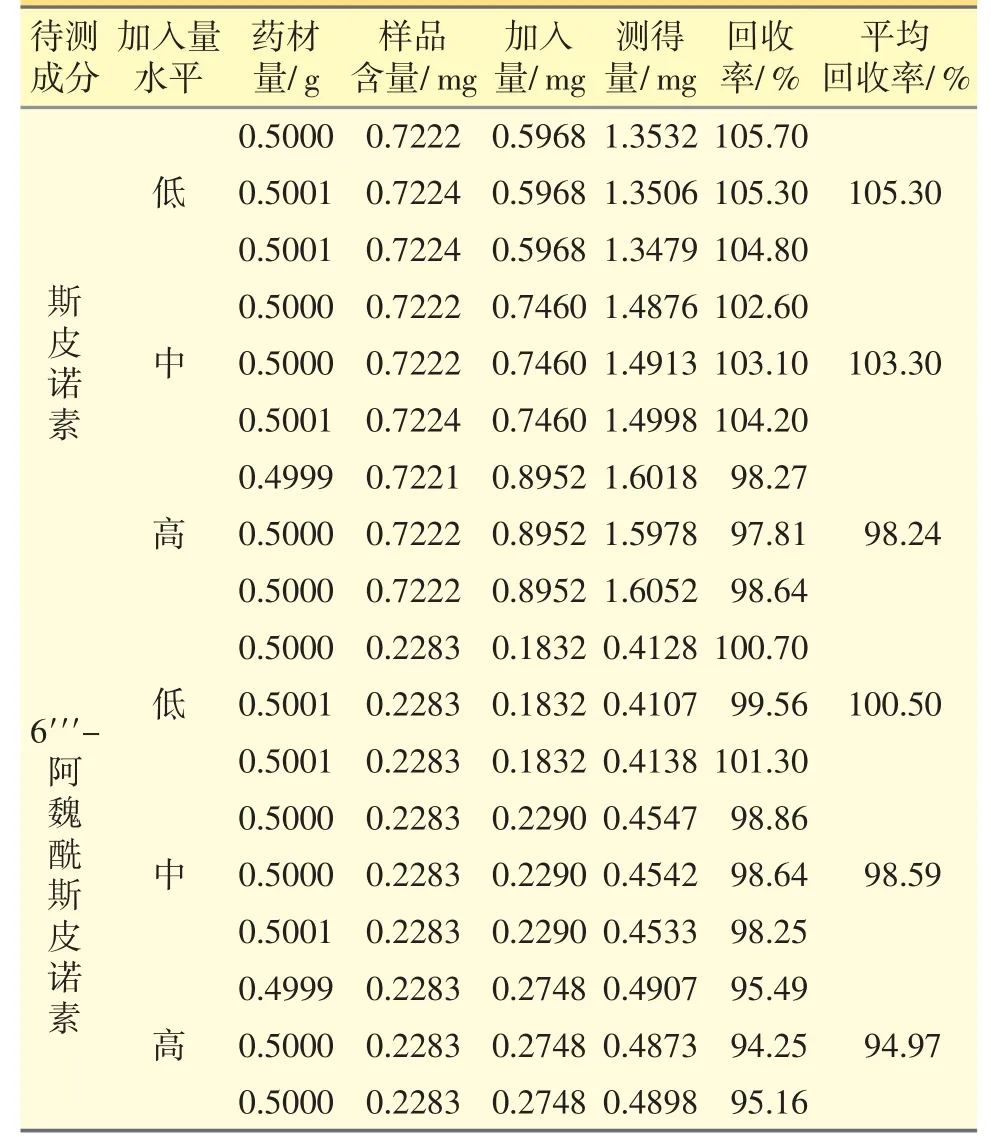
表2 加样回收率试验结果(n=3)
2.4.3 重复性试验 以高、中、低3 种浓度水平分别平行称量3 份样品(高水平称量为1.5 倍的原始称样量,中水平称量为1 倍的原始称样量,低水平称量为0.5 倍的原始称样量),按照“2.3”项下方法制备供试品溶液,分别进样10 μL,测定斯皮诺素和6′′′-阿魏酰斯皮诺素含量,计算RSD 值。斯皮诺素和6′′′-阿魏酰斯皮诺素在高、中、低3 种浓度水平下测得含量的RSD 均小于2%,方法的重复性良好。
2.4.4 稳定性试验 取同一份供试品溶液,分别于样品制备后0、2、4、6、8、12、18、24 h 进样,测定峰面积,计算RSD。测得斯皮诺素和6′′′-阿魏酰斯皮诺素峰面积的RSD 分别为0.26%和0.85%,表明酸枣仁的供试品溶液在24 h 内具有较好的稳定性。
2.5 相对校正因子的确定
2.5.1 相对校正因子的计算 以斯皮诺素为内参物,采用斜率校正法[9]计算6′′′-阿魏酰斯皮诺素的相对校正因子。将“2.2”项下制备的1 号~7 号混合对照品溶液进样,测定斯皮诺素和6′′′-阿魏酰斯皮诺素的线性回归方程,两者的线性斜率之比即为6′′′-阿魏酰斯皮诺素的相对校正因子(以f 表示)。
2.5.2 相对校正因子的耐用性
(1)不同仪器和不同色谱柱对相对校正因子的影响。试验采用3 种不同的色谱柱,分别在Shimadzu LC-20A 和Agilent 1260 液相色谱仪上对f进行测定。结果显示,在两种高效液相色谱仪上所测定的f 的RSD<3.3%;在同一仪器下3 种色谱柱测定的f 的RSD<4.3%,表明f 在不同高效液相色谱仪和不同色谱柱上的耐用性较好。见表3。
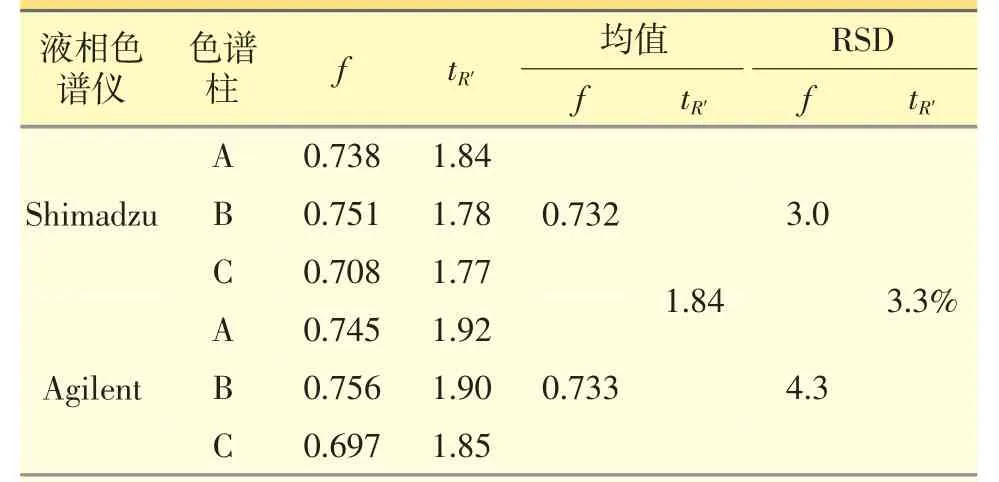
表3 不同仪器和不同色谱柱上测得的相对校正因子(f)和相对保留时间(tR′)
(2)不同流速和不同柱温对相对校正因子的影响。采用Shimadzu LC-20A 高效液相色谱仪和Shimadzu Inertsil ODS-3 色谱柱,分别测定在不同流速(0.9、1.0、1.1 mL·min-1)和不同柱温(14 ℃、16 ℃、18 ℃)下的f,计算RSD。测得的f 在不同流速和不同柱温下的RSD 分别为0.50%和0.34%,表明f 在流速0.9~1.1 mL·min-1和柱温14 ℃~18 ℃的耐用性良好。
2.5.3 相对校正因子的平均值 取以上考察的各色谱条件下的f 的平均值,作为6′′′-阿魏酰斯皮诺素相对于斯皮诺素的校正因子,最终确定为0.73。
2.6 待测成分色谱峰的定位
试验采用3 种不同的色谱柱,分别在Shimadzu LC-20A 和Agilent 1260 液相色谱仪上、测定2 个黄酮活性成分的保留时间。采用相对保留值法[9],即待测成分与内参物保留时间的比值,计算6′′′-阿魏酰斯皮诺素相对于斯皮诺素的保留时间,作为待测成分色谱峰定位的依据。最终确定6′′′-阿魏酰斯皮诺素的相对保留时间(tR′)为1.84。见表3。
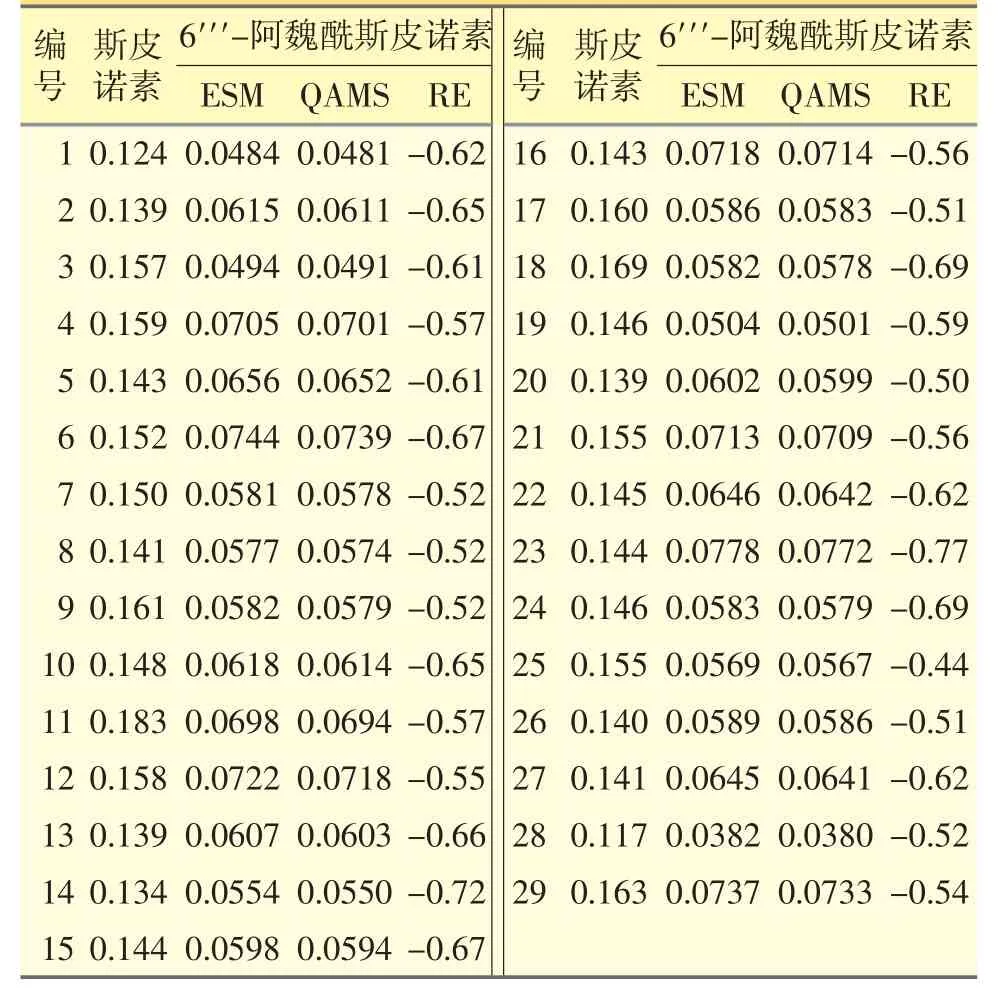
表4 ESM 法和QAMS 法测得的酸枣仁中2 个黄酮活性成分的含量(n=3,%)
2.7 样品含量测定及对QAMS 法的验证
分别采用外标法(ESM)和QAMS 法对收集的29 批酸枣仁的斯皮诺素和6′′′-阿魏酰斯皮诺素的含量进行同步测定,并将两种方法所得含量测定结果以相对误差(RE)进行评价,以验证QAMS 法测定上述2 个黄酮活性成分含量的准确性。
由表4 可见,ESM 法和QAMS 法所得含量测定结果无显著性差异,相对误差均<1.0%,表明所建立的QAMS 法用于酸枣仁中2 个黄酮活性成分的含量测定具有良好的准确性。酸枣仁样品中斯皮诺素的含量在0.117%~0.183%;6′′′-阿魏酰斯皮诺素的含量在0.0382%~0.0778%;2 个成分的含量均较高且较为稳定,其中,斯皮诺素的含量符合2015 年版《中国药典》的限量要求(≥0.080%)。
3 讨论
本试验在现有文献研究的基础上,建立了以斯皮诺素为内参物、同步测定酸枣仁中斯皮诺素和6′′′-阿魏酰斯皮诺素2 个黄酮活性成分的一测多评法。该方法检测成本低、耐用性强、重现性好、准确度高,可为修订酸枣仁的质量标准提供技术依据;在应用于酸枣仁的质控中,保障其临床用药的安全有效。
3.1 供试品制备方式和色谱条件的建立和优化
本试验对供试品溶液的提取方式(超声、回流、冷浸)、提取溶剂(50%乙醇、70%乙醇、乙醇)、提取体积(10、20、30 倍)及提取时间(10、20、30 min)等进行了单因素考察,确定了以1 g 样品加70%乙醇20 mL、超声提取20 min,超声提取前以环己烷索氏回流脱脂的制备方法,与文献[8]的制备方法相比,减少了制备时间,操作更为简便。
本试验通过考察最大吸收波长、流动相系统(甲醇-0.1%乙酸系统和乙腈-0.1%乙酸系统)、流动相酸度(0.05%乙酸、0.1%乙酸和0.15%乙酸)、流动相梯度洗脱、流速(0.8、1.0、1.2 mL·min-1)以及柱温,最终确定了液相色谱条件。采用这一条件,待测成分的理论塔板数增大,柱效提高,分离度和拖尾因子得到改善,方法的耐用性获得了提升。
3.2 黄酮类成分相对校正因子的确立
本试验以斯皮诺素为内参物,建立了6′′′-阿魏酰斯皮诺素的相对校正因子,并从不同仪器、色谱柱、流速和柱温等多个方面考察了相对校正因子的耐用性。前期文献[7]采用一测多评法测定了酸枣仁中4 种皂苷类成分;本试验补充了酸枣仁中测定黄酮类成分的一测多评法,可以为修订酸枣仁的质量标准提供较全面的技术依据。
3.3 样品中黄酮类成分的含量测定结果分析
酸枣仁样品中斯皮诺素和6′′′-阿魏酰斯皮诺素的平均百分含量分别为0.148%和0.062%,结合样品色谱图,说明两种化合物均为酸枣仁中的主要黄酮类成分。与《中国药典》仅以斯皮诺素为单一指标相比,本试验建立的酸枣仁中2 个黄酮活性成分“一测多评”法,可以更加有效地控制酸枣仁的质量。
