大黄蛰虫丸对AOM/DSS 诱导结肠炎相关结直肠癌小鼠的抑制作用*
2021-03-06戴国梁杨欣怡陈闪闪许美娟居文政邹建东
戴国梁,杨欣怡,陈闪闪,许美娟,居文政,邹建东
南京中医药大学附属医院临床药理科,南京 210029
结直肠癌(colorectal cancer,CRC)是全球最常见的恶性肿瘤之一,目前CRC 的发病率和死亡率分别位居恶性肿瘤的第4 位和第2 位。有研究显示,至2035 年,所有国家的结肠癌和直肠癌的死亡人数预计将分别上升60.0%和71.5%[1]。当前对CRC的研究大多集中在比传统疗法更简便、有效的新疗法上,新药开发及其临床实施可能对改善CRC 患者的整体生存率和生活质量起到积极作用。慢性炎症与CRC 的发生发展密切相关,“炎症-异常隐窝-腺瘤-癌症”是结肠炎相关结直肠癌(colitis-associated cancer,CAC)发生的基本路径[2],炎症性肠病(inflammatory bowel disease,IBD)患者如得不到有效的治疗,其30 年内罹患CAC 的风险要比正常人高20 倍[3],这提示炎症反应在CAC 发生发展中具有重要作用,控制“炎-癌转化”对防治CAC 意义重大。
从中药中筛选治疗CAC 的有效药物值得期待,大黄蛰虫丸(Dahuang Zhechong Pill,DZP)是《金匮要略》经典名方,由熟大黄、黄芩、甘草、桃仁、杏仁、芍药、干地黄、干漆、虻虫、水蛭、蛴螬及蛰虫12 味中药组成,是中医临床治疗肿瘤的最常用方剂之一。研究表明,DZP 配合化疗可以改善晚期胃癌症状,同时对胃肠道恶性肿瘤患者有益。
前期研究证实,大黄中的活性成分大黄素可以通过抑制血管内皮素受体2(VEGFR2)降低结肠癌HCT116 细胞的增殖和迁移[4]。此外,研究发现,桃仁与杏仁的提取物均能抑制结肠癌细胞的增殖[5]。黄芩中的活性成分黄芩苷可通过抑制c-Myc、下调SP1转录因子等多种机制诱导结肠癌细胞凋亡[6]。因此,DZP 可能是治疗结直肠癌的有效药物。在本研究中,拟使用氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)诱导的CAC 模型小鼠,探究DZP 对CAC 的影响及其治疗CAC 的作用机制。
1 材 料
1.1 仪器
MicroCL17R 高速低温离心机(赛默飞世尔科技公司);DMI3000B 光学显微镜(莱卡公司);Axio Observer Z1 荧光显微镜(蔡司公司);ELx800 酶标仪、Mini Protean 电泳仪、转印槽及电泳电源、Gel-Doc XR 凝胶成像系统(均伯腾仪器有限公司)。
1.2 药物与试剂
大黄蛰虫丸(规格:3 g/丸,批号:17013622,北京同仁堂制药厂);偶氮甲烷(AOM,批号:SLBV4860,规格:25 mg/瓶,Sigma 公司);双琥珀酰亚胺辛二酸酯(DSS,批号:160110,规格:500 g/瓶,MP biomedicals 公司);小鼠IL-1β ELISA 检测试剂盒(批号:ab197742)、小鼠IL-18 ELISA 检测试剂盒(批号:ab216165)、兔紧密连接相关蛋白Occludin 单克隆抗体(批号:ab216327)、兔闭锁小带蛋白(zonula occludens-1,ZO-1)单克隆抗体(批号:ab221547)、兔IL-1β 单克隆抗体(批号:ab234437)、兔IL-18 单克隆抗体(批号:ab71495)、兔自噬相关蛋白LC3B 单克隆抗体(批号:ab192890)、兔Sequestosome 1(SQSTM1)单克隆抗体(批号:ab109012)、兔自噬相关蛋白5 同源物(ATG5)单克隆抗体(批号:ab109490),均购自Abcam 公司;兔甘油酸-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号:10494-1-AP)、辣根过氧化物(HRP)-山羊抗兔IGg(批号:SA00001-2)及FITC-山羊抗兔IGg(SA00003-2)均购自Proteintech 公司;3,3'-二氨基联苯胺(DAB)显色试剂盒(批号:P0203)、4',6-二脒基-2-苯基吲哚(DAPI)染色液(批号:C1006)、苏木精-伊红(HE)染色液(批号:C0105M)及超敏ECL 化学发光试剂盒(批号:P0018M),均购自碧云天生物技术公司;其他试剂为分析纯;去离子水。
1.3 动物
60 只SPF 级C57BL/6 雄性小鼠,12 周,18~22g,购自北京华阜康生物科技公司。实验动物生产许可证号:SCXK(京)2019-0008,饲养于南京中医药大学实验动物中心,许可证号:SCXK(苏)2018-0049。
2 方 法
2.1 CAC 模型小鼠的复制、分组与给药
60 只SPF 级C57BL/6 雄性小鼠,适应性饲养后,随机分为4 组:对照组、模型组、DZP 低剂量组(2 g·kg-1)、DZP 高剂量组(4 g·kg-1);每组15 只。除对照组外,其余各组小鼠,给予单次10 mg·kg-1AOM 腹腔注射,1 周后联合3 个循环DSS 喂饲(2%DSS 饮水1 周+正常饮水2 周为一个循环),建立AOM/DSS 诱导的CAC 模型小鼠。对照组同步腹腔注射等体积生理盐水并正常饮水。第1 个DSS 喂饲循环结束后(开始造模2 周后),开始灌胃给予相应药物,对照组和模型组小鼠灌胃等体积生理盐水,周期为8 周。在实验周期中,记录小鼠生存情况,并绘制各组小鼠的生存曲线,实验周期结束后,取小鼠血液和结肠组织进行相应检测。
2.2 ELISA
使用ELISA 试剂盒检测小鼠血液中IL-1β 及IL-18 的水平。参阅此两种试剂盒说明书,对标准品进行梯度稀释以绘制标准曲线。将不同组的小鼠血清分别加入包被了抗IL-1β 或IL-18 抗体的96 孔板中,同时加入的还有不同浓度的对应试剂盒的标准品。反应30 min 后加入显色底物,之后加入反应终止液。清洗后,将96 孔板置于酶标仪中,450 nm波长处检测吸光度值,根据IL-1β 及IL-18 的标准曲线,计算各小鼠血清中IL-1β 及IL-18 的水平。
2.3 HE 染色
各组小鼠结肠固定于10%福尔马林,垂直切取一段放于一次性包埋框。以不同浓度乙醇进行脱水。之后将各组小鼠结肠浸泡于二甲苯中20min。融化的石蜡浸泡结肠40min 后,更换石蜡,再次浸泡40min。将小鼠结肠包埋成蜡块,小鼠结肠的横截面朝下。使用切片机将含有小鼠结肠的蜡块切成5 μm 的蜡片,获得小鼠结肠切片。将小鼠结肠切片放入二甲苯中溶解石蜡,再使用从高到低浓度的乙醇进行浸泡,最后将小鼠结肠切片置于去离子水中。
使用苏木素染色液对小鼠结肠切片进行染色,使用盐酸-乙醇溶液分化后,常水冲洗20 min 返蓝。在使用伊红染色液染色后,对小鼠结肠切片进行快速脱水并封片。封片后,使用普通光学显微镜对小鼠结肠组织进行拍照,对其进行组织学评分,评分标准为由轻到重以0~5 分评判(5 分=显著性增加,3分=中度增加,1 分=轻度增加,0 分=正常)。根据以下参数进行评判:隐窝萎缩(隐窝个数,隐窝底部与黏膜肌距离);隐窝多形核白细胞浸润量、单核细胞浸润量;隐窝基底部及黏膜基层淋巴细胞。
2.4 免疫组织化学染色
同HE 染色中的步骤,获得复水的小鼠结肠组织切片。之后使用3%的H2O2溶液孵育小鼠结肠组织以阻断内源性过氧化物酶。PBS 缓冲液清洗小鼠结肠组织后,使用柠檬酸盐缓冲液在95 ℃的水浴锅中孵育小鼠结肠组织20 min,以修复小鼠结肠组织中的抗原。正常山羊血清孵育小鼠结肠组织20 min,将ATG5、IL-1β 和IL-18 抗体稀释100 倍,4 ℃孵育小鼠结肠组织过夜。用稀释后的HRP-山羊抗兔IGg(1∶200)在室温孵育小鼠结肠组织2 h。PBS 清洗后,DAB 显色液孵育组织以显色。PBS 再次清洗后,使用苏木素复染细胞核。将小鼠结肠脱水、透明后封片,置于光学显微镜下观察并拍照。
2.5 免疫组织荧光染色
同HE 染色中的步骤,获得复水的小鼠结肠组织切片。之后使用柠檬酸盐缓冲液在95 ℃的水浴锅中孵育小鼠结肠组织20 min,以修复小鼠结肠组织中的抗原。正常山羊血清孵育小鼠结肠组织20 min,将Occludin 和ZO-1 抗体稀释100 倍,4 ℃孵育小鼠结肠组织过夜。用稀释后的FITC-山羊抗兔IGg(1∶200)在室温下孵育小鼠结肠组织2 h。PBS 清洗后,DAPI 染色液孵育小鼠结肠切片5 min,PBS 再次清洗后,甘油封片,置于荧光显微镜下观察并拍照。
2.6 蛋白印迹
取小鼠结肠组织,按照其每100 mg 加入1 mL裂解液的比例,置于EP 管中。用均质仪打碎组织,4 ℃裂解30 min,12000 r·min-1离心10 min 后取上清液,检测小鼠结肠组织的蛋白浓度。制备蛋白印迹实验样品和SDS-PAGE 凝胶,各孔加样量为50μg。电泳分离蛋白后,进行转膜操作。使用稀释后的LC3B(1∶1000)、SQSTM1(1∶1000)及ATG5(1∶1000)抗体孵育PVDF 膜过夜。清洗后,使用稀释后的HRP-山羊抗兔IGg(1∶10000)孵育PVDF 膜2 h。再次清洗后,使用凝胶成像系统对蛋白印迹进行显影,存储图片。
2.7 统计分析
免疫组织化学染色和免疫组织荧光染色的图片应用Image pro plus(美国,Media Cybernetics)软件进行计算平均光密度,并导出计量数据。蛋白印迹图片使用Image Lab(美国,Bio-Rad)软件进行相对定量分析,并导出计量数据。所有数据以均数±标准差()表示,数据结果采用Graph Pad Prism7软件进行方差分析和作图。多组间的比较采用单因素方差分析。P<0.05 为具有统计学意义。
3 结果
3.1 DZP 降低CAC 模型小鼠的死亡率和血清中炎症因子的水平
与对照组相比,模型组生存率显著降低,15 只小鼠存活9 只(P<0.01)。给药后DZP 显著降低了模型小鼠的死亡率,其中DZP 低剂量组存活12 只、高剂量组小鼠存活14 只(P<0.05),见图1A。CAC 模型小鼠血清IL-1β 和IL-18 水平显著升高(P<0.01),经DZP 治疗8 周后,显著降低了CAC 模型小鼠血清IL-1β 和IL-18 水平(P<0.01)。见图1B-C。
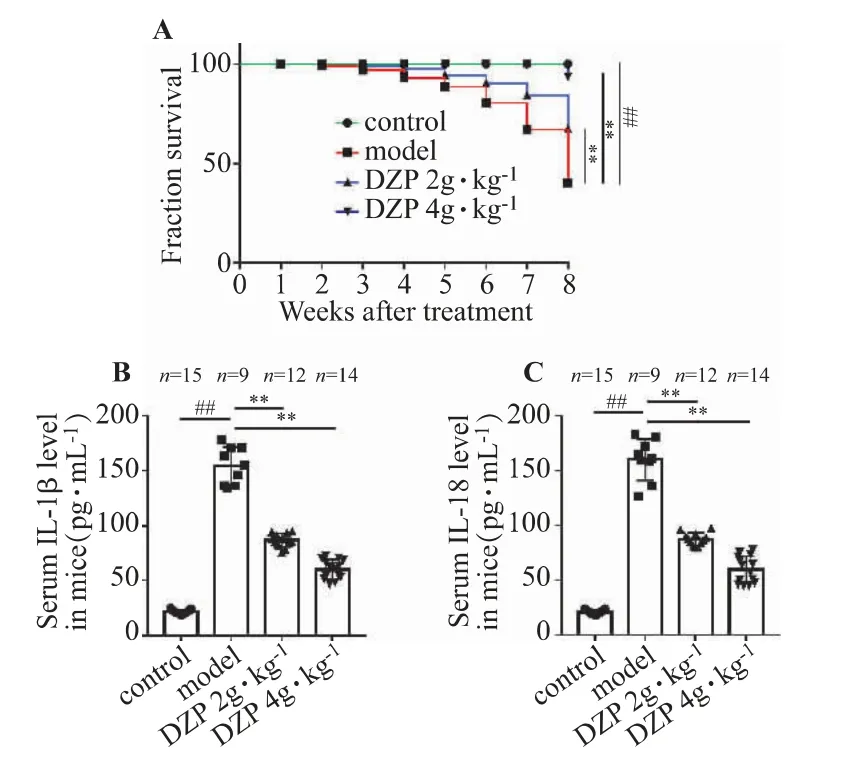
图1 DZP 对CAC 模型小鼠的死亡率和血清炎症因子水平的影响()
3.2 DZP 改善CAC 模型小鼠的肠道炎症和病理组织学
小鼠结肠组织免疫组织化学染色结果显示,与对照组相比,模型组小鼠结肠中IL-1β 和IL-18 水平显著增加(P<0.01),经DZP 治疗8 周后,显著降低了CAC 模型小鼠结肠组织中IL-1β 和IL-18 的表达水平(P<0.01),见图2A-D。HE 染色结果显示,CAC 模型小鼠结肠炎细胞浸润严重,DZP 治疗后可显著减轻CAC 模型小鼠结肠内的炎症。对结肠HE染色进行组织学评分结果显示,DZP 可改善CAC 模型小鼠结肠的病理组织学(P<0.01)。见图2E-F。
3.3 DZP 改善CAC 模型小鼠结肠紧密连接
免疫组织荧光染色结果显示,与对照组相比,CAC 模型小鼠结肠中紧密连接相关蛋白Occludin及ZO-1 的表达显著降低(P<0.01),经DZP 治疗8周后,显著增加了CAC 模型小鼠结肠中Occludin及ZO-1 蛋白的表达(P<0.05,P<0.01)。见图3A-D。
3.4 DZP 促进CAC 模型小鼠结肠自噬
小鼠结肠组织免疫组织化学染色结果显示,与对照组相比,CAC 模型小鼠结肠中ATG5 水平显著降低(P<0.01),经DZP 治疗8 周后,显著增加了CAC 模型小鼠结肠组织中ATG5 的表达水平(P<0.01),见图4A-B。蛋白印迹结果显示,与对照组相比,模型组小鼠结肠中SQSTM1 蛋白表达水平显著增加(P<0.01),LC3BⅠ/Ⅱ及ATG5 的蛋白表达水平显著降低。经DZP 治疗8 周后,显著降低CAC 模型小鼠结肠组织中SQSTM1 的蛋白表达水平(P<0.01),并显著上调CAC 模型小鼠结肠组织中LC3BⅠ/Ⅱ及ATG5 的蛋白表达水平。见图4C-F。
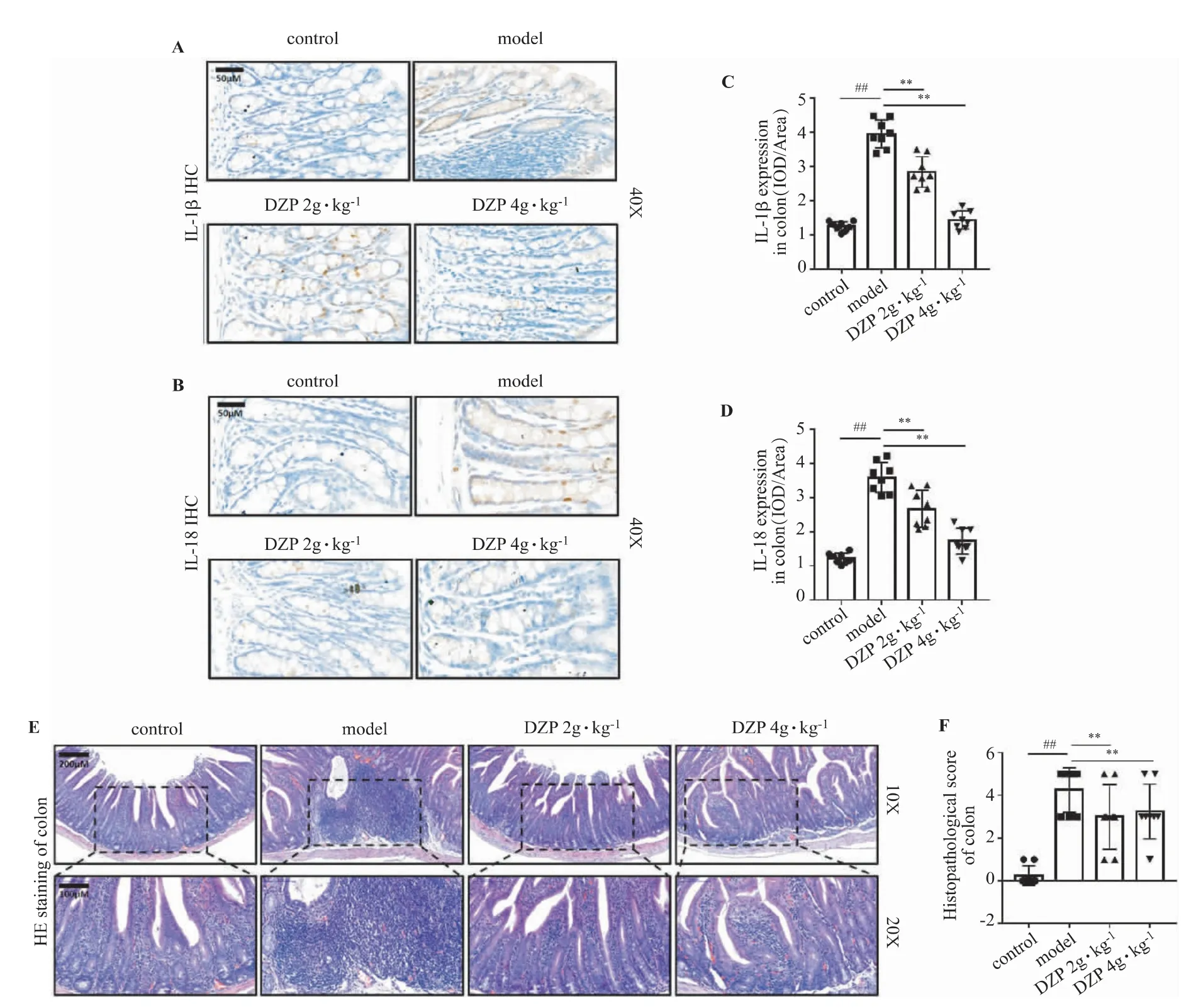
图2 DZP 对CAC 模型小鼠结肠炎症及病理组织学的影响(,n=8)
4 讨论
药理实验表明,结合AOM 及DSS 可诱导CAC的两步式肿瘤模型,是研究CAC 发病机理的经典模型。肿瘤的进展不仅取决于其内在因素,而且受到多方面的全身过程的影响,尤其是全身性的炎症。在某些类型的肿瘤中,发生恶性变化之前就存在炎症,致癌性变化又会诱发炎症微环境,从而促进肿瘤的发展。炎症促进肿瘤的作用已被证实,包括促进恶性肿瘤细胞的增殖和存活,促进血管生成和转移[7]。本实验结果表明,DZP 可显著降低CAC 模型小鼠的死亡率及血清中IL-1β 和IL-18 的水平。
肠道慢性炎症导致其上皮细胞因子和趋化因子诱导的增加,被认为是导致CAC 及CRC 重要因素[8],随之而来的变化是肠道上皮细胞增殖、存活和迁移的改变[9]。有研究表明,发炎的结肠黏膜在没有发生任何组织学改变之前,其分子信号经历了与癌症相似的变化[10]。此外,临床研究显示,大肠腺瘤的患病率与患者血液中较高的IL-6 和TNF-α 浓度有关,系统性炎症可能与大肠肿瘤的早期发展有关[11]。因此,抑制肠道炎症可能是延缓或治疗CAC 及CRC 的有效策略。本实验表明,DZP 可有效抑制CAC 模型小鼠的肠道炎症,这可能是其减轻CAC模型小鼠全身炎症并降低小鼠死亡率的原因之一。
研究表明,肠道炎症的增加导致肠道屏障的破坏,也是导致全身性炎症的直接原因。正如实验观察到的、CAC 模型小鼠结肠中的紧密连接相关蛋白Occludin 及ZO-1 的表达显著降低,这可能促进了小鼠肠道炎症和CAC 的发生。在CRC 中,自噬被认为具有促进肿瘤和抑制肿瘤的双重作用[12],但潜在机制仍不清楚。慢性炎症会干扰自噬机制的正常运作,在上皮细胞中,自噬缺陷可以通过增强氧化应激和基因组不稳定性,以及激活转录因子来促进肿瘤的发生[13]。一项临床研究发现,CRC 患者肠道组织中ATG5 下调[14],此结果与本实验结果一致。同时,SQSTM1 在CAC 模型小鼠结肠中的表达增加,而LC3B 的表达减少。经DZP 治疗8 周后,模型小鼠结肠LC3BⅠ/Ⅱ及ATG5 的表达增加,而SQSTM1 的表达降低。上述实验结果表明,DZP 增强了CAC 模型小鼠结肠的自噬水平,DZP 治疗CAC 作用与其促进结肠自噬有关。

图3 DZP 对CAC 模型小鼠结肠组织Occludin 及ZO-1 表达的影响(,n=8)
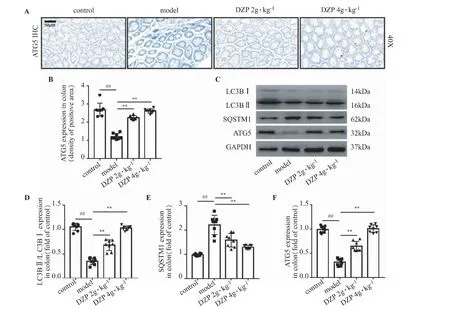
图4 DZP 对CAC 模型小鼠结肠自噬的影响()
综上所述,本研究结果表明,DZP 显著降低了CAC 模型小鼠的炎症和死亡率,这与DZP 增加小鼠结肠自噬水平、促进结肠紧密连接蛋白表达密切相关,但无法明确其具体作用机制,有待进一步研究。
