阿帕替尼单药对照吉西他滨单药治疗二线及以上化疗失败的晚期卵巢癌的临床观察
2020-04-07庄翠侠赵文英祁清华王银华
刘 飞,庄翠侠,叶 斌,赵文英,胡 俊,祁清华,王银华
(1.芜湖市第二人民医院 a.肿瘤放疗一科;b.全科医学科,安徽 芜湖 241000;2.皖南医学院第一附属医院 弋矶山医院 肿瘤内科,安徽 芜湖 241001)
近年来,妇科肿瘤的发病率在逐年增加,并有年轻化趋势,卵巢癌连同宫颈癌和子宫内膜癌被合称为妇科三大恶性肿瘤。根据最新的国家癌症中心发布的数据,卵巢癌在女性恶性肿瘤发病率中位于第11位[1],严重威胁着女性患者的生命健康。对于晚期卵巢癌主要以全身化疗为主,辅以局部治疗,虽然很多晚期患者最初受益于满意的局部治疗联合以铂类为基础的化疗,但仍有近90%的患者会复发,并最终死亡[2]。目前对于晚期卵巢癌多线治疗后病情进展的患者,尚没有标准治疗方案,当前可选药物包括脂质体阿霉素、依托泊苷、拓扑替康以及吉西他滨等。多线治疗后的妇科肿瘤多存在药物耐药情况,研究报道[3]吉西他滨不受铂类耐药影响,也不易受到典型的多药耐药性的影响,因此可用于多种实体瘤多线耐药后的治疗。阿帕替尼是一种小分子酪氨酸激酶抑制剂,主要作用于血管内皮细胞生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR-2),可通过抑制肿瘤血管生成,发挥抗肿瘤作用[4]。基础实验及临床研究发现阿帕替尼能够抑制宫颈癌细胞生长,并且对于复发卵巢癌有一定疗效[5-6]。本文以晚期卵巢癌患者为研究对象,探讨阿帕替尼单药和吉西他滨单药在治疗晚期卵巢癌方面的疗效及安全性,现报道如下。
1 资料与方法
1.1 病历资料 通过病历系统调阅芜湖市第二人民医院2017年1月~2019年5月收治的经病理组织学确诊,以及影像学检查结合FIGO分期判定为Ⅳ期卵巢癌患者。同时满足以下条件:二线以上常规方案化疗后出现病情进展;具有CT或MRI等影像学可测量的病灶;三大常规检查、肝肾功能及心电图基本正常;KPS评分70分及以上;预计生存期3个月及以上;治疗前均知情同意。经筛选共有40例患者入组,根据治疗方案分成阿帕替尼组和吉西他滨组。具体见表1。
表1 患者一般资料分析

特征阿帕替尼组(n=20)吉西他滨组(n=20)平均年龄/岁56.558体力评分>80910≤801110治疗二线24三线1816转移部位肺54肝脏42盆腔910其他(骨)87肿瘤标记物正常62异常1418
1.2 方法 阿帕替尼组16例患者起始予以500 mg/d口服,4例给予250 mg/d口服。吉西他滨组,1000 mg/m2静脉输注第1、8天,每21 d重复1次。以3~4周评价毒性,6~8周评价疗效,持续用药至病情进展或者不良反应不能耐受、或患者决定退出治疗。
1.3 疗效评价 根据观察方法,每6~8周进行疗效评价,参照实体瘤疗效评价标准(RECIST)1.1版标准进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),计算客观缓解率(objective response rate,ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(disease contral rate,DCR)=(CR例数+PR例数+SD例数)/总例数×100%。
1.4 不良反应评价 应用国际肿瘤化疗药物不良反应-通用不良反应术语标准版4.0(NCI-CTC4.0)标准对治疗过程中出现的不良反应进行分级,分为0~4级。
1.5 随访 通过门诊及电话对患者进行随访,随访内容包括疾病状态、毒副反应、服药情况及相关检查结果,全组末次随访时间为2019年7月。无进展生存期(progression-free survival,PFS):为药物治疗开始时间至发生疾病进展或任何原因死亡的时间。总生存期(overall survival,OS):为药物治疗开始时间至因任何原因引起患者死亡的时间或末次随访时间。
1.6 统计学分析 采用SPSS 18.0和Graphpad prism 7版统计软件进行数据分析。计量资料用中位数表示;分类资料以例数和率(%)表示,组间比较采用Fisher确切概率法或秩和检验。生存分析采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 治疗完成情况 阿帕替尼组20例患者中有2例因不良反应不能耐受而被排除,其余18例均满足疗效评价要求,且完成6周以上的阿帕替尼单药治疗。吉西他滨组患者中仅有1例患者因严重血小板减少,改换其他治疗方案。具体见表2。
表2 药物剂量情况

具体药物使用情况阿帕替尼组吉西他滨组初始剂量调整41后续剂量调整23治疗间隔延长02不良反应停药21
2.2 近期疗效 分别对2组患者进行近期疗效评价,阿帕替尼组:CR 0例,PR 4例,SD 9例和PD 5例,ORR和DCR分别为22.2%和72.2%。吉西他滨组:CR 0例,PR 2例,SD 7例和PD 10例,ORR和DCR分别为10.5%和47.3%。两组ORR和DCR差异均无统计学意义(P>0.05)。见表3。
表3 患者疗效评价(n/%)

nCRPRSDPDORRDCR阿帕替尼组18049522.272.2吉西他滨组190271010.547.4P0.4050.184
注:Fisher确切概率法。
2.3 生存分析 两组患者均按要求完成随访,随访时间为1~15个月,中位随访8个月。至末次随访时间,阿帕替尼组中位PFS为5个月,中位OS为10个月;而吉西他滨组中位PFS为3个月,中位OS为9个月,两组差异具有统计学意义(P<0.05),具体见图1、2。
2.4 不良反应 阿帕替尼组常见不良反应包括高血压、手足综合征、蛋白尿、乏力,有1例患者出现罕见的头发变白。而吉西他滨组患者常见不良反应为骨髓抑制,差异具有统计学意义。剂量及周期调整方面,阿帕替尼组治疗过程中共有2例患者因不良反应无法耐受而停药,其中1例给予单药阿帕替尼(500 mg/d)治疗10 d左右,出现3级高血压及头痛后自行停药;另1例给予单药阿帕替尼(250 mg/d)治疗15 d左右出现3级蛋白尿,患者肾功能不全加重停药。有2例患者阿帕替尼治疗过程中因不良反应重而调整治疗剂量,2例患者起始剂量为500 mg/d,因出现3级口腔溃疡、皮肤反应及高血压减量至250 mg/d,经过对症处理好转继续服药。阿帕替尼组未发生4级毒副反应。吉西他滨组1例患者因Ⅳ骨髓抑制,停止后续治疗,改换其他治疗方案,2例患者因血小板减少及粒细胞减少,推迟治疗时间。见表4。
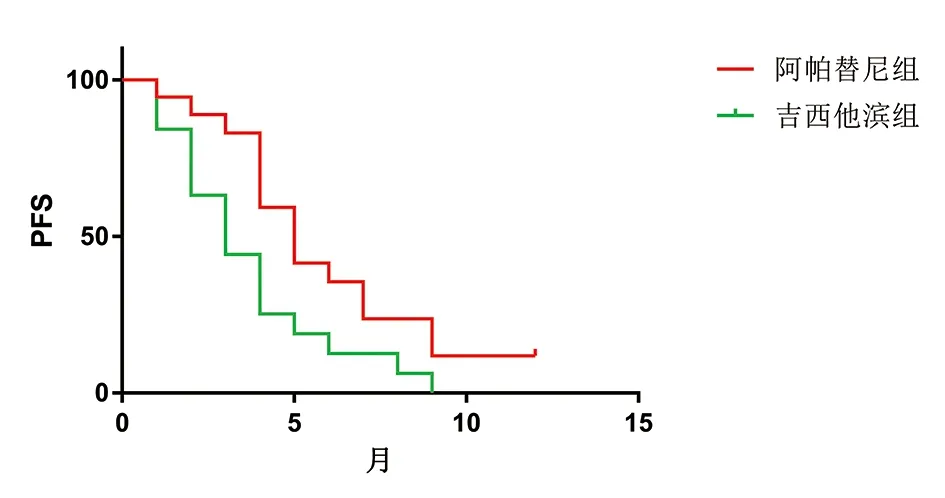
图1 两组患者无进展生存曲线
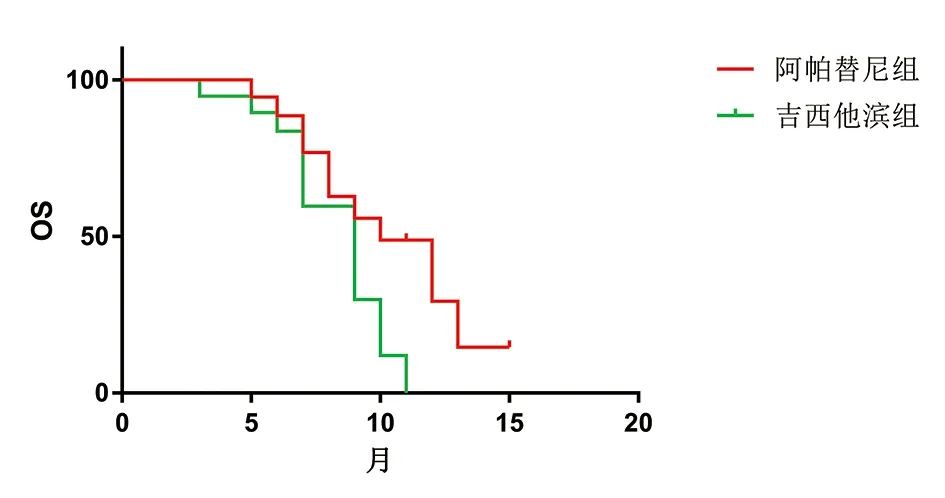
图2 两组患者总生存曲线
表4 不良反应发生情况

不良反应阿帕替尼组吉西他滨组1级2级3级4级1级2级3级4级ZP手足综合征062000003.2200.001高血压862000005.1540.000蛋白尿021010001.1840.236乏力120011000.5630.574恶心呕吐100042002.0280.043肝功能异常100011201.4320.152中性粒细胞减少110029213.8630.000贫血130078103.3120.001血小板减少100084103.8730.000
3 讨论
肿瘤转移是恶性肿瘤导致患者死亡的最主要原因之一。在我国,妇科恶性肿瘤因发病率高而严重影响女性健康。多数卵巢癌因早期症状不典型,确诊时已属晚期,因此针对晚期卵巢癌的药物疗效与安全性的研究存在现实意义。
晚期妇科肿瘤主要以化疗为主,对于二线治疗后病情进展的患者可选择单药治疗。吉西他滨(gemcitabine)作为细胞周期特异性药物,主要通过抑制核苷酸代谢,影响细胞DNA合成,导致细胞G1/S期阻滞,从而起抗肿瘤作用;吉西他滨单药治疗复发卵巢癌,尤其是铂类耐药或紫杉醇治疗进展者,总有效率约14%~22%[7]。一项Ⅲ期临床试验比较了吉西他滨与脂质体阿霉素在曾接受过紫杉类药物及铂类耐药的卵巢癌病人的疗效,研究入组的195例患者,结果显示吉西他滨组ORR 6.1%,PFS 3.6个月,OS 12.7个月;并提出GEM可以作为脂质体阿霉素替代方案,用于铂类耐药卵巢癌患者的治疗[8]。上述研究提示GEM可用于晚期卵巢癌的治疗。
VEGF/VEGFR是一类细胞膜酪氨酸激酶配/受体,通路激活后可促进肿瘤细胞增殖,促进血管生成,从而抑制肿瘤细胞的凋亡,直接或间接地促进肿瘤的转移,因此,抑制VEGF/VEGFR信号通路成为晚期恶性肿瘤治疗新靶点[9]。阿帕替尼作为国产新型小分子抗血管生成药物,主要通过竞争性结合VEGFR2胞内酪氨酸ATP结合位点,抑制其磷酸化,阻断信号通路传导,抑制血管内皮细胞的增殖、迁移,达到抑制肿瘤新生血管形成的作用[4]。目前已被中国临床肿瘤学会指南(csco)推荐用于晚期胃腺癌或胃-食管结合部腺癌,以及食管癌的二线治疗。一项研究[10]报道,入组多种晚期恶性实体瘤常规化疗失败的患者(包括卵巢癌),阿帕替尼治疗均显示出一定的临床效果。2018年一项Ⅱ期前瞻性研究[11]报道阿帕替尼联合VP16治疗铂类耐药复发性卵巢癌时,联合方案的ORR达54.3%,在PFS方面,联合治疗约8.1个月,但入组的患者中,早期和中期患者约占78%,Ⅳ期患者仅8例。在单药治疗方面,2017年ESMO会议上中国一项研究报道显示单药阿帕替尼治疗宫颈癌和卵巢癌的中位PFS达到了8个月和5个月,ORR分别为46.2%和53.3%,DCR分别为100%和73.3%。另一项Ⅱ期研究报道[6],在复发卵巢癌中,单药阿帕替尼ORR为41.4%,DCR为68.9%,中位PFS 5.1个月,中位OS 14.5个月。从既往数据看阿帕替尼在晚期卵巢癌中无论是单药治疗,还是与其他药物联合均能使患者获益。
但是对于两者单药之间的比较研究较少,因此本研究回顾性分析了两种药物在晚期卵巢癌中单药治疗的疗效。通过研究发现阿帕替尼单药治疗多线化疗失败的卵巢癌ORR和DCR分别为22.2%和72.2%,这与成远等[12]报道类似(其ORR和DCR分别为27.3%和81.8%);而吉西他滨组的ORR和DCR分别为10.5%和47.3%,两者间经统计学分析无差异,提示两药单药治疗在晚期卵巢癌近期疗效方面无明显差异。本研究中吉西他滨组的中位PFS为3月,中位OS为9月;研究结果与Mutch D等报道相近[8]。阿帕替尼组中位PFS 5月,中位OS10月,较吉西他滨组相比,差异有统计学意义,提示阿帕替尼相比于GEM能一定程度上改善患者生存;但与Miao等[6]研究相比,OS低于其14.5个月;对于两者之间的差异,我们比较患者基本情况发现,Miao的实验中入组人群中ⅢA~ⅢC患者约占总数86.2%,Ⅳ期患者仅占13.8%,并且患者KPS评分>80分;而本研究入组患者多数合并肝脏、肺以及骨转移,病情较晚;同时患者体力状态评分较低,多数患者不能接受联合化疗;另外该研究中约85%为3线及以上治疗的患者;上述情况提示在体力评分高和分期较早时使用阿帕替尼有可能使患者更受益,当然上述观点只是基于两项研究结果的一种推断,需要大样本、多中心联合研究,统计学分析进一步证实。
本研究中阿帕替尼最常见的不良反应是高血压、手足综合征和蛋白尿。这与先前阿帕替尼在治疗转移性胃癌和乳腺癌的报告相似[13-14]。其中高血压发生率较高,是本试验中减少剂量和停止治疗的最主要原因。1例因3级高血压自行停药;其余高血压者患者通过使用血管紧张素受体阻滞剂,或联合钙拮抗剂,均能很好控制。而吉西他滨组主要以血液学毒性为主,这也是导致患者延期治疗及退出治疗的主要原因。阿帕替尼组未观察到4级不良反应,而吉西他滨组1例因Ⅳ度骨髓抑制停止治疗。从药物毒副反应看,不排除阿帕替尼相比于GEM在一定程度上能延长患者PFS和OS,可能与血液系统毒副反应相对较轻有关;GEM组患者贫血、粒细胞减少以及血小板减少副反应发生率明显高于阿帕替尼组,直接影响了患者生活质量和生存期;而阿帕替尼主要毒副反应为高血压及蛋白尿,上述不良反应对患者机体的损害是一个长期慢性的过程,且相比于骨髓抑制导致的三系减少而言,治疗难度较小,患者因心理可承受而依从性更高,有利于患者配合治疗以及其心理健康。
总之,晚期卵巢癌是不可治愈的,阿帕替尼作为一种新型的国产口服抗血管生成类药物,不良反应可控,可以被患者接受,尤其是对于临床多线治疗失败的卵巢癌较吉西他滨单药组,显示了初步疗效,可作为临床的一种选择。但由于本研究病例数较少,且属于回顾性研究,故阿帕替尼的确切疗效和正确的治疗顺序仍需要大样本的临床研究去证实。
