二甲双胍增强胆管癌细胞对吉西他滨敏感性机制的研究
2022-06-11邓海山俞文隆
邓海山 俞文隆
胆管癌是一种死亡率极高的恶性肿瘤,无明显早期症状且病程进展迅速[1]。肿瘤细胞的侵袭性和对治疗药物的不敏感性是导致胆管癌不良预后的主要因素[2]。丙酮酸激酶 M2(pyruvate kinase M2,PKM2)是糖酵解途径中一种重要的限速酶。PKM2在肿瘤细胞产生耐药性过程中起到重要作用,而靶向作用于PKM2能够有效提高肿瘤细胞对化疗药物的敏感性。研究表明,PKM2表达的上调与肿瘤细胞对吉西他滨和顺铂的敏感性降低有关[3-4]。二甲双胍是一种常用的口服降糖药,体内及体外研究均发现其具有一定的抗癌作用,且可下调PKM2的表达,抑制肿瘤细胞的增殖[5-7]。线粒体是细胞的能量源,在肿瘤细胞增殖和分化中发挥着重要作用[8]。基于已有的研究,本研究将二甲双胍用于胆管癌细胞,进一步探讨二甲双胍对PKM2表达的调控,进而阐明其增强胆管癌细胞对吉西他滨敏感性的作用及机制。
1 材料和方法
1.1 材料
1.1.1 试剂 10%FBS(批号:11875-093)和 1%青霉素链霉素(批号:15070-063)均购自美国GIBCO-Invitrogen公司;Trizol试剂(批号:15596-026)购自美国Ambion公司;qPCR检测试剂盒(批号:QP001)购自广州复能基因有限公司;PKM2激动剂ML265(批号:1221186-53-3)购自美国 Targetmol公司;二甲双胍(批号:D9351)和吉西他滨(批号:G8970)均购自北京索莱宝科技有限公司;线粒体膜电位检测(JC-1)试剂盒(批号:C2006)和乳酸脱氢酶(lactate dehydrogenase,LDH)定量检测试剂盒(批号:C0016)均购自中国碧云天生物技术公司;乳酸定量检测试剂盒(批号:A019-2-1)购自南京建成生物工程研究所。
1.1.2 仪器 实时荧光定量PCR仪(型号:QuantStudio 6)购自美国 Applied Biosystems(ABI)公司;微量分光光度计(型号:Nano-100)购自杭州奥盛仪器有限公司;酶标仪(型号:MULTISKAN MK3)购自赛默飞世尔科技(中国)有限公司;细胞超声破碎仪(型号:SCIENTZIID)购自宁波新芝生物科技股份有限公司;荧光显微镜(型号:IX51)购自奥林巴斯(中国)有限公司。
1.1.3 细胞 人胆管癌细胞HCC9810和RBE细胞系由中国科学院上海细胞库提供。
1.2 方法
1.2.1 细胞分组 人胆管癌细胞HCC9810和RBE在含有10%FBS和1%青霉素链霉素的RPMI 1640培养基中培养,置于37℃,5% CO2培养箱中孵育,并分为以下各组:(1)HCC9810/RBE+溶剂组:HCC9810/RBE细胞在含有终浓度5%二甲基亚砜(DMSO)的培养基中培养;(2)HCC9810/RBE+吉西他滨组:HCC9810/RBE细胞在含有终浓度为100 nmol/L吉西他滨(溶于5%DMSO)的培养基中培养;(3)HCC9810/RBE+二甲双胍+吉西他滨组:HCC9810/RBE细胞在含有终浓度为10 mmol/L二甲双胍和100 nmol/L吉西他滨(溶于5%DMSO)的培养基中培养;(4)HCC9810/RBE+二甲双胍+吉西他滨+ML265组:HCC9810/RBE细胞在含有终浓度为10 mmol/L二甲双胍、100 nmol/L吉西他滨和100 nmol/L ML265(溶于 5%DMSO)的培养基中培养。各组细胞均培养48 h。
1.2.2 细胞存活率检测 采用噻唑蓝(MTT)染色法。将 HCC9810和RBE细胞系(5×104个/孔)接种于 96孔细胞培养板中,贴壁培养12 h。按上述分组,细胞加入药物干预后,参考文献[9]方法,吸出培养基,加入150 μl DMSO,震荡10 min,用酶标仪检测570 nm波长处吸光度(optical density,OD)值;Blank为不加细胞只加培养基。细胞存活率=(测试组OD570nm-Blank OD570nm)/(正常培养组OD570nm-Blank OD570nm)×100%。
1.2.3 细胞PKM2 mRNA表达水平检测 采用qRTPCR法。用Trizol试剂提取各组细胞中总RNA,然后进行反转录,并应用qPCR检测试剂盒进行PCR检测。PKM2引物序列:正向引物:5'-GACGGAGGTGGAAAATGGTG-3',反向引物:3'-CAGATGCCTTGCGGATGAAT-5'。PCR循环过程:95℃ 10 min预变性,95℃ 15 s变性,60℃退火延伸60 s,40个循环。应用2-ΔΔCt法计算基因的相对表达量。
1.2.4 细胞培养基乳酸含量测定 药物处理各组细胞后,收集细胞培养基,离心取上清液。根据乳酸定量检测试剂盒操作方法进行检测,待测样品用分光光度计检测450 nm波长处OD值,根据试剂盒对照样品检测所得标准曲线计算乳酸含量。
1.2.5 细胞LDH活性检测 药物处理各组细胞后,收集细胞加入PBS,利用细胞超声破碎仪在冰上破碎细胞制成细胞悬液。按照LDH定量检测试剂盒操作手册进行处理后,应用酶标仪检测490 nm波长处OD值。根据试剂盒对照样品检测,LDH活性=(样品OD490nm-Blank OD490nm)/(标准管OD490nm-标准Blank OD490nm)×标准品浓度。
1.2.6 细胞线粒体凋亡检测 采用JC-1染色法。细胞接种至小玻片上待长至单细胞层,4%多聚甲醛固定,然后加入1 ml JC-1染色工作液,充分混匀。细胞培养箱中37℃孵育20 min;孵育结束后,吸除上清液,用JC-1染色缓冲液洗涤2次;加入2 ml细胞培养液;荧光显微镜下观察并拍照。绿色荧光增强,红色荧光减弱,表明线粒体凋亡增加。
1.3 统计学处理 采用GraphPad Prism 6.0统计软件。计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计意义。
2 结果
2.1 各组细胞存活率比较 与HCC9810+溶剂组比较,HCC9810+吉西他滨组、HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组细胞存活率均降低(均P<0.05);与HCC9810+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨组细胞存活率降低(P<0.05);与 HCC9810+二甲双胍+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨+ML265组细胞存活率升高(P<0.05)。RBE细胞各组的细胞存活率结果与HCC9810细胞类似,见图1。
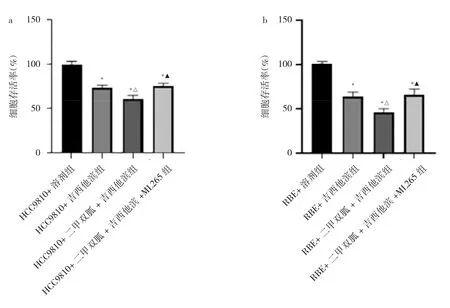
图1 各组细胞存活率比较(a:HCC9810细胞经处理后各组细胞存活率比较;与HCC9810+溶剂组比较,*P<0.05;与HCC9810+吉西他滨组比较,△P<0.05;与HCC9810+二甲双胍+吉西他滨组比较,▲P<0.05;b:RBE细胞经处理后各组细胞存活率比较;与RBE+溶剂组比较,*P<0.05;与RBE+吉西他滨组比较,△P<0.05;与RBE+二甲双胍+吉西他滨组比较,▲P<0.05)
2.2 各组细胞PKM2 mRNA表达水平比较 与HCC9810+溶剂组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组PKM2 mRNA表达水平均降低(均P<0.05);与HCC9810+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组PKM2 mRNA表达水平均降低(均P<0.05);与HCC9810+二甲双胍+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨+ML265组PKM2 mRNA表达水平升高(P<0.05)。RBE细胞各组的PKM2 mRNA表达水平变化与HCC9810一致,见图2。

图2 各组细胞PKM2 mRNA表达水平比较(a:HCC9810细胞经处理后各组细胞PKM2 mRNA表达水平比较;与HCC9810+溶剂组比较,*P<0.05;与HCC9810+吉西他滨组比较,△P<0.05;与HCC9810+二甲双胍+吉西他滨组比较,▲P<0.05;b:RBE细胞经处理后各组细胞PKM2 mRNA表达水平比较;与RBE+溶剂组比较,*P<0.05;与RBE+吉西他滨组比较,△P<0.05;与RBE+二甲双胍+吉西他滨组比较,▲P<0.05)
2.3 各组细胞培养基乳酸含量比较 与HCC9810+溶剂组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组细胞培养基乳酸含量均降低(均 P<0.05);与 HCC9810+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组细胞培养基乳酸含量均降低(均P<0.05);HCC9810+二甲双胍+吉西他滨组和HCC9810+二甲双胍+吉西他滨+ML265组细胞培养基乳酸含量比较差异无统计学意义(P>0.05)。RBE细胞各组的细胞培养基乳酸含量结果与HCC9810类似,见图3。

图3 各组细胞培养基乳酸含量比较(a:HCC9810细胞经处理后各组细胞培养基乳酸含量比较;与HCC9810+溶剂组比较,*P<0.05;与HCC9810+吉西他滨组比较,△P<0.05;b:RBE细胞经处理后各组细胞培养基乳酸含量比较;与RBE+溶剂组比较,*P<0.05;与RBE+ 吉西他滨组比较,△P<0.05)
2.4 各组细胞LDH活性比较 与HCC9810+溶剂组比较,HCC9810+吉西他滨组、HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组LDH活性均升高(均P<0.05);与HCC9810+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组LDH活性均升高(均P<0.05);与HCC9810+二甲双胍+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨+ML265组LDH活性降低(P<0.05)。RBE细胞各组的LDH活性结果与HCC9810类似,见图4。

图4 各组细胞LDH活性比较(a:HCC9810细胞经处理后各组细胞LDH活性比较;与HCC9810+溶剂组比较,*P<0.05;与HCC9810+吉西他滨组比较,△P<0.05;与HCC9810+二甲双胍+吉西他滨组比较,▲P<0.05;b:RBE细胞经处理后各组细胞LDH活性比较;与RBE+溶剂组比较,*P<0.05;与RBE+吉西他滨组比较,△P<0.05;与RBE+二甲双胍+吉西他滨组比较,▲P<0.05)
2.5 各组细胞线粒体凋亡情况比较 与HCC9810+溶剂组比较,HCC9810+吉西他滨组、HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组细胞线粒体凋亡均增加(绿色荧光增强,红色荧光减弱);与HCC9810+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨组、HCC9810+二甲双胍+吉西他滨+ML265组细胞线粒体凋亡均增加(绿色荧光增强,红色荧光减弱);与HCC9810+二甲双胍+吉西他滨组比较,HCC9810+二甲双胍+吉西他滨+ML265细胞线粒体凋亡减少(绿色荧光减弱,红色荧光增强)。RBE细胞各组的线粒体凋亡结果与HCC9810类似,见图5(插页)。

图5 各组细胞线粒体凋亡情况比较(线粒体膜电位检测染色,×200)
3 讨论
癌细胞倾向于贪婪地吸收葡萄糖进行糖酵解,以调节肿瘤的发展、维持和转移,该过程被称为“Warburg效应”[10]。与正常细胞相比,肿瘤细胞的糖酵解率增加大约30倍,这一特点促进了糖酵解靶向抗肿瘤治疗新方法的探索[11]。二甲双胍是一种常用的口服降糖药物,可通过腺苷酸活化蛋白激酶(AMPK)信号通路抑制Warburg效应[12],发挥抗肿瘤作用[5-6]。PKM2在肿瘤细胞中高度表达,并在Warburg效应和肿瘤耐药中发挥重要作用。既往研究发现,耐药癌细胞表现出更高的糖酵解率,这表明以糖酵解途径为突破点可能是降低癌细胞耐药性的一种新的研究方向[13]。最新研究表明,PKM2高表达预示肝内胆管癌恶性程度,且与不良预后有关[14]。本研究探讨二甲双胍对PKM2的表达调控,进而阐明其促进胆管癌细胞对吉西他滨敏感性的机制。
胆管癌主要是肝门部胆管癌,是胆管系统的第二大肿瘤。由于胆管癌的隐匿性发病和高度恶性,患者预后较差。胆管癌患者平均生存时间约为1年,5年生存率<10%。即使是根治性手术切除后,患者5年生存率也只有20%~40%[15]。化疗敏感性仍然是影响患者生存率的最重要因素之一。在本研究中,体外培养胆管癌细胞株HCC9810和RBE细胞,并用化疗药物吉西他滨、二甲双胍处理细胞,结果表明,与吉西他滨单独处理相比,二甲双胍联合吉西他滨处理后明显降低了细胞存活率。乳酸是主要的糖酵解产物,具有促进肿瘤增殖和转移作用[16]。LDH是糖酵解的关键酶之一,是维持细胞糖酵解不可或缺的部分[17]。本研究结果表明,二甲双胍联合吉西他滨明显降低细胞培养基乳酸含量,提高细胞LDH活性。JC-1染色结果表明,二甲双胍增加了吉西他滨的促线粒体凋亡作用。以上结果表明,二甲双胍和吉西他滨在抑制胆管癌细胞增殖及促进胆管癌细胞线粒体凋亡方面表现出协同作用。在机制的研究中发现,二甲双胍联合吉西他滨抑制了HCC9810和RBE细胞中PKM2的表达;PKM2激动剂ML265减弱了二甲双胍联合吉西他滨对胆管癌细胞促凋亡作用,说明PKM2可能介导二甲双胍协同吉西他滨的促凋亡作用。
综上所述,本研究发现二甲双胍可能通过抑制胆管癌细胞PKM2的表达、激活线粒体凋亡来增强胆管癌细胞对吉西他滨的敏感性。
