红花注射液对肺癌A549细胞迁移的影响及分子机制研究
2020-04-07乔婷婷钟亮亮朱宗鑫胡耿维吴志浩
乔婷婷,钟亮亮,朱宗鑫,胡耿维,潘 星,吴志浩,2
(皖南医学院 1.肿瘤微环境研究室;2.医学生物学教研室,安徽 芜湖 241002)
红花注射液是一种从中药红花中提取而来,其主要成分为红花醌苷、红花素、花黄色素等的复合物,临床上具有活血化瘀、改善微循环、增加组织血液灌流量等作用[1]。临床上应用较广泛的是其从中药红花中提取制备的灭菌水溶液,其主要成分为红花黄色素,具有一定的抗肿瘤作用[2]。但是,目前对于红花注射液的抗肿瘤作用还知之甚少,其具体的抗肿瘤机制仍缺乏深入的探讨。因此,本文通过研究红花注射液的抗癌作用,发现其抑制肺腺癌A549细胞迁移,为今后的临床治疗和中药联合治疗提供了理论与实验依据。
1 材料与方法
1.1 细胞株 A549细胞(人源非小细胞肺腺癌上皮细胞系,ATCC)。
1.2 药品与试剂 红花注射液(华润三九药业有限公司,批号17120202003,国药准字Z51020673);NF-κB抗体、Snail抗体、p-GSK-3β抗体、GSK-3β抗体购于CST公司;β-actin抗体、DMSO(sigma公司,美国);polyjet(Signa Gen公司);小牛血清(CIBCO公司,美国);DMEM(HyClone公司,美国);pRL-CMV质粒(Promega公司,美国);siRNA(吉玛公司,中国);GSK-3β抑制剂(Merck公司,美国);流式凋亡试剂盒(BD公司,美国);丽春红染液、MTT、TEMED(碧云天公司,中国);NC膜(PALL公司,美国)。
1.3 仪器 CO2培养箱(Eppendorf公司,德国);BioTek酶标仪(伯腾公司,美国);流式细胞仪(BD公司,美国);离心机(Eppendorf公司,德国);4℃水平摇床(New Brunswick公司,美国);化学发光显影成像系统(GE公司,美国);金属浴D1100-230V(Labnet AccuBlock公司,美国)。
1.4 方法
1.4.1 细胞复苏 将人肺腺癌A549细胞从-80℃冰箱中取出,放在水浴锅中轻轻摇晃,待融化后1500 r/min离心4 min,倒掉上清,加入含有10%小牛血清和抗生素的DMEM培养基,混匀制成细胞悬液,放置37℃、5%CO2的细胞培养箱中培养。
1.4.2 MTT比色法检测A549细胞的增殖抑制率 将A549细胞接种到96孔培养板中,待细胞密度长至80%左右,分别按以下分组:阴性对照组(加相同剂量的DMSO终体积为100 μL/孔)、红花注射液组(100、200、300、400、500 mL/L)处理培养12 h(药物组用DMEM配好相应的浓度分装在不同的EP管里,随后打入96孔板,每孔终体积为100 μL)。后加入5 μg/mL的MTT溶液,避光继续放至培养箱中培养,4 h后吸去上清液,加入二甲基亚砜(DMSO)100μL/孔,摇床上避光摇15 min,用酶标仪在波长为490 nm处测定其吸光度OD值。细胞增殖抑制率计算公式:增殖抑制率(%)=(对照组值-药物组值)/对照组值×100%。
1.4.3 流式细胞术检测A549细胞凋亡 胰酶消化处于对数生长期的A549细胞接种于六孔板,待细胞长至80%时饥饿过夜,加入红花注射液(100、200 mL/L)(根据WB结果选取最适浓度),于37℃、5%CO2培养箱中培养12 h,离心收集细胞,使用1×Bingding Buffer吹打细胞重悬转移至5 mL培养管中,同时加入5 μL Annexin V-FITC和5 μL PI 染液,轻轻涡旋细胞悬液并在室温下(25℃)在黑暗中孵育15 min,最后向管中加入400 μL 1×Bingding Buffer,流式细胞仪分析细胞凋亡。
1.4.4 细胞划痕实验检测A549细胞的迁移能力 细胞接种于六孔板,待密度长至90%时,用枪头沿着细胞表面划出一条笔直的线;轻轻摇动六孔板,吸去培养基,用PBS洗涤5~6次,直至脱落的细胞完全洗去,在倒置显微镜下观察细胞的划痕情况;后饥饿细胞过夜并加100、200 mL/L红花注射液处理。镜下分别于红花注射液处理的0、24、48 h观察细胞的迁移情况并拍照。用image J软件量化分析。
1.4.5 双荧光素酶报告基因实验 细胞接种于十二孔板,待细胞密度达到一定时,更换含有10%小牛血清的DMEM培养基,转染Snail启动子,5 h后换液,48 h后饥饿过夜,加入不同浓度红花注射液处理。12 h后用外用1×PBS清洗两次,配制1×PLB裂解液,每孔100 μL,然后将12孔板放在摇床上晃动20 min,4℃,14000 g,离心15 min,将上清转移至新的EP管中,上机检测。
1.4.6 质粒DNA转染和siRNA转染 将A549细胞铺于六孔板中,当细胞密度达到80%时,更换含有血清无抗生素的培养基,转染siRNA和cDNA,6 h后更换新鲜培养基,转染48 h后,DMEM饥饿12 h加入不同浓度的红花注射液。NF-κB siRNA的正义链序列为5′GCGACAGGUGCAGA-AAGAdTdT3,反义链序列为3′dTdTCGCUGUUCCACGUCUUUCU5。
1.4.7 Western blot 将A549细胞进行铺板,贴壁长满后饥饿过夜。分别加入不同浓度(50、100、150、200、250 mL/L)的红花注射液(根据MTT结果,红花注射液在浓度为300 mL/L已达到半数致死量,故设置300 mL/L以下的浓度梯度),12 h后收样。使用Laemmli sample buffer裂解液收集细胞,进行电泳跑胶转膜封闭。所剪的蛋白条带在4℃低温摇床中孵育相应一抗过夜,室温孵育相应二抗1 h,后在AI600化学发光成像仪中显影。

2 结果
2.1 红花注射液对A549细胞增殖抑制率的影响 不同浓度红花注射液(100、200、300、400、500 mL/L)分别作用于A549细胞后,与对照组比较,各浓度的红花注射液对A549细胞的增殖均有抑制作用,差异具有统计学意义(F=17.851,P<0.05,组间差异有统计学意义)。且红花注射液抑制作用随着浓度的提高也逐渐增强,即具有剂量依赖性(图1)。
2.2 红花注射液对A549细胞凋亡的影响 红花注射液(100、200 mL/L)作用于A549细胞12 h后,与对照组相比,药物组随着红花注射液浓度的增加凋亡细胞数增多(图2)(F=12.30,P<0.05,组间差异有统计学意义)。
2.3 红花注射液对A549细胞迁移的影响 100、200mL/L红花注射液作用于A549细胞0、24、48 h后于显微镜下拍照观察细胞的迁移情况,以伤口愈合面积来判定细胞的迁移能力。结果显示,对照组随着时间的增加伤口愈合面积增加,伤口逐渐变小,表示细胞的迁移能力增加,而药物组随着时间的增加伤口愈合面积较对照组减少,并且伤口愈合面积随着浓度的增加而减少,表示红花抑制A549细胞的迁移(图3)(F=26.218,P<0.05,组间差异有统计学意义)。

注:与Safflower 0 mL/L相比,***P<0.001;与药物组相比,*P<0.05。
图1 不同浓度红花注射液对A549细胞的浓度-抑制率曲线

注:与Safflower 0 mL/L相比,*P<0.05。
图2 不同浓度红花注射液对A549细胞凋亡的影响
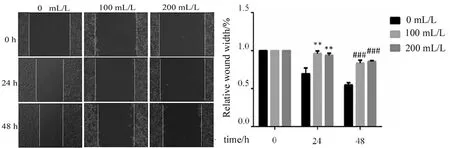
注:与Safflower 0 mL/L相比,**P<0.01,###P<0.001。
图3 不同浓度红花注射液对A549细胞迁移的影响
2.4 红花注射液下调Snail蛋白的表达 红花注射液(0、50、100、150、200、250 mL/L)作用于肺癌A549细胞12 h后,Snail蛋白表达均降低,并且高浓度红花注射液处理组较低浓度处理组表达更低,具有浓度依赖性(图4)。
2.5 红花注射液在转录水平抑制Snail的表达 不同浓度浓度红花注射液处理A549细胞后,通过双荧光素酶报告基因检测,与对照组相比,随着浓度的增加,Snail启动子活性下降,不同浓度红花注射液处理组间的比较均具有统计学差异(F=11.918,P<0.05,组间差异有统计学意义)(图5A)。转染NF-κB siRNA后,Snail启动子活性下降更明显,差异具有统计学意义(图5B)(F=10.373,P<0.05,组间差异有统计学意义)。

图4 不同浓度红花注射液对A549细胞Snail蛋白表达的影响

A:与Safflower 0 mL/L相比,*P<0.05,**P<0.01;B:与Safflower 0 mL/L相比,**P<0.01,##P<0.01。
图5 NF-κB在转录水平调控Snail启动子活性
2.6 红花注射液通过GSK-3β-NF-κB下调Snail蛋白的表达 Western blot结果显示不同浓度红花注射液作用A549细胞后,NF-κB蛋白水平以浓度依赖性方式下降(图6A);转染NF-κB siRNA后,结果显示Snail随着NF-κB的沉默而下降(图6B);应用GSK-3β通路抑制剂预处理A549细胞1 h后,加入200 mL/L红花注射液,与对照组相比,单独加药组GSK-3β失活形式p-GSK-3β和NF-κB、Snail表达均下降,与单独加药相比,抑制剂处理组中p-GSK-3β表达上升,NF-κB、Snail蛋白表达亦随之上升(图6C);A549细胞中转染GSK-3β cDNA并加入不同浓度红花注射液(50、100 mL/L),NF-κB和Snail蛋白表达随着GSK-3β过表达而下降(图6D)。
3 讨论
近年来肺癌的治疗及预后有了重大的进展,增进了我们对肿瘤进展机制的理解,并推动了早期检测和多模式护理的发展,然而,肺癌的总体治愈率和存活率仍然很低,特别是在转移性疾病中[3]。因此,需要继续深入研究新药的机制以将临床益处扩大到更广泛的患者群体中。红花,菊科植物红花的干燥管状花,是预防和治疗心血管疾病最常用的传统药物之一[4]。通常通过煎煮和酒精沉淀的方法制备红花注射剂[5]。据报道,红花注射液具有多种药理特性,是一种活化血液循环、消散血瘀的中药,并且在以单一或复方制剂形式的临床环境中被广泛用作抗肿瘤治疗药物[6]。研究发现红花注射液对肝癌、胃癌和肺癌等实体肿瘤细胞均具有抑制作用,但其具体抗癌作用机制尚不明确。本文研究结果显示,经不同浓度红花注射液处理后,A549细胞增殖率和迁移受到抑制,并且凋亡率增加。表明红花注射液通过抑制A549细胞增殖和迁移、促进凋亡来发挥抗癌作用,但其具体的分子机制仍需探讨。
上皮间质-转化(EMT)是一种高度保守的过程,其中极化的上皮细胞失去黏附和紧密连接,成为迁移间充质细胞,是在胚胎发生,伤口愈合和癌症发病的背景下的一种细胞程序[7]。已有文献鉴定了几种激活EMT的转录因子。然而这些EMT诱导转录因子中的一些通常在侵袭-转移级联开始之前很长时间以及在非侵入性肿瘤中表达[8]。Snail作为EMT中E-钙黏蛋白表达的关键转录抑制因子,在胚胎发育和肿瘤进展中起重要作用[9]。EMT中的关键分子事件是Snail介导的上皮标记物E-钙黏蛋白的下调,其导致细胞与细胞黏附的破坏以及随后获得更多的迁移和侵袭性表型[10]。NF-κB家族的转录调节因子促进超过100个靶基因的表达,其中大多数参与宿主免疫应答[11]。基因敲除和其他研究也确立了NF-κB在免疫系统个体发育中的作用,也证明了NF-κB在肿瘤的发生发展中的作用[12]。有研究表明,NF-κB也是促进EMT的一个主要的转录因子[13]。本实验通过WB法证明红花注射液可能通过下调Snail和NF-κB蛋白的表达来发挥其抑癌作用。根据之前的研究报道以及对Snail启动子上可能存在的转录因子进行分析,发现Snail启动子上存在NF-κB转录因子的结合位点,于是猜想红花注射液可能通过转录因子NF-κB在转录水平调控Snail的表达,因此,通过双荧光素酶报告基因系统检测不同浓度红花注射液对Snail启动子活性的影响,结果显示红花注射液通过NF-κB在转录水平调控Snail的表达。而文献报道NF-κB的活性又受到GSK-3β激活的调节[14-15]。因此本实验通过抑制剂进一步确认GSK-3β通路参与调控Snail和NF-κB的蛋白表达。

图6 红花注射液通过GSK-3β-NF-κB通路下调Snail表达
总之,实验结果表明红花注射液能显著抑制A549细胞的增殖迁移并诱导凋亡,其相关的机制可能与GSK-3β-NF-κB-Snail通路有关。实验的下一步旨在探索:①NF-κB在Snail启动子上发挥作用的具体结合位点以及定点突变辅以验证。②GSK-3β是如何调控NF-κB的表达,是否促进NF-κB的核移位进而上调Snail启动子活性还是通过其他途径发挥作用?此外,本研究结果还需进一步的体内实验以及对正常细胞是否具有一定的毒性加以验证,为红花注射液的临床应用奠定了实验基础。
