昆明地区耐碳青霉烯类抗生素铜绿假单胞菌的分子流行病学特点及耐药特征分析
2024-01-01周飞李小凤梁媛李洁姜波单斌宋贵波
周飞 李小凤 梁媛 李洁 姜波 单斌 宋贵波

摘要:目的 研究耐碳青霉烯類抗生素铜绿假单胞菌分子流行病学规律及耐药机制,为临床预防和治疗铜绿假单胞菌的感染提供理论依据。方法 对多中心收集的耐碳青霉烯类抗生素铜绿假单胞菌(carbapenems-resistant Pseudomonas aeruginosa, CRPA)开展多位点序列分型(multilocus sequence typing, MLST)和遗传信息研究,并对碳青霉烯酶基因与外膜孔蛋白OprD编码基因进行序列分析。结果 多位点序列分型方法将81株CRPA分为36个ST型,总体以ST3390(41.98%,34/81)为主,其中有5种为新发现的ST型别;CRPA菌株中碳青霉烯酶基因的检出率较高(65.43%,53/81),尿液标本检出率最高(80.00%,28/35),其中IMP、VIM和NDM型碳青霉烯酶基因检出率分别为37.04%、27.16%和1.23%,未检测到KPC、GES、SPM和OXA-40型碳青霉烯酶基因;oprD基因的序列比对分析发现,高达96.29%(78/81)CRPA临床分离株发生了各种类型的突变,以单个或者多个碱基的插入或缺失为主(76.54%,62/81)。结论 81株CRPA主要的耐药机制为膜孔蛋白基因突变和产碳青霉烯酶;存在ST3390克隆株的局部流行,应加强医院感染防控措施,防止暴发流行。
关键词:铜绿假单胞菌;分子流行病学;多位点序列分型;碳青霉烯类抗生素;耐药机制
中图分类号:R378.99+1 文献标志码:A
Molecular epidemiological and drug resistance characteristics of carbapenem-resistant Pseudomonas aeruginosa in Kunming
Zhou Fei1,2,3, Li Xiao-feng1,2,3, Liang Yuan1,2,3, Li Jie1,2,3, Jiang Bo1,2,3, Shan Bin1,2,3, and Song Gui-Bo1,2,3
(1 Department of Clinical Laboratory of the First Affiliated Hospital of Kunming Medical University, Kunming 650032;
2 Yunnan Key Laboratory of Laboratory Medicine, Kunming 650032; 3 Yunnan Province Clinical Research Center
for Laboratory Medicine, Kunming 650032)
Abstract Objective To explore the molecular epidemiology and drug resistance mechanism of carbapenem resistant Pseudomonas aeruginosa (CRPA), and to provide theoretical basis for clinical prevention and treatment of Pseudomonas aeruginosa infection. Methods Multilocus sequence typing (Multilocus Sequence Typing, MLST) and genetic information of carbapenem resistant Pseudomonas aeruginosa collected from multiple centers were studied, and the sequences of carbapenemase gene and outer membrane porin OprD coding gene were analyzed. Results 81 strains of CRPA were divided into 36 ST types by multilocus sequence typing. The ST3390 (41.98%, 34/81) was the main type, and five ST types were newly discovered. The carbapenemase gene in CRPA strains was higher (65.43%, 53/81), especially in urine samples (80.00%, 28/35), of which IMP, VIM, and NDM carbapenemase enzyme genes were 37.04%, 27.16%, and 1.23%, respectively, and KPC, GES, SPM, and OXA-40 carbapenemase genes were not detected. Up to 96.29% (78/81) of the CRPA clinical isolates had various types of mutations in the gene oprD, which were dominated by single or multiple base insertions or deletions (76.54%, 62/81). Conclusion The main drug resistance mechanisms of 81 strains of CRPA are porin gene mutation and carbapenemase production. There is a local epidemic of ST3390 clone, prevention and control measures should be strengthened to prevent outbreaks.
Key words Pseudomonas aeruginosa; Molecular epidemiology; MLST; Carbapenem antibiotics; Drug resistance mechanism
铜绿假单胞菌(Pseudomonas aeruginosa, PA)广泛分布于自然界以及健康人的皮肤、肠道和呼吸道,是一类重要的革兰阴性条件致病菌[1]。它是引发院内感染的重要病原体,也是导致免疫功能低下患者高死亡率的重要原因[2]。近年来由于亚胺培南和美罗培南等碳青霉烯类药物的广泛应用,导致耐碳青霉烯类抗生素铜绿假单胞菌(carbapenem-resistant Pseudomonas aeruginosa, CRPA)在世界范围内广泛流行[3]。据CHINET中国细菌耐药监测网((http://www.chinets.com)显示,2021年全国24035株铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为23.0%和18.9%,耐药形势不容乐观。
CRPA通常只对黏菌素有效,加大了感染后临床治疗的难度[4]。流行病学研究确定了耐碳青霉烯类抗生素铜绿假单胞菌感染的相关危险因素和多种耐药机制,如医疗设备的使用、抗生素滥用、碳青霉烯酶的产生、多药外排泵的过度表达、膜孔蛋白的丢失和生物膜形成等[5-6]。而碳青霉烯酶的产生是铜绿假单胞菌获得碳青霉烯类耐药性的最重要机制之一,它可以水解碳青霉烯类在内的大部分抗生素,并可以通过各种遗传元件水平获得各种耐药基因,使其可在同种或不同种属菌株之间克隆传播[7]。然而,铜绿假单胞菌可以通过获得编码碳青霉烯酶的可转移基因获得对碳青霉烯类抗生素的耐药性,而其高克隆多样性通常会导致酶型携带的差异,如ST111分离株就被发现有很高的IMP-9和VIM-2流行率[8],表明铜绿假单胞菌存在克隆株的地区分布差异和遗传背景差异,因此有必要详细的分析CRPA在各个地区的流行病学规律、分子特点和遗传特征,才能更好的为铜绿假单胞菌的临床预防策略和精准治疗提供理论依据。本研究选取昆明地区两家三甲医院收集的CRPA菌株,从MLST分型、耐药基因分析到种群结构分析,以全面揭示该地区CRPA菌株的分子耐药特征和遗传特征。
1 材料与方法
1.1 菌株收集与药敏分析
收集2017年1月—2021年2月期间分别从昆明医科大学第一附属医院和第二附属医院临床标本中部分检出并分离的耐碳青霉烯类抗生素铜绿假单胞菌(carbapenems-resistant Pseudomonas aeruginosa,CRPA)共81株。菌株纳入标准:对亚胺培南、美罗培南中至少一种耐药,剔除同一患者相同部位检出的重复菌株。铜绿假单胞菌ATCC27853作为质控菌株,由本实验室保存。参照《全国临床检验操作程序》,使用全自动微生物质谱鉴定系统和VITEK2 Compact微生物鉴定及药敏分析系统对菌株进行培养鉴定及药敏分析,采用多黏菌素药物敏感性检测及临床解读专家共识[9]判读多黏菌素B的药敏结果,其余的12种抗生素药敏结果采用CLSI标准判读。本研究已通过昆明医科大学第一附属医院伦理研究委员会批准(编号:L-20/2021)。
1.2 MLST分型
参照Curran等[10]在前人的基础上开发出的用于铜绿假单胞菌的MLST方案,其方案是通过扩增铜绿假单胞菌内部的7个管家基因(acsA、aroE、guaA、mutL、nuoD、ppsA和trpE),然后通过测序后的序列与数据库进行比对分配出相应的7个等位基因号,上传等位基因号后输出对应的序列型别(sequence type, STs)。本研究中将阳性扩增子送到北京博迈德基因技术有限公司运用Sanger法进行双向测序,将测序所得的等位基因谱(acsA-aroE-guaA-mutL-nuoD-ppsA-trpE)上传至PubMLST管家基因数据库(https://pubmlst.org/organisms/),从而确定序列型别(ST)。
1.3 PCR检测碳青霉烯酶基因及膜孔蛋白基因oprD
使用细菌基因组DNA提取试剂盒(天根,北京)提取细菌DNA。合成特异性引物并分别对碳青霉烯酶基因(A类:blaKPC和blaGES;B类:blaIMP、blaVIM、blaSPM、blaNDM;D类blaOXA-40)以及外膜孔蛋白基因oprD進行PCR扩增。扩增条件为95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s(外膜孔蛋白OprD退火温度为61 ℃),72 ℃延伸1 min,35个循环;72 ℃终延伸10 min。PCR产物于2%琼脂糖凝胶中电泳,凝胶成像仪拍照并记录结果。PCR阳性扩增子送到北京博迈德基因技术有限公司运用Sanger法进行双向测序,对碳青霉烯酶基因及膜孔蛋白基因oprD测序结果进行序列比对,确定碳青霉烯酶基因亚型和膜孔蛋白oprD突变情况。
1.4 MLST种群结构分析
将所有菌株的ST型别信息导入BioNumerics软件,分析各ST型之间的克隆关系,并生成最小生成树(minimum spanning tree, MST)。克隆复合体(clone complex,CC)被定义为含有两个及两个以上STs且7个等位基因中有6个等位基因相同的所有STs型别的一个集合[8]。
2 结果
2.1 CRPA菌株的临床特征及药物敏感性分析
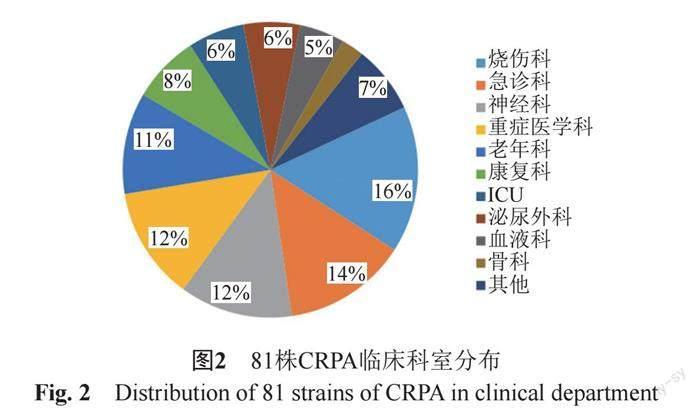
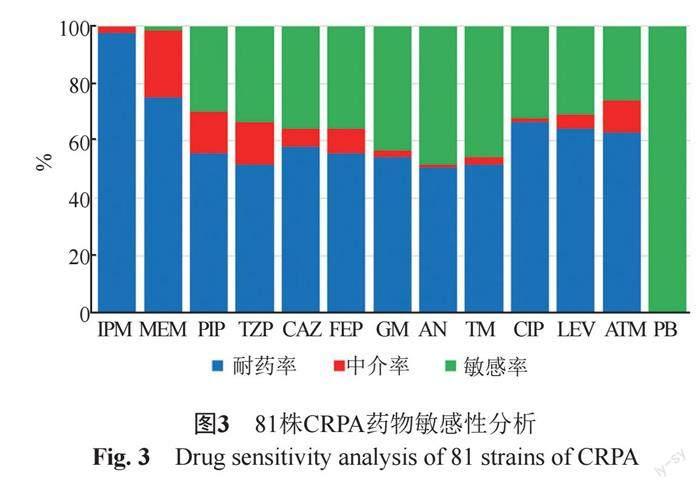
本研究共收集到来自临床住院患者的81株CRPA,标本类型包括尿液43.21% (35/81)、分泌物18.52%(15/81)、血液16.05%(13/81)、引流液11.11%(9/81)、肺泡灌洗液4.94%(4/81)、脑脊液2.47%(2/81)、胆汁2.47%(2/81)和腹水1.23%(1/81)(图1);科室分布主要以烧伤科和急诊科为主,分别占比16.05%(13/81)、13.58%(11/81)(图2)。药敏结果显示71.60%(58/81)CRPA为多重耐药菌,未发现对多黏菌素B(PB)耐药菌株,8类共13种抗菌药物的药敏结果见图3。
2.2 CRPA菌株MLST分型及种群结构分析
81株CRPA总共检出36种不同的STs型别,以ST3390最为常见(41.98%,34/81),其中发现5种新的STs型别:ST3645、ST3646、ST3647、ST3648、ST3649(图4)。本研究中,ST3390除对多黏菌素B表现为敏感外,对其余抗生素表现为高度耐药(图5)。遗传进化结果显示,81株CRPA由两个克隆分化而来,最大的克隆群由ST3649,ST3647和ST3390组成,其中ST3390为该克隆群的核心;另一个克隆复合体由ST234和ST3282组成(图6)。
2.3 碳青霉烯酶基因携带情况
81株CRPA分离株检出IMP型、VIM型和NDM型基因,其中碳青霉烯酶基因的检出率为65.43%(53/81),其中,IMP-9型检出率为37.04%(30/81),VIM-2型检出率为27.16%(22/81),NDM-1型检出率为1.23%(1/81)。
2.4 外膜蛋白OprD基因的突变分析
78株(96.29%,78/81)CRPA发生了不同形式的突变。oprD基因序列发生突变的菌株有73株(90.12%, 73/81),其中62株因单个或多个碱基的缺失或插入导致其发生框移突变,6株因碱基突变致终止密码子提前出现,5株发生氨基酸替换;另外5株可能为大片段缺失导致PCR结果为阴性(表1)。
3 讨论
本次研究的81株菌株被分为36种不同的序列型别,这表明本地区STs型别丰富多样,铜绿假单胞菌的感染来源和途径多样化,提示需要进一步做好感染控制和感控传播各个环节的工作。36种STs中,ST3390是优势型别,占41.98%。检测到全球范围内广泛传播的ST244和ST357菌株,其形成的克隆复合体的传播是全球多起感染暴发流行的重要型别之一[11]。结合药敏结果,发现CRPA除了对多黏菌素敏感外,对临床上常用的抗假单胞菌药物的耐药率普遍较高(>50%),特别是优势型别ST3390有着极高的耐药率,表明本地区铜绿假单胞菌对抗菌药物的耐药情况非常严峻,应高度重视抗生素治疗失败或者效果不理想造成的抗生素选择下ST3390菌株克隆传播和暴发流行。
碳青霉烯酶的产生是铜绿假单胞菌对碳青霉烯类抗生素高水平耐药的重要原因,因其可以水解碳青霉烯类在内的大部分抗生素类别。目前,铜绿假单胞菌中检出的有KPC、GES、IMP、VIM、SPM、NDM、SIM 和OXA类等10余种碳青霉烯酶,其中IMP和VIM型是B类酶型中最常见的类型[12-13]。本研究CRPA菌株中碳青霉烯酶的检出率较高(65.43%, 53/81),其中高达84.62%(11/13)血液分离的CRPA菌株检测到IMP-9或者VIM-2,高达88.24%(30/34)ST3390菌株中携带有VIM-2或者IMP-9酶基因,这可能是导致这些菌株对除多黏菌素B之外的其它抗生素均表现高水平耐药的重要原因之一。值得注意的是,尿液标本中的碳青霉烯酶VIM-2或IMP-9基因,检出率更高达80.00%(28/35),表明尿液中分离的铜绿假单胞菌耐药情况较为严重,需要进一步的研究和引起临床重视。
此外,铜绿假单胞菌外膜蛋白OprD表达下调或缺失是造成对亚胺培南耐药的重要原因[14]。本研究中,高达96.29%(78/81)CRPA分离株存在不同类型的oprD基因突变,甚至高于Yin等[8]报道中国西南医院烧伤病房对碳青霉烯类非敏感的铜绿假单胞菌中89%的菌株存在oprD基因突变的结果。本次研究中突变类型最多的是单个或多个碱基的插入或缺失(76.54%,62/81),其中两种氨基酸替换组合为T103S,K115T,F170L和T103S,K115T,F170L,E185Q,P186G,V189T,R310E,A315G,G425A。结果与文献报道的研究一致,loop L2(T103S、K115T和V127L),loop L3(F170L、E185Q、P186G和V189T)和loop L6(R310E、A315G)是OprD蛋白最常见的氨基酸点突变类型[15-16]。研究还发现[14]nt1116-1118缺失碱基GTC将导致loop L7上第372-383之间的氨基酸发生由“MSDNNVGYKNYG”到“VDSSSSYAGL”,由此会产生截短2個氨基酸序列的突变,本研究中有13株CRPA菌株也发生了此改变,其中6株对亚胺培南耐药,美罗培南中介耐药。此外,3株分离菌(CRPA40、CRPA57和CRPA63)未发生任何形式的突变,表明其对碳青霉烯类耐药可能是由其它机制介导的。34株ST3390菌株均发生109位置碱基A的缺失,表明某一特定型别的菌株可能在OprD的突变中具有某种特定的突变模式,需要进一步深入研究。
综上所述,本研究从CRPA菌株的分子分型、碳青霉烯酶分型及膜孔蛋白基因的突变情况3个方面初步探讨了耐碳青霉烯类抗生素铜绿假单胞菌的分子流行病学特点及耐药机制,有助于研究者进行流行病学分析,以便加强抗菌药物的合理使用及新型药物的研发。同时,临床应加强对细菌的耐药性监测,定期开展分子流行病学研究,以便更好地监测及预防耐药菌株的暴发流行。
参 考 文 献
Pachori P, Gothalwal R, Gandhi P. Emergence of antibiotic resistance Pseudomonas aeruginosa in intensive care unit: A critical review[J]. Gen Dis, 2019, 6(2): 109-119.
Zhang Y, Chen X L, Huang A W, et al. Mortality attributable to carbapenem-resistant Pseudomonas aeruginosa bacteremia: A meta-analysis of cohort studies[J]. Emerg Microbes Infect, 2016, 5(3): e27.
Muderris T, Durmaz R, Ozdem B, et al. Role of efflux pump and OprD porin expression in carbapenem resistance of Pseudomonas aeruginosa clinical isolates[J]. J Infect Develop Countr 2018, 12: 1-8.
van der Zee A, Kraak W B, Burggraaf A, et al. Spread of carbapenem resistance by transposition and conjugation among Pseudomonas aeruginosa[J]. Front Microbiol, 2018, 9: 2057.
Patel K, Kram J J, Baumgardner D J. Risk factors associated with carbapenem-resistant Pseudomonas aeruginosa[J]. WMJ, 2017, 116(5): 210-214.
Pang Z, Raudonis R, Glick B R, et al. Antibiotic resistance in Pseudomonas aeruginosa: Mechanisms and alternative therapeutic strategies[J]. Biotechnol Adv, 2019, 37(1): 177-192.
Bialvaei A Z, Kafil H S, Leylabadlo H E, et al. Dissemination of carbapenemases producing Gram negative bacteria in the Middle East[J]. Iran J Microbiol, 2015, 7(5): 226-246.
Yin S, Chen P, You B, et al. Molecular typing and carbapenem resistance mechanisms of Pseudomonas aeruginosa isolated from a Chinese burn center from 2011 to 2016[J]. Front Microbiol, 2018, 9: 1135.
楊启文, 胡付品, 张菁, 等. 多黏菌素药物敏感性检测及临床解读专家共识[J]. 协和医学杂志, 2020, 11(5): 559-570.
Curran B, Jonas D, Grundmann H, et al. Development of a multilocus sequence typing scheme for the opportunistic pathogen Pseudomonas aeruginosa[J]. J Clin Microbiol, 2004, 42(12): 5644-5649.
Ji J, Wang J, Zhou Z, et al. Multilocus sequence typing reveals genetic diversity of carbapenem- or ceftazidime-nonsusceptible Pseudomonas aeruginosa in China[J]. Antimicrob Agents Chemother, 2013, 57(11): 5697-5700.
Li F, Chen D, Li L, et al. Analysis of metallo-beta-lactamases, oprD mutation, and multidrug resistance of beta-lactam antibiotic-resistant strains of Pseudomonas aeruginosa isolated from Southern China[J]. Current Microbiology, 2020, 77(11): 3264-3269.
Pfennigwerth N, Geis G, Gatermann S G, et al. Description of IMP-31, a novel metallo-beta-lactamase found in an ST235 Pseudomonas aeruginosa strain in Western Germany[J]. J Antimicrob Chemother, 2015, 70(7): 1973-1980.
Fang Z L, Zhang L Y, Huang Y M, et al. OprD mutations and inactivation in imipenem-resistant Pseudomonas aeruginosa isolates from China[J]. Infect Genet Evol, 2014, 21: 124-128.
Farra A, Islam S, Stralfors A, et al. Role of outer membrane protein OprD and penicillin-binding proteins in resistance of Pseudomonas aeruginosa to imipenem and meropenem[J]. Int J Antimicrob Agents, 2008, 31(5): 427-433.
Ocampo-Sosa A A, Cabot G, Rodríguez C, et al. Alterations of OprD in carbapenem-intermediate and -susceptible strains of Pseudomonas aeruginosa isolated from patients with bacteremia in a Spanish multicenter study[J]. Antimicrob Agents Chemother, 2012, 56(4): 1703-1713.
