饮水摄入抗生素对小鼠肠道菌群的影响
2024-01-01马晶王德亚田忠景康美玲李庆亮朱峰孙夏丁诚实
马晶 王德亚 田忠景 康美玲 李庆亮 朱峰 孙夏 丁诚实

摘要:目的 采用抗生素饮水饲喂小鼠,观察抗生素对肠道菌群的影响。方法 高通量测序,分析肠道菌群的共有和特有OTUs、多样性和复杂度;PCA、NMDS、PCoA和 UPGMA聚类树作多样本比较分析;聚类热图和柱状图分析小鼠肠道菌群相对丰度并预测肠道菌群功能的改变。结果 饮水摄入抗生素能够显著降低肠道菌群的物种丰富度、多样性、复杂度,升高优势菌群的总体占比,变形菌门的肠道细菌对抗生素的拮抗能力更强,并可能影响其功能。结论 抗生素具备改变肠道菌群的作用,需做好食品特别是饮用水受其污染的防控工作。
关键词:抗生素;肠道菌群;高通量测序
中图分类号:R978.1 文献标志码:A
Effects of antibiotics intaken by drinking water on intestinal microbiota in mice
Ma Jing, Wang Deya, Tian Zhongjing, Kang Meiling, Li Qingliang, Zhu Feng, Sun Xia, and Ding Chengshi
(College of Life Science, Zaozhuang University, Zaozhuang 277160)
Abstract Objective In this study, mice were fed with antibiotics by drinking water, and their effects on intestinal microbiota were observed. Methods The public and unique OTUs, the sample diversity, and the sample complexity were obtained by high-throughput sequencing. The multiple comparative analysis was observed by PCA plot, NMDS plot, PCoA plot, and UPGMA clustering tree. The clustering heatmap and barplot were used to analyze the species abundance of intestinal flora and predict changes in intestinal flora function. Results Intake of antibiotics in drinking water can significantly reduce the species richness, diversity, and complexity of intestinal flora, and increase the overall proportion of dominant flora. Proteobacteria intestinal bacteria have stronger antagonistic ability to antibiotics. It may affect its function. Conclusion Antibiotics can change the intestinal flora, and thus it is necessary to prevent and control the antibiotic contamination of food, especially drinking water.
Key words Antibiotics; Intestinal microbiota; High-throughput sequencing
抗生素是指由微生物或高等动植物在生活过程中所产生的具有抗病原体或其它活性的一类次级代谢物,能干扰其他细胞生长的化学物质[1-2]。其在养殖业中的大量使用成为畜禽抗病增产的有效保证,为食品产业的发展提供源源不断的原材料[3-5]。抗生素随粪便和污泥施肥进入土壤,随雨水地表径流迁移至河流、湖泊和水库等污染地表水,还可通过渗滤作用污染地下水[6-8]。最近研究发现上海儿童尿液中检出21种抗生素,而这些抗生素主要来源于饮用水与食品[9]。
为了抵抗抗生素,细菌通过基因突变,获得耐药基因而成为耐药菌。耐药基因可以长期残留在畜禽养殖附近的水、土壤和大气等环境中并在食品加工储藏过程中转移传播给其它微生物,被认为是一种新型的食品和水体污染物。特别是在抗生素的胁迫下,食品中耐药基因的转移和扩散变得越来越容易[10-12]。
有研究表明,食品是耐药菌传播给人类的媒介[13-14]。而從可能存在抗生素和耐药菌的微环境方面看,动物肠道是抗生素胁迫细菌、耐药基因转移扩增的理想场所。前期研究往往关注单一抗生素对肠道菌群的影响,很少研究多抗生素的联合作用[15-16]。本文采用Illumina MiSeq PE250二代测序平台对肠道微生物V4区进行富集测序,观察多抗生素联合作用对肠道菌群结构的影响,并预测抗生素对肠道菌群功能的改变。本研究为抗生素的污染防控提供了一定的理论依据。
1 材料与方法
1.1 材料与试剂
昆明雄性小鼠(20±2)g购自北京华阜康生物科技股份有限公司,实验动物许可证号SCXK(京)2020-0004。
主要试剂:TIANamp Stool DNA Kit粪便基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;MiniBEST Agarose Gel DNA Extraction Kit购自宝生物工程(大连)有限公司;氨苄青霉素(Ampicillin,Amp,A610028)、卡纳霉素(Kanamycin,Km,A506636)、四环素(Tetracycline,Tet,A500731)购自上海生工公司;其他试剂均为国产分析纯。
1.2 仪器与设备
VS-G-1A型超净工作台(无锡云洁净化设备有限公司);NanoDrop One型超微量紫外分光光度(美国Thermo公司);ULT-7150-9V型深低温冰箱(美国Thermo公司); T100 型PCR仪(美国Bio-RAD公司);Optima XE-100型超速离心机(美国Beckman公司);Illumina MiSeq PE250二代测序平台(北京诺禾致源公司)。
1.3 实验方法
1.3.1 动物分组及饲养
小鼠随机分为4组,纯净水对照组、低剂量抗生素组、中剂量抗生素组、高剂量抗生素组。纯净水对照组:纯净水饮水饲养。低剂量抗生素组:抗生素Amp、Km、Tet各0.5 mg/L饮水饲养。中剂量抗生素组:抗生素Amp、Km、Tet各1 mg/L饮水饲养。高剂量抗生素组:抗生素Amp、Km、Tet各2 mg/L饮水饲养。连续饲养16 d,收集粪便。
1.3.2 肠道菌群物16S rRNA V4区高通量测序
使用粪便基因组提取试剂盒提取小鼠粪便中肠道菌群总DNA,对16S rRNA基因V4区扩增。引物Af-F:5'-GCGGAAACGACTTAACTGAACC-3';利用515F扩增粪便DNA样本V4区,通过Illumina MiSeq PE250二代测序平台高通量测序。
1.4 数据分析
测序得到的原始数据作为序列标签Tags,排除干扰数据,对原始数据进行拼接、过滤,得到有效数据(effective tags)。对所有样品的Effective Tags进行聚类,Uparse 软件(Uparse v7.0.1001)以97%的一致性将序列聚类成为operational taxonomic units(OTUs),然后对OTUs的代表序列进行物种注释。然后基于Effective Tags进行OTUs聚类和物种分类分析。维恩图指示组间的共有和特有OTUs信息等;T-test、MetaStat、LEfSe统计学处理和微生物生态学定量分析(quantitative insights into microbial ecology,QIIME,Version 1.9.1),计算物种α多样性指数如Observed-species、Chao1、Shannon和Simpson等指数,使用R软件(Version 2.15.3)绘制稀疏曲线(rarefaction curve)、等级聚类曲线(rank abundance curve)和物种指数组间差异箱型图(species difference boxplot),观察样品中物种的复杂性(均匀度)和物种相对丰度;使用R软件绘制主成分分析(principal component analysis,PCA)、主坐标分析(principal co-ordinates analysis,PCoA)和无度量多维标定法(non-metric multi-dimensional scaling,NMDS)图。PCA分析使用R软件的ade4包和ggplot2软件包,PCoA分析使用R软件的WGCNA,stats和ggplot2软件包,NMDS分析使用R软件的vegan软件包,UPGMA(unweighted pair-group method with arithmetic mean)方法构建样品聚类树,然后进行β多样性指数组间差异分析;QIIME软件分析,聚类热图和柱状图说明饮水抗生素摄入对小鼠肠道菌群物种相对丰度的影响;根据FAPROTAX数据库,功能聚类热图预测肠道功能的改变[17-19]。
2 结果与分析
2.1 肠道菌群OTUs的分布
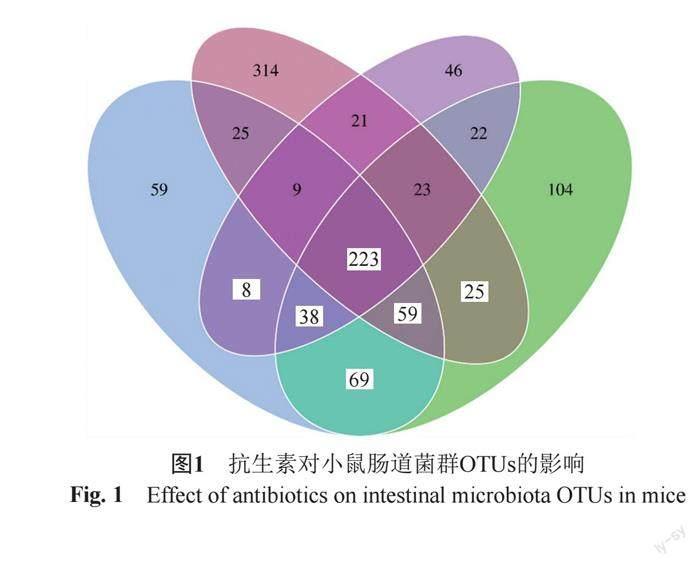
OTUs指微生物的有效代表序列,由图1可知饮水摄入抗生素能显著降低小鼠肠道菌群的总体和特有OTUs,总体OTUs数目由699(对照组)降低到563(低剂量组)、390(中剂量组)和490(高剂量组),特有OTUs数目由314(对照组)降低到104(低剂量组)、46(中剂量组)和59(高剂量组)。而OTUs可代指物种丰富度,即饮水摄入抗生素能够降低肠道菌群的丰富度。
2.2 小鼠肠道菌群样品复杂度分析
Shannon指数是用来估算样品中微生物多样性的指数,指数值越大,说明群落多样性越高。低(0.5 mg/L)、中(1 mg/L)、高(2 mg/L)剂量饮水摄入抗生素能够极显著降低小鼠肠道菌群的Shannon指数,即降低肠道菌群的多样性,但不具备量效关系。Simpson指数描述从一个群落种群连续两次抽样所得到的个体数属于同一种的概率,代指样品的均匀性,数值越大越均匀。对照组的肠道菌群物种丰度相对较均匀、较丰富,低(0.5 mg/L)、中(1 mg/L)、高(2 mg/L)剂量饮水摄入抗生素均能够显著降低Simpson指数、改变这种均匀性,减少敏感菌群的存在,增大优势菌群的占比。Chao1指数指用Chao1算法估计群落中含OTUs 数目的指数,常用来估计物种总数。低(0.5 mg/L)和高(2 mg/L)剂量饮水摄入抗生素能够显著降低Chao1指数(P<0.05),减少肠道菌群物种总数;中(1 mg/L)剂量饮水摄入抗生素能够极显著降低Chao1指数(P< 0.01),减少肠道菌群物种总数(见表1)。
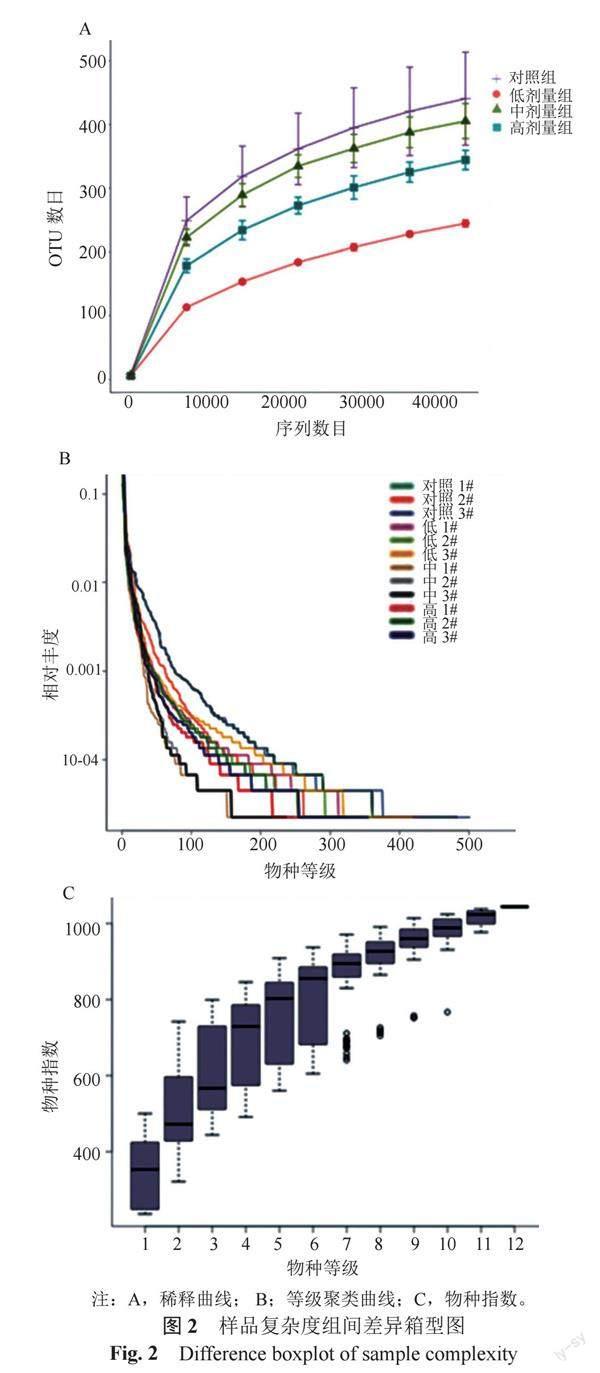
为了深入分析抗生素对小鼠肠道微生物整体结构的影响,进一步从各样本肠道菌群的丰富度和均匀度的层面研究小鼠肠道微生物的多样性。图2A样品稀释曲线结果表明随着样品测序深度的增加,观测物种指数曲线趋于平缓,各组样本的OTUs数目随着测序深度的增加基本达到饱和,说明当前测序深度足以发现各样本生境中的大部分物种;而各组样本的稀释曲线明显分开,说明各组小鼠肠道物种多样性具有较大的差异。从图2B反映物种丰富度及均匀度的物种等级聚类曲线可以看出,随着OTU等级的增加,曲线愈加平坦并且在橫轴的跨度也越来越大,说明样品中物种的均匀度和相对丰度都达到了很高的水平,且抗生素组与对照组的物种差异显著(P<0.05)。图2C反映样品中物种分布均匀,丰度较高,所测结果可用于后续分析。
2.3 小鼠肠道菌群多样本比较分析
PCA是一种应用方差分解,对多维数据进行降维,从而提取出数据中最主要的元素和结构的方法[20]。群落组成越相似,样品在图中的距离越接近。图3A表明组内样品彼此之间距离较近,菌群结构差异较小,样品重复性较好;对照组与抗生素摄入组组间距离较远,说明抗生素对肠道菌群结构的影响较大;低(0.5 mg/L)、中(1 mg/L)、高(2 mg/L)剂量饮水摄入抗生素组间差异较小且未能明显分开,说明抗生素对菌群结构影响的量效关系较差。NMDS分析根据样本中包含的物种信息,以点的形式反映在多维空间上,而对不同样本间的差异程度,则是通过点与点间的距离体现,能够反映样本的组间和组内差异等[18]。图3B结果与图3A类似,组内样品距离较近,菌群结构差异较小,样品重复性好;对照组与抗生素摄入组组间距离远,说明抗生素对肠道菌群结构的影响较大;中剂量(1 mg/L)饮水摄入抗生素对样品菌群结构的影响最大,低剂量(0.5 mg/L)和高剂量(2 mg/L)饮水摄入抗生素对肠道菌群结构的影响相似。PCoA分析是通过一系列的特征值和特征向量排序从多维数据中提取出最主要的元素和结构,样品距离越接近,表示物种组成结构越相似、群落结构相似度越高[18]。图3C也表明组内差异较小,组间差异较大,抗生素饮水摄入能够影响小鼠的肠道菌群结构。在图3D UPGMA聚类树图中,低(0.5 mg/L)、中(1 mg/L)、高(2 mg/L)剂量饮水摄入抗生素均能够降低小鼠肠道菌群的均匀性和丰度,非优势菌群如无壁菌门(Tenericutes)、放线菌门(Actinobacteria)、梭菌门(Fusobacteria)、脱铁杆菌门(Deferribacteres)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)和蓝藻细菌(Cyanobacteria)总体占比减小。优势菌群如拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)总体占比增大,其中变形菌门增加明显,由3.1%分别增加到27.1%(低剂量抗生素)、15.7%(中剂量抗生素)和12.9%(高剂量抗生素),增加的程度与抗生素的剂量呈负相关。厚壁菌门占比减小,由28.6%分别降低到25.7%(低剂量抗生素)、14.3%(中剂量抗生素)和8.6%(高剂量抗生素),降低的程度与抗生素的剂量呈正相关。
2.4 肠道菌群物种相对丰度的改变
如图4A聚类热图显示,抗生素能够显著降低小鼠肠道菌群中的红细菌纲(Rubrobacteria)、柔膜菌纲(Mollicutes)、酸微菌纲(Acidimicrobiia)、放线菌纲(Unidentified-Actinobacteria)、Δ-变形菌纲(Deltaproteobacteria)、噬纤维菌纲(Cytophagia)、鞘脂杆菌纲(Sphingobacteriia)、β-变形菌纲(beta Proteobacteria)、红蝽菌纲(Coriobacteriia)、全噬菌纲(Holophagae)、念珠菌纲(Candidatus-Azambacteria)、芽单胞菌纲(Unidentified-Gemmatimonadetes)、疣微菌纲(Verrucomicrobiae)、浮霉菌纲(Planctomycetacia)、α-变形菌纲(Alphaproteobacteria)、梭杆菌纲(Fusobacteriia)、厌氧绳菌纲(Anaerolineae)、黄杆菌纲(Flavobacteriia)、杆菌纲(Bacilli)、绿菌纲(Chloroplast)、拟杆菌纲(Bacteroidia)、螺旋体菌纲(Unidentified-Saccharibacteria)和丹毒丝菌纲(Erysipelotrichia)。抗生素浓度越大,对肠道菌群相对丰度的影响就越大。如图4B柱状图所示,饮水摄入抗生素能增加肠道菌群里面的γ-变形菌纲(gamma Proteobacteria)和梭菌纲(Clostridia);同时抗生素可降低肠道菌群的物种丰富度,减少杆菌纲(Bacilli)、柔膜菌纲(Mollicutes)、丹毒丝菌纲(Erysipelotrichia)、红蝽菌纲(Coriobacteriia)、α-变形菌纲(alpha Proteobacteria)、β-变形菌纲(beta Proteobacteria)和ε-变形菌纲(epsilon Proteobacteria),柱状图的结果和聚类热图的结果基本一致。抗生素浓度越大,杆菌纲(Bacilli)减少得越多,而Γ-变形菌纲(Gammaproteobacteria)增加得越少。
2.5 小鼠肠道菌群结构改变的功能预测
如图5功能聚类热图所示,与纯净水对照组相比,抗生素能够增加动物寄生虫或共生体疾病(animal parasites or symbionts)、人体肠道疾病(human gut)、哺乳动物肠道疾病(mamal gut)、人类病原体疾病(human pathogens)、人源性胃肠炎(human pathogens gastroenteritis)、人源性腹泻(human pathogens diarrhea)、硝酸还原(nitrate reduction)、有氧化学异养(aerobic chemoheterothophy)、延胡索酸呼吸(fumarate respiration)、氮呼吸(nitrogen respiration)、硝酸铵化(nitrite ammonification)、硝酸盐呼吸(nitrate respiration)、亚硝酸盐呼吸(nitrite respiration)。抗生素能够降低人源性肺炎(human pathogens pneumonia)、塑料降解(plastic gegradation)、芳香族化合物降解(aromatic compound degradation)、化能异养(chemoheterothophy)、发酵(fermentation)、尿素分解(ureolysis)、硫化物呼吸(respiration of sulfur compounds)、硫酸呼吸(sulfate respiration)、反硝化(denitrification)、硝酸盐反硝化(nitrate denitrification)、亞硝酸盐反硝化(nitrite denitrification)、氧化亚氮脱氮(nitrous oxide denitrification)。低、中、高剂量抗生素(0.5、1和
2 mg/L)均能够改变肠道功能,但不具备量效关系。
3 讨论
肠道是食物消化吸收的主要场所,是一个巨大的细菌库,肠道菌群的紊乱会引起肠道疾病甚至系统性疾病[21-22]。肠道菌群在某些因素作用下,可以变成易感细菌,通过基因突变或水平转移获得耐药基因而成为耐药菌。然而,环境因素复杂,如饮水饮食、抗生素[23]、耐药菌[24]、纳米材料[25-26]等都可能影响耐药菌的形成和传播。抗生素作为食品特别是饮水的新型污染物,一旦摄入动物体内,一方面会引起耐药基因的产生和传播,另一方面必然会改变肠道菌群的结构,进而可能造成菌群失调、疾病发生。抗生素在水体中浓度可达0.917 μg/L~0.664 mg/L[27],本研究使用的是自由饮水,而不是抗生素灌胃,故抗生素浓度稍高,选为0.5、1和2mg/L。Amp为β-内酰胺抗生素,是人类最早和最常用抗生素;Tet类抗生素为畜禽养殖最常用的抗生素;Km为氨基糖苷类抗生素,也是人类使用较多的抗生素。这3种抗生素在环境中普遍存在,水体中基本都能检测到这3种所代表的3类抗生素的残留[27]。选择该3种抗生素联合用药,考察其对肠道菌群的影响,具有多抗生素联合影响的代表性。
前期的研究主要集中在单抗生素或双抗生素对肠道菌群的影响,本研究主要关注多抗生素联合作用对肠道菌群的影响。结果表明,饮水摄入多种抗生素能够显著降低小鼠肠道菌群的OTUs分布,即降低肠道菌群的物种丰富度。Shannon、Simpson和Chao1多样性指数说明样品中正常小鼠肠道菌群的多样性较高,饮水摄入抗生素能够降低菌群的多样性。稀释曲线、等级聚类曲线和物种指数组间差异箱型图均说明样品均匀度较好,复杂度较高,饮水摄入抗生素能够降低肠道菌群样品的复杂度。多样本比较分析中,组内样品距离较近,菌群结构较一致;组间样品距离较远,菌群结构差异较大,饮水摄入抗生素能够明显改变样品的肠道菌群组成。在门水平上,饮水摄入抗生素能够显著降低肠道菌群的丰富度和非优势菌群的占比,使其在肠道菌群中所占比例不足1%;饮水摄入抗生素能够升高优势菌群的总体占比,使其占比大于99%。对于优势菌群,抗生素都能够降低厚壁菌门的占比,增大变形菌门的占比,推测变形菌门的肠道菌群抵抗抗生素的能力更强,这与前期的研究成果变形菌门更易获得耐药基因一致[16,28],但其机制还有待于深入研究。根据表1中的多样性指数,在纲水平上抗生素能够极显著降低肠道菌群的丰富度,且抗生素在1 mg/L浓度以内具有量效关系,高剂量1~2 mg/L范围内不具备量效关系。细菌对抗生素的抵抗有两种方式,一种是耐药基因的获得,一种是细菌表型结构的抵抗,推测在不同抗生素浓度下,细菌耐药的方式不同,故在一定药物浓度范围内不具备量效关系。单一抗生素对肠道菌群的影响可能结果更明确,但自然环境中往往是多抗生素共存,故研究多抗生素联合对肠道菌群的影响更具有现实意义。从菌群结构上前人研究发现,在门水平级别上单一β-内酰胺类的抗生素均以抗生素作用下Firmicutes增加、Bacteroidetes与Proteobacteria减少为特征[15]。而本文研究结果表明多种抗生素联合作用下,Firmicutes、Bacteroidetes与Proteobacteria均占比增加,推测这与多抗生素联合作用下,Bacteroidetes与Proteobacteria更易获得耐药基因产生抗性有关[25-26,28]。头孢噻肟钠、头孢曲松钠、盐酸左氧氟沙星、万古霉素、美罗培南、阿奇霉素、硫酸庆大霉素和本研究使用的氨苄青霉素、卡那霉素、四环素对肠道菌群在纲水平上的影响相似,在种属水平上的影响差异还有待深入研究[15-16]。
正常微生物菌群彼此之間保持着一种动态平衡,菌群的结构失衡与动物机体的疾病发生密切相关,例如它们在腹泻、肿瘤、免疫、营养、消化吸收等方面发挥重要作用[29-30]。本研究表明:多抗生素联合作用可能引起动物寄生虫或共生体疾病、哺乳动物及人肠道疾病、人类病原体疾病、人源性腹泻、人源性胃肠炎、能量代谢疾病、消化吸收疾病,其与单抗生素或双抗生素作用相似,以上结果是基于数据库的疾病预测,还有待于确切的动物模型和临床实验验证。抗生素与肠道菌群关系的深入研究,将为食品特别是饮用水抗生素污染防控提供一定的理论基础。
参 考 文 献
Hou J, Wan W, Mao D, et al. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China[J]. Environ Sci Pollut R, 2015, 22(6): 4545-4554.
He D, Sun Y, Xin L, et al. Aqueous tetracycline degradation by non-thermal plasma combined with nano-TiO2[J]. Chem Eng J, 2014, 258: 18-25.
编辑部. 全球面临抗生素耐药性挑战[J]. 中国食品学报, 2013, 13(7): 58.
陈明, 陈美琴, 耿志明, 等. 鸡蛋中聚醚类抗生素残留检验方法研究[J]. 中国食品学报, 2006, 6(5): 124-128.
编辑部. 科学家发现对抗耐药细菌的抗生素[J]. 中国食品学报, 2017, 17(6): 19.
Li B, Yang Y, Ma L, et al. Metagenomic and network analysis reveal wide distribution and co-occurrence of environmental antibiotic resistance genes[J]. Isme J, 2015, 9(11): 2490-2502.
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. P Natl Acad of Sci USA, 2013, 110(9): 3435-3440.
Mu Q, Li J, Sun Y, et al. Occurrence of sulfonamide-, tetracycline-, plasmid-mediated quinolone- and macrolide-resistance genes in livestock feedlots in Northern China[J]. Environ Sci Pollut R, 2015, 22(9): 6932-6940.
Wang H, Wang N, Wang B, et al. Antibiotics in drinking water in Shanghai and their contribution to antibiotic exposure of school children[J]. Environ Sci Technol, 2016, 50(5): 2692-2699.
Chee-Sanford J C, Hee-Sanford J C, Mackie R I, et al. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste[J]. J Environ Qual, 2009, 38(3): 1086-1108.
馬沁沁, 付雨, 孙群. 食源性乳杆菌中耐药基因的转移研究[J]. 食品科学, 2015, 36(23): 167-171.
罗义, 周启星. 抗生素抗性基因(ARGs)——一种新型环境污染物[J]. 环境科学学报, 2008, 28(8): 1499-1505.
何雪梅, 郭莉娟, 吴国艳, 等. 猪肉源大肠杆菌对抗生素及消毒剂耐药性研究[J]. 食品科学, 2014, 35(7): 132-137.
Cindy M L, Marc S, Maliha A, et al. Escherichia coli ST131-H22 as a foodborne uropathogen[J]. mBio, 2018, 9(4): e00470-18.
彭欣. 基于BIPES分析抗生素短期作用对小鼠肠道菌群的影响[D]. 广州: 南方医科大学, 2014.
李岷, 吴信华, 曹园. 采用高通量测序技术研究抗生素对小鼠肠道菌群的影响[J]. 中国微生态学杂志, 2019, 31(9): 993-1004.
王雪, 赵龙玉, 赵凤春, 等. 应用Illumina高通量测序技术探究长根菇多糖对小鼠肠道菌群的影响[J]. 食品科学, 2015, 36(19): 222-226.
臧凯丽, 贾彦, 崔文静, 等. 瑞士乳杆菌调控小鼠肠道菌群变化规律的研究[J]. 食品科学, 2018, 39(1): 156-164.
Anderson M J. A new method for non-parametric multivariate analysis of variance[J]. Austral Ecol, 2001, 26(1): 32-46.
Ekaterina A, Frisli T, Rudi K. De novo semi-alignment of 16S rRNA gene sequences for deep phylogenetic characterization of next generation sequencing data[J]. Microbes Environ, 2013, 28(2): 211-216.
杨华, 叶发银, 赵国华, 等. 膳食多酚与肠道微生物相互作用研究进展[J]. 食品科学, 2015, 36(3): 223-227.
刘开朗, 王加启, 卜登攀, 等. 人体肠道微生物多样性和功能研究进展[J]. 生态学报, 2009, 29(5): 2589-2594.
李姝, 邵毅, 周昌艳, 等. 市售鸡肉及内脏中磺胺耐药菌污染特征[J]. 食品科学, 2017, 38(21): 170-174.
侯雪娇, 吴科敏, 莫国东, 等. 食源性沙门氏菌耐药表型与耐药基因的研究[J]. 食品科学, 2016, 37(19): 166-170.
Ding C S, Pan J, Jin M, et al. Enhanced Uptake of Antibiotic Resistance Genes in the Presence of Nanoalumina[J]. Nanotoxicology, 2016, 10(8): 1051-1060.
Qiu Z G, Yu Y M, Chen Z L, et al. Nanoalumina promotes the horizontal transfer of multiresistance genes mediated by plasmids across genera[J]. Proc Natl Acad Sci, 2012, 109(13): 4944-4949.
魏晓东. 广州典型排放源废水和河流水体中抗生素的污染特征研究[D]. 中国科学院大学, 2018.
Ding C S, Yang D, Jin M, et al. Effects of free antibiotic resistance genes in the environment on intestinal microecology of mice[J]. Ecotox environ safe, 2020, 204(19): 111119.
张烽, 张晨虹. 膳食营养与肠道微生物组[J]. 生命科学, 2017, (7): 695-706.
臧凯丽, 江岩, 孙勇, 等. 益生菌剂调整肠道疾病人群菌群结构丰度水平的研究[J]. 食品科学, 2018, 39(13): 133-143.
