雷氏普罗威登斯菌对碳青霉烯类耐药与氨基糖苷类异质性耐药研究
2024-01-01柳朔怡顾全李会平戚桂杰鲁程绯
柳朔怡 顾全 李会平 戚桂杰 鲁程绯


摘要:目的 分析雷氏普罗威登斯菌对碳青霉烯类药物耐药机制与氨基糖苷类药物异质性耐药现象的探索。 方法 对2016—2021年收集的4株多重耐药的雷氏普罗威登斯菌(multidrug resistant Providencia Rettgeri, MRPRE)临床分离株的耐药性和携带的耐药基因进行分析。采用异质性耐药菌谱分析与亚抑菌浓度抗生素诱导实验探索庆大霉素异质性耐药菌株对氨基糖苷类和碳青霉烯类抗生素的适应性耐药。结果 本研究共收集4株MRPRE,其中3株检出blaNDM-1基因,对碳青霉烯类高度耐药,同时对第一、二、三代头孢菌素、氨曲南、复方磺胺甲恶唑、喹诺酮类药物耐药。1株未检出碳青霉烯酶基因,但对氨基糖苷类抗生素异质性耐药,在亚抑菌浓度庆大霉素诱导下,庆大霉素MIC值由8 ?g/mL上升至64 ?g/mL,亚胺培南MIC值由2 ?g/mL上升至8 ?g/mL,出现适应性耐药。结论 雷氏普罗威登斯菌可携带blaNDM-1对碳青霉烯类抗生素高度耐药,同时表现对多种抗生素的多重耐药。异质性耐药菌株在亚抑菌浓度庆大霉素诱导下可出现庆大霉素与亚胺培南的适应性耐药。
关键词:雷氏普罗威登斯菌;碳青霉烯酶;新德里金属酶;异质性耐药
中图分类号:R372 文献标志码:A
Analysis of carbapenem resistance and aminoglycoside heteroresistance mechanisms of Providencia rettgeri
Liu Shuoyi1, Gu Quan2, Li Huiping2, Qi Guijie1, and Lu Chengfei1
(1. Prenatal Diagnosis and Genetic Disease Diagnosis Center, Tangshan Maternal and Child Health Hospital, Tangshan 063000;
2. Tangshan Peoples Hospital, Tangshan 063000)
Abstract Objective To analyze the mechanism of carbapenem resistance and aminoglycoside heteroresistance of Providencia Rettgeri. Methods Four clinical isolates of multidrug resistant Providencia rettgeri(MRPRE) were collected from 2016 to 2021. Carbapenemase genes were determined by PCR and sequence analysis. Aminoglycoside heteroresistance was confirmed with population analysis profile. After pretreatment with sub-inhibitory concentration of gentamicin, the adaptive resistance of Providencia Rettgeri against aminoglycosides and carbapenems was observed. Results A total of four MRPRE strains were collected in this study. Three strains were highly resistant to carbapenems with blaNDM-1 gene. Meanwhile, they were resistant to cephalosporins, aztreonam, cotrimoxazole, and quinolones. One strain was negative for carbapenemase genes, but presented as aminoglycoside heteroresistance. After pretreatment with sub-inhibitory concentration of gentamicin, strains demonstrated adaptive resistance to gentamicin and imipenem. The MIC value of gentamicin increased from 8 to 64 ?g/mL, and that of imipenem increased from 2 to 8 ?g/mL. Conclusion We report three clinical strains of multidrug-resistant Providencia Rettgeri with blaNDM-1 gene. The adaptive resistance of Providencia Rettgeri against gentamicin and imipenem could be induced by the sub-inhibitory concentration of gentamicin in vivo.
Key words Providencia Rettgeri; Carbapenemase; New Delhi metallo-β-lactamase 1; Heteroresistance
普羅威登斯菌属隶属于变形菌门,γ-变形菌纲,肠杆菌目,目前已有10个分类种,分别为产碱普罗威登斯菌(Providencia alcalifaciens),大红谷仓普罗威登斯菌(P. burhodogranariea),海恩巴赫普罗威登斯菌(P. heimbachae),雷极普罗威登斯菌(P. rettgeri),拉氏普罗威登斯菌(P. rustigianii),斯尼普罗威登斯菌(P. sneebia),斯氏普罗威登斯菌(P. stuartii),居线虫普罗威登斯菌(P. vermicola),华西普罗威登斯菌(P. huaxiensis)和泰国普罗威登斯菌(P. thailandensis)。相较于肠杆菌科的其他属,普罗威登斯菌较少引起院内感染[1],其中斯氏普罗威登斯菌和雷氏普罗威登斯菌在临床较为普遍,其主要引起尿路感染与腹泻,此外也有肺炎、脑膜炎、心内膜炎、伤口和血流感染相关报道[2]。近年来,国内外屡有报道发现多重耐药的普罗威登斯菌[3]。特别是携带blaNDM-1的普罗威登斯菌[4],
其表现为对临床首选抗感染药物的泛耐药性,包括对β-内酰胺类、氟喹诺酮类、四环素类和碳青霉烯类均表现高耐药性。此外由于抗感染治疗的失败,亚抑菌浓度抗生素的诱导,普罗威登斯菌可对氨基糖苷类和喹诺酮类药物出现异质性耐药。给临床治疗与院感控制带来巨大挑战。
本文在2016—2021年收集了4株多重耐药的雷氏普罗威登斯菌(multidrug resistant Providencia Rettgeri, MRPRE)临床分离株,对其耐药性与耐药基因进行分型,结合临床感染资为临床合理用药与院感防控提供依据。
1 材料与方法
1.1 菌株来源
实验菌株分离自2016—2021年唐山市人民医院临床微生物检验标本,采用VITEK 2 Compact鉴定并于-80 ℃甘油保存。质控菌株霍氏肠杆菌(ATCC700323)与改良碳青霉烯灭活试验辅助菌株(ATCC25922)购自中国医学细菌保藏管理中心(national center for nedical culture collections, CMCC)。
1.2 实验仪器
血平板、MH平板购自郑州安图生物公司,K-B药敏纸片与营养肉汤购自温州康泰生物公司,抗生素粉末购自Oxoid公司。VITEK 2 Compact以及配套生化鉴定卡(GN)和体外药敏卡(GN09)购自生物梅里埃公司。西门子MicroScan WalkAway 96革兰阴性菌药敏板(Neg MIC 38)购自贝克曼公司。PCR实验材料(Taq PCR Mix 预混体系)与引物合成购自生工生物工程(上海)股份有限公司。
1.3 菌株鉴定与耐药表型
菌株生化鉴定按VITEK 2.0 Compact全自动细菌鉴定及药敏分析系统说明操作。扩增16S rRNA基因并测序进行基因鉴定,测序结果以Blast比对搜索Genbank数据库。扩增引物为原核生物通用引物8F、1492R,65 ℃退火温度,扩增程序参照文献[5]。扩增产物Sanger测序交由生工生物工程(上海)股份有限公司完成。
菌株体外药敏试验按VITEK 2 Compact革兰阴性菌体外药敏卡(GN09)和西门子MicroScan WalkAway 96革兰阴性菌药敏板(Neg MIC 38)标准进行操作。异质性耐药表型采用K-B法测量,异质性耐药(heteroresistance, HR)表现为抑菌圈内有菌落生长,非异质性耐药在抑菌圈内无菌落生长,测量抑菌圈直径后按照CLSI M100-S30判断敏感性。
采用改良碳青霉烯灭活试验(modified carbapenem inactivation method, mCIM)联合EDTA改良碳青霉烯灭活试验(EDTA-carbapenem inactivation method, eCIM)对菌株产碳青霉烯酶类型进行补充试验,操作与结果判读依据为CLSI M100-S30。mCIM阳性、eCIM阴性提示试验菌株携带丝氨酸型碳青霉烯酶;mCIM阳性、eCIM陽性提示试验菌株携带金属β-内酰胺酶。
1.4 耐药基因检测
根据既有报道,对常见的丝氨酸碳青霉烯酶和金属碳青霉烯酶进行扩增检测[6]。具体基因名称与引物信息见表1。blaKPC、blaVIM和blaIMP基因的扩增条件:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃延伸5 min。blaNDM和blaOXA-48基因的扩增条件:94 ℃预变性3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃延伸5 min。产物经1.5%琼脂糖凝胶电泳,出现目的片段大小的电泳条带为阳性。阳性PCR产物送生工生物工程(上海)股份有限公司进行测序。序列经NCBI数据库比对确定基因分型。
1.5 异质性耐药菌谱分析(population analysis profile, PAP)
对庆大霉素出现异质性耐药的菌株进行异质性耐药菌谱分析,具体操作参考文献[7]进行,具体参数按操作的微生物与药物略有改动。配置0.5、1、2、4、8、16、32、64、128和256 ?g/mL庆大霉素抗性MH平板。配置菌液浓度至0.5×108 CFU/mL,并依次稀释10~105倍,取100 ?L菌株涂布抗性MH平板置于35 ℃温箱培养48 h,取菌落数在30~300 CFU平板进行计数并乘以菌液稀释倍数计算实际菌落形成单位。以抗生素浓度做横坐标,实际菌落形成单位对数为纵坐标绘制PAP曲线。
1.6 庆大霉素和亚胺培南适应性耐药
对庆大霉素出现异质性耐药的菌株进行亚抑菌浓度庆大霉素诱导实验。将临床分离的初代细菌取单个菌落置于含有1 ?g/mL庆大霉素营养肉汤培养基中进行诱导,35 ℃温箱大气环境培养24 h后,离心弃上清,用0.45%生理盐水重新悬浊配置0.75×
108 CFU/mL菌液,取1 ?L菌液再置于1 mL含有1 ?g/mL庆大霉素营养肉汤中进行诱导,其他菌液分别采用K-B法和微凉肉汤稀释法(MIC)检测庆大霉素与亚胺培南耐药性。按上述方法循环诱导直至庆大霉素由异质性耐药转变为完全耐药。
2 结果
2.1 菌株资料与鉴定结果
2016—2021年,一共收集到4株碳青霉烯类异质性耐药普罗威登斯菌,编号分别为TS2016023,TS2018019,TS2018121,TS2021057,菌株分离于临床微生物检验标本,经VITEK 2 Compact鉴定为雷氏普罗威登斯菌,16S rRNA基因测序结果显示与雷氏普罗威登斯菌模式菌株参考序列(DQ885263)相似度分别为99.6%,99.9%,99.9%和100%。菌株均来源于呼吸道标本,其中1株(ST2021057)分离自神经外科住院患者,其他3株分离自ICU住院患者。
2.2 菌株体外药物敏感性实验结果
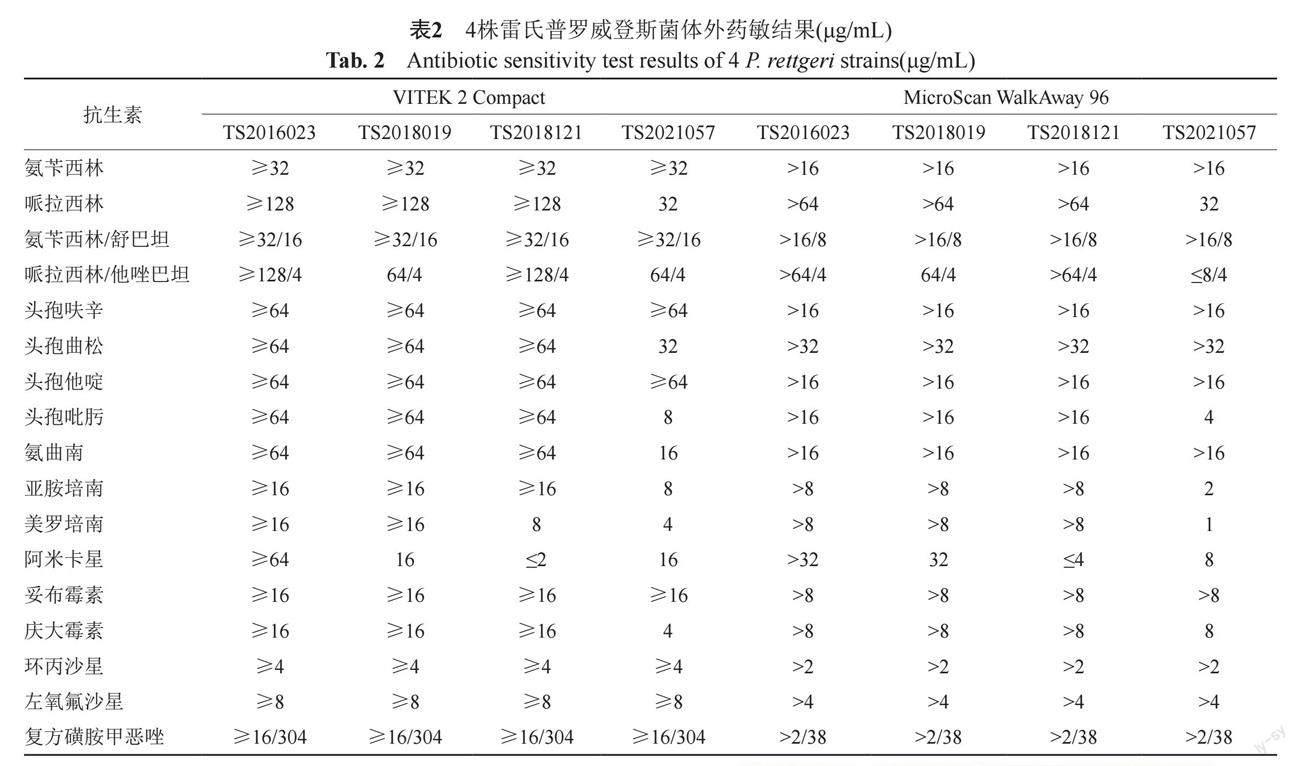
VITEK 2 Compact体外药敏试验结果显示所有菌株均表现对第一、二、三代头孢菌素、氨曲南、复方磺胺甲恶唑和喹诺酮类药物耐药。TS2016023,TS2018019和TS2018121对亚胺培南、美罗培南耐药。ST2021057对第四代头孢(头孢吡肟)表现为剂量依赖性敏感(susceptible-dose dependent, SDD),对氨基糖苷类药物敏感性不定,其中庆大霉素为中介,妥布霉素耐药,阿米卡星敏感。亚胺培南与美罗培南均为耐药。MicroScan WalkAway 96体外药敏试验结果显示亚胺培南中介,美罗培南为敏感。体外药敏结果与具体MIC值见表2。K-B法体外药敏结果显示,ST2021057对庆大霉素、妥布霉素和阿米卡星均表现为异质性耐药,其在抑菌圈内出现针尖样菌落,见图1。
2.3 碳青霉烯類耐药表型与耐药基因检测
3株碳青霉烯类异质性耐药普罗威登斯菌mCIM试验与eCIM试验同为阳性,提示其携带金属碳青霉烯酶,ST2021057菌株mCIM试验与eCIM试验结果无法判定,见图2。耐药基因检测结果显示,3株雷氏普罗威登斯菌只检出blaNDM-1基因,未发现其他碳青霉烯酶基因。测序结果经BLAST比对,blaNDM基因同属NDM-1型。ST2021057菌株未检出任何碳青霉烯酶。
2.4 异质性耐药菌谱分析结果
ST2021057雷氏普罗威登斯菌庆大霉素PAP曲线如图3所示,敏感对照菌大肠埃希菌(ATCC9922)在低抑菌浓度范围内被迅速杀灭,完全耐药菌TS2016023可在较高浓度下保持稳定生长。ST2021057曲线在敏感对照株和耐药株之间,且曲线折点倍数大于8倍,可判断为异质性耐药菌株。
2.5 庆大霉素和碳青霉烯类药物适应性耐药结果
对ST2021057雷氏普罗威登斯菌经过8轮亚抑菌浓度庆大霉素诱导实验,该菌庆大霉素抑菌圈外环由
18 mm缩小至10 mm,亚胺培南抑菌圈由22 mm缩小至20 mm,并在抑菌圈内出现针尖样异质性耐药菌落,见图4。微量肉汤稀释法结果显示,ST2021057初代菌株庆大霉素MIC值为8 ?g/mL,亚胺培南MIC值为
2 ?g/mL,经过8轮亚抑菌浓度庆大霉素诱导后,庆大霉素和亚胺培南MIC值分别为64 ?g/mL和8 ?g/mL,见图5。
3 讨论
耐碳青霉烯类肠杆菌科细菌(CRE),因其传播速度快,感染治疗周期长,抗菌药物选择有限,已经成为临床抗感染治疗和院感防控的重大挑战[8]。CRE主要以携带碳青霉烯酶基因水解碳青霉烯类抗生素产生耐药性[9],该基因通常位于可结合质粒上并与氨基糖苷类、大环内酯类和喹诺酮类等其他抗生素耐药基因一同组成基因盒,从而形成快速水平传播的能力[10]。携带blaNDM-1的大肠埃希菌最早在2008年发现于1名来自印度的瑞典患者,时至今日已在全球范围内形成大范围流行,并迅速扩散至临床常见感染菌株,如肺炎克雷伯、阴沟肠杆菌和铜绿假单胞菌等[11]。普罗威登斯菌是临床常见院内感染细菌,根据ABX指南,该菌在院内获得和长时间住院的感染比社区感染更为常见。特别是雷极普罗威登斯菌和斯氏普罗威登斯菌常引起严重的尿路感染与菌血症[12]。携带blaNDM-1的雷极普罗威登斯菌国内鲜有报道[13]。本文检出3株携带blaNDM-1的雷极普罗威登斯菌,对β-内酰胺类、喹诺酮类、氨基糖苷类和磺胺类抗生素菌表现为耐药,此外,普罗威登斯菌还对四环素、呋喃妥因、替加环素、多黏菌素呈天然耐药,该类型普罗威登斯菌的出现将对临床抗感染治疗带来巨大挑战。
细菌的异质性耐药(heteroresistance)通常是指某个单一分离菌株,在其培养的群体中存在着对某种药物敏感性不同的亚群[14]。本研究检出1株雷极普罗威登斯菌(TS2021057)对氨基糖苷类药物存在异质性耐药,具体表现为其在氨基糖苷类药物K-B法抑菌圈内出现针尖样菌落,并且MicroScan WalkAway 96体外药敏结果(微量肉汤稀释法)和VITEK 2 Compact体外药敏结果不一致。由于VITEK 2 Compact系统采用的是动态监测读数,将每15 min菌株在抗生素孔中的生长率比对数据库,通过计算转化生成对应MIC值,该方法可能漏检异质性耐药亚群导致仪器结果与K-B法和微量肉汤稀释法不符[15]。异质性耐药是微生物在亚抑菌浓度抗生素选择压力下的一种适应性策略。本研究观察到1株雷极普罗威登斯菌(TS2021057)在亚抑菌浓度庆大霉素诱导下同时出现庆大霉素与亚胺培南体外敏感性下降。由于收集的菌株数量仅有1株,不能推断该现象是否在普罗威登斯菌中普遍存在,其具体机制也尚不清楚。根据Dupont等[16]的研究报道,肠杆菌科细菌在接触β-内酰胺类和喹诺酮类等抗生素后出现一种应激反应,表现为膜孔蛋白OmpF的低表达和OmpX的高表达,使细胞膜通透性改变。通过膜孔蛋白扩散的药物主要有β-内酰胺类、喹诺酮类、四环素、氯霉素和氨基糖苷类等。在肠杆菌科细菌中OmpF的表达下调或缺失会影响细菌对氨基糖苷类抗生素的摄取,并可导致细菌对β-内酰胺类抗生素发生不同程度的耐药[17]。根据Mariam等[18]的报道,普罗威登斯菌中也存在相似功能的孔膜蛋白Omp-Pst1和Omp-Pst2,其中Omp-Pst1被证实与β-内酰胺类和喹诺酮类药物的主动运输有关[19]。细菌的异质性耐药为药物对致病细菌的治疗效果的评估带来了很大困难,使自动化体外药敏仪器数据的可靠性降低,不能为临床提供准确的用药指导。不规范的临床治疗又导致异质性耐药菌株在亚抑菌抗生素浓度下筛选进化出适应性耐药菌株。因此,针对普罗威登斯菌的感染,除面对多重耐药菌株带来的挑战,及早发现、正确处理异质性耐药也尤为重要。
普罗威登斯菌对黏菌素和替加环素具有天然耐药性。携带blaNDM-1的普罗威登斯菌可对所有头孢菌素类和碳青霉烯类抗生素均表现耐药。此外异质性耐药可使氨基糖苷类抗生素敏感性迅速下降。这使得临床治疗与根除多重耐药的普罗威登斯菌感染十分困难。微生物检验部门需有效监测碳青霉烯酶基因,及早发现异质性耐药菌株,临床科室合理使用抗生素,做好院感防控措施,多部门联合协作对预防和控制多重耐药的普罗威登斯菌至关重要。
参 考 文 献
Abdallah M, Balshi A. First literature review of carbapenem-resistant Providencia[J]. New Microbes New Infect. 2018, 25: 16-23.
O'Hara C M, Brenner F W, Miller J M. Classification, identification, and clinical significance of Proteus, Providencia, and Morganella[J]. Clin Microbiol Rev, 2000, 13(4): 534-546.
宋嘉言, 張孟孝, 范宁. 多重耐药雷氏普罗威登斯菌医院感染一例[J]. 中华临床感染病杂志, 2018, 11(5):391-393.
Zhou M, Wang D, Kudinha T, et al. Comparative evaluation of four phenotypic methods for detection of class A and B carbapenemase-producing Enterobacteriaceae in China[J]. J Clin Microbiol, 2018, 56(8): e00395-18.
陈茶, 屈平华, 顾全, 等. 基于细菌16S rRNA基因的PCR扩增与测序分析在临床不常见菌鉴定中的应用[J]. 中华检验医学杂志, 2012, 35(7): 612-619.
刘婧娴, 俞静, 李媛睿, 等. 肺炎克雷伯菌对碳青霉烯类抗生素的耐药机制研究[J]. 上海交通大学学报: 医学版, 2016, 36(1): 93-99.
El-Halfawy O M, Valvano M A. Antimicrobial heteroresistance: An emerging field in need of clarity[J]. Clin Microbiol Rev, 2015, 28(1): 191-207.
Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria[J]. Lancet Infect Dis, 2009, 9(4): 228-236.
Queenan A M, Bush K. Carbapenemases: The versatile beta-lactamases[J]. Clin Microbiol Rev. 2007, 20(3): 440-458.
顾全, 柳朔怡, 韩素桂, 等. 耐碳青霉烯类肺炎克雷伯菌耐药基因与可移动遗传元件的分析[J]. 微生物学免疫学进展, 2021, 49(6): 45-51.
Marquez-Ortiz R A, Haggerty L, Sim E M, et al. First complete Providencia rettgeri genome sequence, the NDM-1-producing clinical strain RB151[J]. Genome Announc. 2017, 5(3): e01472-16.
陈东科, 孙长贵. 实用临床微生物学检验与图谱[M]. 北京: 人民卫生出版社, 2011: 348-350.
李巍, 艾芙琪, 马逸珉, 等. 携带blaNDM-1碳青霉烯类耐药雷极普罗威登斯菌耐药机制研究[J]. 检验医学, 2019, 34(1): 67-70.
刘宇阳, 陈茶, 黄彬. 铜绿假单胞菌对碳青霉烯类抗生素异质性耐药的研究进展[J]. 中国感染控制杂志, 2021, 20(8): 763-768.
李喜红, 刘盼盼, 王莲慧, 等. 评估纸片扩散法与Vitek2-compact GN13测定的肺炎克雷伯菌体外亚胺培南药敏及AES系统修正可靠性的研究[J]. 中华微生物学和免疫学杂志, 2016, 36(8): 615.
Dupont M, James C E, Chevalier J, et al. An early response to environmental stress involves regulation of OmpX and OmpF, two Enterobacterial outer membrane pore-forming proteins[J]. Antimicrob Agents Chemother, 2007, 51(9): 3190-3198.
庄逸菁, 姚芬, 黄源春, 等. 亚抑制浓度庆大霉素诱导大肠埃希菌发生适应性耐药的研究[J]. 中国抗生素杂志, 2016, 41(3): 232-236.
Tran Q T, Mahendran K R, Hajjar E, et al. Implication of porins in beta-lactam resistance of Providencia stuartii[J]. J Biol Chem. 2010, 285(42): 32273-32281.
Bajaj H, Tran Q T, Mahendran K R, et al. Antibiotic uptake through membrane channels: Role of Providencia stuartii OmpPst1 porin in carbapenem resistance[J]. Biochemistry. 2012, 51(51): 10244-10249.
