P356-1Y2L表位刺激BALB/c小鼠的特异性抗肿瘤免疫
2020-11-02贺晓静李白煜贺洁开封大学河南开封475000河南大学
贺晓静 李白煜 贺洁 (开封大学,河南 开封 475000;河南大学)
每年新发肝癌诊出约854万例,成为全球第六大常见癌症〔1〕。根据美国癌症协会的数据,美国肝癌的发病率在所有癌症中增长最快,可能是由于肥胖/糖尿病的增多导致的〔2〕。由于缺乏有效的治疗,肝癌是导致成年男性癌症死亡的第二大原因。激活宿主免疫系统能产生显著抗肿瘤效果〔3〕。虽然这是很有前景的治疗方法,但程序性死亡受体(PD)-1阻断的抗肿瘤效果取决于肿瘤特异性浸润性T细胞的存在。除此之外,通过免疫检查点释放非特异性免疫可能导致自身免疫破坏。但靶向肿瘤特异性或肿瘤相关抗原的免疫疗法很少引起自身免疫疾病〔4〕。研究已经鉴定过肝癌高表达抗原黑色素瘤相关抗原(MAGE)C2有效的人类白细胞抗原(HLA)-A2限制性CD8+细胞素性T细胞(CTL)表位〔5〕,然而,尚不清楚MAGEC2衍生的表位是否能够引发体内抗肿瘤免疫应答。在荷瘤小鼠模型中用表位肽P356-1Y2L能引起强烈的抗肿瘤反应,可能有助于MAGEC2衍生的表位在抗肿瘤免疫疗法中的应用〔6〕。本文拟检测MAGEC2衍生的免疫原性肽在小鼠体内抗肿瘤免疫效果。
1 材料和方法
1.1材料 T2A2细胞、HepG2细胞(MAGEC2+、HLA-A2+)、H22细胞由开封大学医学部实验室常规保存,采用37℃、体积分数5% CO2饱和湿度培养条件下常规培养。6~8周龄Balb/c和昆明小鼠由河南省实验动物中心提供。表位肽P248-1Y、P356-1Y2L由上海科肽生物科技有限公司合成。青霉素和链霉素均购自美国Gibco,Anti-CD8 抗体和Anti-干扰素(IFN)-γ抗体均购自美国的eBioscience品牌。鼠IFN-γ酶联免疫斑点(ELISPOT)检测试剂盒购自北京达科为生物技术有限公司,乳酸脱氢酶(LDH)检测试剂盒购自上海碧云天生物技术公司。
1.2抗肿瘤保护模型 选取6~8周龄Balb/c小鼠,每组5只,每间隔10 d(即第0、10和20天)腹腔注射免疫小鼠,每只小鼠由100 μg/ml的肽和不完全弗氏佐剂(IFA)(Sigma-Aldrich,USA)按1∶1乳化。对照组用磷酸盐缓冲液(PBS)和同体积IFA进行乳化。为了分析诱导特异性CTL,在最后1次免疫后10 d(即第30天),处死小鼠并将脾细胞在RPMI1640培养基中培养,实验组加入10 μg的肽。2 d后做为效应细胞铺于96孔板中,以效靶比50.0∶1,25.0∶1和12.5∶1的比例加入靶细胞(HepG2细胞),LDH实验检测细胞毒活性实验。在37°C孵育4 h,孵育结束前45 min,将10 μl裂解物加入靶细胞最大释放组。离心4 min后,将50 μl上清液转移到另一个96孔板中,每个孔中加入50 μl底物混合物,黑暗中室温孵育30 min;每孔分别加入50 μl终止液。用酶标仪测量波长490 nm处的OD值。计算公式:杀伤率=(实验孔值-效应细胞自发释放值-CTL自发释放值)/(靶细胞值-效应细胞自发释放值)×100%〔7〕。
1.3胞内因子染色 收获上述效应细胞,加入终浓度为10 μg/ml的布雷菲德菌素(BFA),并在37℃,体积分数5%CO2中孵育6 h。培养完成后,用4%多聚甲醛在4℃下固定20 min,在室温下用0.1%皂苷处理10 min,并用PBS洗涤。加入异硫氰酸荧光素(FITC)标记的小鼠CD8抗体(1∶200稀释),PE标记的抗小鼠IFN-γ流动单克隆抗体,在4℃下黑暗中孵育30 min,通过离心弃去上清液,将细胞重悬于PBS中,用流式细胞仪检测〔8〕。
1.4检测IFN-γ分泌水平 取出ELISPOT条带,加入200 μl无血清IMDM培养基进行封闭,静置10 min;诱导的CTL作为效应细胞,T2A2荷肽作为刺激细胞。根据ELISPOT实验技术说明书进行常规操作。最后将条带置于通风处,在室温下进行干燥;使用ELISPOT图像分析仪计数96孔板的斑点数〔9〕。
1.5治疗模式 H22细胞接种于昆明小鼠腹腔,6~8 d可产生腹水,通过腹水进行传代。1 w后抽取腹水常规培养于含10%胎牛血清的RPMI1640培养基中,置于37℃培养箱中进行培养。调整至1×107个细胞/ml。细胞生长至瓶底70%~80%时既是对数生长期。常规消毒后,在第0天将H22细胞皮下注射到小鼠的背部。当肿瘤长度和宽度约为0.5 cm,在第12天腹腔内注射100 μg/ml乳化后的表位肽。每隔4天免疫1次,出现第1个肿瘤时及时进行测量,游标卡尺每2天测1次,肿瘤体积=0.4×(长度×宽度)2。在31 d的时间里观察小鼠的存活情况〔10〕。
1.6统计学分析 采用SPSS16.0软件行方差分析及t检验。
2 结 果
2.1ELISPOT检测多肽免疫BALB/c小鼠分泌的IFN-γ P248-1Y组和P356-1Y2L组分泌的斑点数分别为(64.6±11.5)个和(245.4±109.2)个,显著高于PBS组的斑点数〔(13.0±4.4)个,P<0.05〕。见图1。

图1 候选肽在Balb/c小鼠体内特异性CTL分泌IFN-γ能力的检测
2.2GLMEEMSAL肽免疫能在BALB/c小鼠中特异性激活T细胞杀伤靶细胞 P356-1Y2L肽刺激的CD8+T淋巴细胞能够裂解靶细胞,而用P248-1Y肽和PBS刺激的脾细胞显示出较低的裂解活性。同时,对靶细胞HepG2+BB7.2未显示出杀伤活性。说明了P248-1Y和P356-1Y2L诱导的特异性CTL杀伤靶细胞具有HLA-A2限制性。见表1。

表1 表位肽免疫BALB/c小鼠CD8+T淋巴细胞的细胞毒活性
2.3胞内因子染色检测多肽免疫BALB/c小鼠诱导CTL的能力 P248-1Y和P356-1Y2L组CD8+T细胞能分泌IFN-γ水平分别为(1.84±0.22)%、(3.56±0.25)%,显著高于PBS表位组〔(0.78±0.16)%,P<0.05〕。见图2。
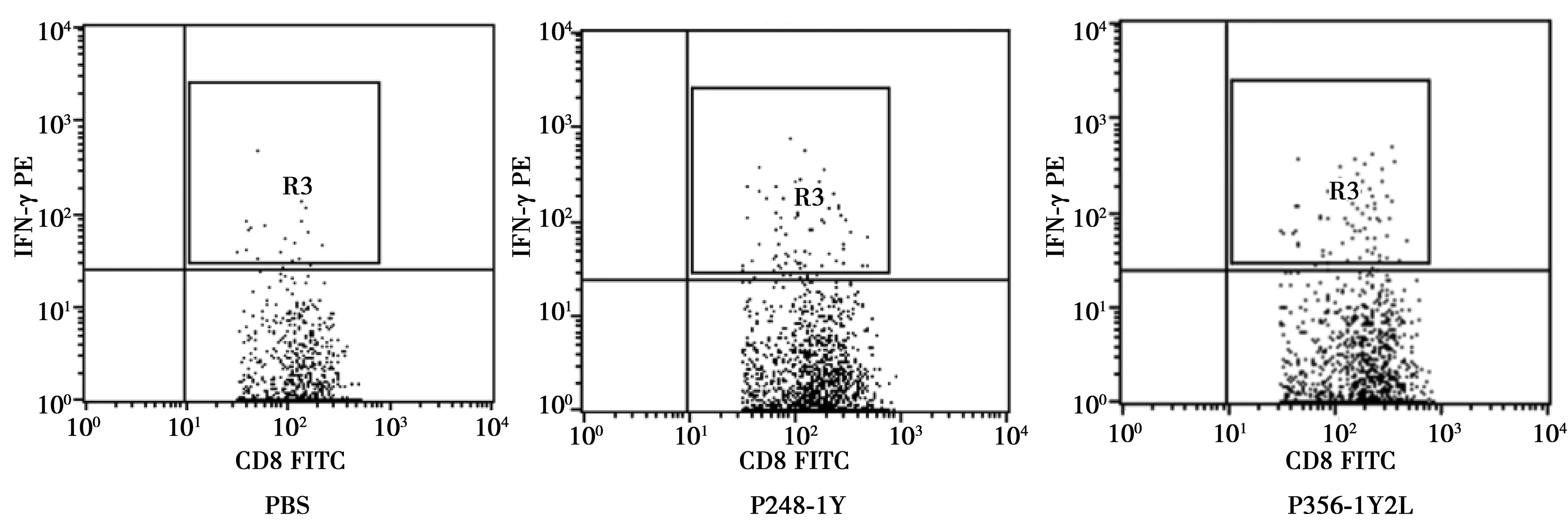
图2 胞内因子染色检测表位肽体内诱导CTL分泌IFN-γ的能力
2.4P356-1Y2L肽免疫抑制BALB/c小鼠肿瘤生长 在实验结束时,P356-1Y2L组与PBS相比,肿瘤生长减少高达40%。见图3。
2.5表位肽P356-1Y2L提高了荷瘤小鼠的生存期 与表位肽可以抑制BALB/c小鼠肿瘤生长一样,表位肽亦可提高荷瘤小鼠的生存期。相对于PBS组接受表位肽P356-1Y2L的免疫荷瘤小鼠的存活率显著升高(P<0.05)。见图4。

图3 BALB/c小鼠肿瘤模型中表位肽的抗肿瘤作用

图4 多肽免疫可增强荷瘤小鼠生存期
3 讨 论
肝癌的发生发展是从患者患有慢性炎症或肝硬化的非癌性肝病变逐渐发展成肝癌的,并且这些病变不能通过药物治疗来治愈或根除〔11〕。通过预防非癌性肝脏病变进展为肝癌及减轻肿瘤负担,免疫疗法可有效用于肝癌治疗并且预防疾病的发展〔4〕。然而,肿瘤免疫在肿瘤部位经常被抑制,特别是在易于表现出免疫耐受的肝脏微环境中,通过门静脉对已暴露的抗原减少异常免疫应答。目前,癌症免疫疗法采用两种不同的策略,增强效应细胞功能和释放免疫抑制性肿瘤微环境〔12〕。
人们普遍认为,多肽具有许多非常有吸引力的优点,包括有利的药代动力学特征和组织分布模式,血液的快速清除,低毒性和免疫原性及具有良好的溶解性〔13〕。鉴定和开发具有抗肿瘤特性的新型生物活性肽,为癌症的预防和治疗提供了良好的机会〔14〕。目前,多肽的从头设计和合成是抗肿瘤肽的主要来源形式,可以通过抑制肿瘤血管生成发挥有效的抗肿瘤活性。随着对癌症中涉及的蛋白质的结构、功能和相互作用的进一步研究,将发现越来越多可以特异性结合这些蛋白质的多肽〔15〕。在癌症治疗过程中,抗肿瘤肽面临着许多的治疗挑战,包括稳定性差、膜通透性低和容易被蛋白酶水解消化〔16〕。为了解决这些问题,已经广泛采用了3种不同类型的修饰策略,包括氨基酸取代,功能肽的结构融合和与化学治疗药物的缀合,并且已被证明在体内外活性实验中是有效的〔17〕。
基于T细胞的特异性免疫疗法被认为是最有希望的肿瘤治疗策略之一。CTL能够识别源自主要组织相容性复合物(MHC)Ⅰ类分子上呈递的肿瘤相关抗原(TAA)的表位肽,随后对肿瘤细胞进行裂解。人体中有效的肿瘤免疫是与针对肿瘤抗原CTL的存在有关,肿瘤抗原是一类源自肿瘤特异性抗原或TAA的HLA结合肽〔18〕。由于大多数TAA是自身抗原,在癌症患者中,靶向肿瘤相关自身抗原的特异性CTL由于胸腺耗竭而不常见,并且在产生抗体免疫应答方面效果不佳。所以需要用特殊的手段去提高表位肽的免疫原性〔19〕。此外,在临床研究中,已经有增强表位的免疫原性去诱导特异性的CTLs令人鼓舞的结果〔20~23〕。在实验中本文观察到用肽P356-1Y2L免疫BALB/c能够诱导识别和裂解肿瘤细胞CTL的活化。此外,本研究表明在体内使用MAGEC2衍生的表位提供抗肿瘤免疫治疗方案,可抑制肿瘤生长并延长小鼠的生存期。
在基于肽的免疫疗法的临床试验中,已经证明肿瘤抗原衍生的肽可以成功地诱导针对癌症的抗原特异性CTL〔24〕。本研究证明了对HLA-A2+具有高亲和力的MAGEC2衍生表位P356-1Y2L可诱导BALB/c小鼠中的抗肿瘤CTL反应。
