去甲亚精胺对白色念珠菌生物膜形成的抑制作用
2019-06-03曹焱帆章可可张燕妮汤丰瑜胡凤婷叶青松
曹焱帆,章可可,张燕妮,汤丰瑜,胡凤婷,叶青松
(温州医科大学 口腔医学院 干细胞与组织工程研究所,浙江 温州 325035)
生物膜是指黏附于组织表面,并包裹在由微生物产生的胞外复合物中的微生物膜性聚集体[1]。在微生物引起的体内感染中,以生物膜形式的感染占比超过80%[2]。生物膜的屏障作用可以阻碍治疗药物进入生物膜并作用于微生物,使得生物膜状态下的微生物对抗生素的抗性比浮游微生物提高了近千倍[3]。伴随着耐药性问题浮现,抗生素的地位正面临巨大威胁[4]。去甲亚精胺是一种多胺分子,这种多胺分子在原核和真核生物中普遍存在,是细胞生长所需的一种多胺[5]。早期研究发现去甲亚精胺在霍乱弧菌生物膜的形成过程中起到促进作用[6]。随后有许多的研究证实去甲亚精胺能抑制细菌生物膜形成。但是对真菌生物膜形成方面的研究较少,因此本实验将口腔常见真菌(白色念珠菌)作为研究对象,探讨去甲亚精胺对白色念珠菌生物膜形成的作用及机制。
1 材料和方法
1.1 材料
1.1.1 菌株:实验所用菌株是白色念珠菌(Candida albicans,C.Albicans)SC5314,由温州医科大学口腔医学院口腔研究所提供。
1.1.2 仪器和试剂:紫外可见分光光度计(上海仪电分析仪器有限公司);全波长微孔板读数板机(美国Thermo Fisher公司);体式显微镜(日本Nikon公司);高真空离子溅射仪(瑞士Leica公司);场发射扫描电镜(scanning electron microscope,SEM;日本Hitachi公司);定量PCR仪器(美国Life Technologies公司);去甲亚精胺(美国Sigma公司);RPMI1640培养基(美国Gibco公司);甲基四氮盐(XTT,美国Life Technologies公司);4-丙磺酸基吗啉(MOPS)、结晶紫染色剂、沙氏琼脂培养基、PBS(北京Solarbio公司);甲基丙烯酸树脂(上海张江生物材料有限公司);50%戊二醛(北京百灵威科技有限公司);TRIzol(美国Thermo Fisher公司);反转录及RT-PCR相关试剂(大连TaKaRa公司)。
1.2 方法
1.2.1 结晶紫染色:梯度稀释的去甲亚精胺和白色念珠菌悬液共同培养,观察生物膜量的形成。去甲亚精胺溶液在96孔细胞培养板内对倍稀释,设置为实验组,使其最终浓度范围为3.5~893.6 mmol/L。 0 mmol/L去甲亚精胺的RPMI1640培养基[7]作为对照组1;80.0 μmol/L氟康唑的RPMI培养基用作对照组2[8];13.4 mmol/L无水乙醇(氟康唑溶剂)的RPMI1640培养基用作对照组3。加入100 μL 1×105菌落形成单位(colony-forming units,CFU)/mL的白色念珠菌[9],并补齐至200 μL,在恒温培养箱中放置48 h,观察生物膜的形成情况。小心移除孔板内液体培养基,用无菌PBS冲洗3次。加入100 μL甲醇溶液固定样品,15 min后移除甲醇。用去离子水冲洗,风干,加入100 μL 0.1%(w/v)结晶紫染色剂,室温下浸染,30 min后移除结晶紫染液,用去离子水冲洗3次。体式显微镜观察孔板底部白色念珠菌生物膜的形成情况。在完成结晶紫染色的孔细胞培养板内加入150 μL 33%浓度的醋酸溶液脱色 5 min[10]。用移液枪反复吹打并吸取100 μL混合液至新的孔板内,使用全波长微孔板读板机进行读数,波长设定为590 nm。重复3次并取平均值。
1.2.2 生物膜代谢活性检测:将维生素K3溶于丙酮配制成10 mmol/L的维生素K3母液,备用。将XTT粉末和无菌磷酸盐溶液以0.5 mg/mL的浓度制成XTT溶液[11]。将XTT溶液与维生素K3母液以体积比为10 000:1混合以制备XTT工作液。在96孔细胞培养板将梯度稀释的去甲亚精胺和白色念珠菌以及对照组1、对照组2、对照组3在37 ℃下培养48 h。移除上清液,PBS轻轻冲洗清除残留浮游细菌。每孔加100 μL XTT工作液,在37 ℃培养1 h。用移液枪小心将上清液移入新的孔板,使用全波长微孔板读板机进行读数,波长设定为490 nm。重复3次并取平均值。
1.2.3 菌落计数:通过收集实验组以及对照组孔板底部生物膜,并对其进行CFU计数,检查对白色念珠菌生物量的影响。实验组及生物膜培养方法与上述相同。收集各组生物膜。充分震荡,保证生物膜的完全分离。不同组的培养基进行连续10倍稀释,作为工作菌液溶液,取10 μL溶液滴在沙氏琼脂固体培养基上均匀涂布,并在37 ℃下培养24 h,并进行CFU计数[12]。重复3次并取平均值。
1.2.4 SEM成像:将制备好的1 cm×1 cm的甲基丙烯酸树脂片放置于24孔细胞培养板底部,使白色念珠菌在义齿基托树脂片上形成生物膜。PBS冲洗去除残留培养基和浮游细菌,1 mL 2.5%终浓度的戊二醛固定样品,并在室温下静置2~16 h。PBS洗涤2次,依次用浓度30%、40%、50%、60%、70%、80%、90%、95%和100%的梯度乙醇脱水15 min[13],在无水乙醇中可短暂保存。移除无水乙醇,将样品放置于37 ℃烘箱12 h,进行干燥。用高真空离子溅射仪对样品表面进行25 s镀膜后,在场发射SEM观察白色念珠菌的形态和生物膜的量。
1.2.5 实时定量qRT-PCR:使白色念珠菌在0 mmol/L、 14.0 mmol/L和27.9 mmol/L浓度的去甲亚精胺环境下在甲基丙烯酸树脂片上形成生物膜。在37 ℃下培养48 h后,用灭菌的探针将生物膜刮下来。通过离心收集生物膜。玻璃磁珠破壁并使用TRIzol提取RNA。采用Nanodrop 2000检测RNA的纯度和浓度,并使用琼脂糖凝胶电泳法检测RNA的完整性。使用大连TaKaRa公司试剂盒(操作方法参考使用说明书)将RNA反转录获得cDNA,反应条件设定为42 ℃,2 min,在4 ℃冰箱中保存。PCR反应体系的总体积为20 μL,分别是荧光染料(SYBR Premix Ex TaqII)10 μL,上游引物(PCR Forward Primer)0.8 μL,下游引物(PCR Reverse Primer)0.8 μL,参比染料(ROX Reference DyeII)0.4 μL,引物模板2 μL和灭菌蒸馏水6 μL。反应程序如下:在95 ℃预变性30 s,在95 ℃变性5 s,在55 ℃退火30 s,在72 ℃延伸30 s,40个循环,每个基因组设置3个复孔,结果使用2-△△CT分析法分析数据[14]。引物序列见表1。

表1 qRT-PCR引物序列
1.3 统计学处理方法 所有实验至少独立进行3次,使用SPSS24.0软件进行统计分析。多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 结晶紫定性分析 结果显示,与0 mmol/L去甲亚精胺的RPMI1640培养基的对照组1(见图1a)对比,111.7 mmol/L及以上浓度的去甲亚精胺作用下,白色念珠菌生物膜几乎不能形成(见图1b-e)。55.9 mmol/L 去甲亚精胺作用下,在孔板底部仍有较薄的生物膜形成(见图1f)。而27.9 mmol/L及以下浓度的去甲亚精胺则完全无法抑制生物膜的形成(见图1g-j)。含有80.0 μmol/L的氟康唑对照组2孔板底部可见较薄的生物膜形成(见图1k),含有13.4 mmol/L无水乙醇(氟康唑溶剂)的RPMI1640培养基的对照组3不能抑制生物膜形成(见图1l)。

图1 结晶紫染色定性分析去甲亚精胺对白色念珠菌生物膜形成的影响
2.2 结晶紫定量分析 通过对上述定性染色结果进行脱色溶解并检测其吸光度发现,白色念珠生物膜形成的抑制作用与去甲亚精胺浓度呈正相关关系,当浓度≥111.7 mmol/L时,吸光度值趋近于0(见图2),表明白色念珠菌几乎不能形成生物膜。去甲亚精胺浓度为111.7 mmol/L的实验组的吸光度值低于80.0 μmol/L的氟康唑(对照组2),差异有统计学意义(P<0.05)。当去甲亚精胺浓度≤ 55.9 mmol/L时,白色念珠菌形成生物膜的能力随药物浓度降低而增强(P<0.05)。0 mmol/L去甲亚精胺的RPMI1640培养基(对照组1)和13.4 mmol/L无水乙醇的RPMI1640培养基(对照组3)无抑制作用,2组差异无统计学意义(P>0.05)。

图2 结晶紫染色定量分析去甲亚精胺对白色念珠菌生物膜形成的影响

图3 XTT定量分析去甲亚精胺对白色念珠菌生物膜代谢活性的影响
2.3 XTT检测 去甲亚精胺对白色念珠菌生物膜代谢活性作用的结果见图3。111.7 mmol/L及以上浓度的去甲亚精胺的实验组中,白色念珠菌的生物代谢活性趋近于0。去甲亚精胺浓度为111.7 mmol/L的实验组,生物膜代谢活性低于80.0 μmol/L氟康唑(对照组2),差异有统计学意义(P<0.05)。
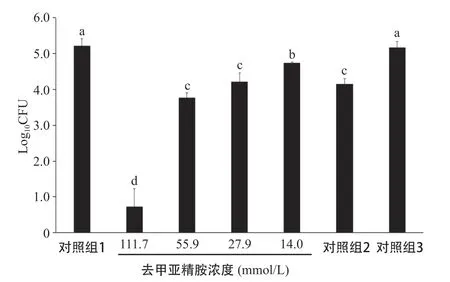
图4 不同浓度去甲亚精胺对白色念珠菌CFU计数的影响
2.4 CFU计数 去甲亚精胺对白色念珠菌生物量的影响见图4。与不含有去甲亚精胺的RPMI1640培养基(对照组1)比较,111.7 mmol/L的去甲亚精胺能基本杀灭白色念珠菌,并且与80.0 μmol/L的氟康唑(对照组2)对比,更好地减少白色念珠菌的生物量,差异有统计学意义(P<0.05)。当去甲亚精胺浓度≤55.9 mmol/L时,白色念珠菌生物膜中的生物量随着药物浓度的降低而升高。含有13.4 mmol/L 无水乙醇的RPMI1640培养基(对照组3)则对白色念珠菌基本没有杀菌作用。
2.5 生物膜SEM观察 在0 mmol/L去甲亚精胺的RPMI1640培养基(对照组1)和13.4 mmol/L无水乙醇的RPMI1640培养基(对照组3)共同培养的义齿基托树脂片上可见菌丝相真菌交织形成较厚的生物膜(见图5A、C)。加入111.7 mmol/L的去甲亚精胺时,义齿基托树脂上仅可见少量极其稀疏的酵母相白色念珠菌(见图5D)。当去甲亚精胺的浓度≤55.9 mmol/L 时,白色念珠菌生物膜随着药物浓度的降低而变厚,且真菌形态逐渐由酵母相向菌丝相转变(见图5E-G)。含有80.0 μmol/L的氟康唑(对照组2)义齿基托树脂片上可见少量菌丝相和酵母相的真菌形成的菌落(见图5B)。
2.6 实时定量qRT-PCR 由于生物膜量的收集问题,实验仅检测27.9 mmol/L和14.0 mmol/L浓度的去甲亚精胺和0 mmol/L去甲亚精胺的对照组1的qRT-PCR实验结果(见图6)。通过对目的基因hwp、als3和ywp的扩增所得的ct值与内参基因18S rRNA对比。当去甲亚精胺的浓度为27.9 mmol/L时,白色念珠菌黏附相关的als3、chs1和菌丝相表达相关的hwp均处于较低的表达水平,显著低于对照组1和14.0 mmol/L去甲亚精胺的实验组的基因表达水平,差异有统计学意义(P<0.05)。当去甲亚精胺的浓度为14.0 mmol/L时,hwp和als3基因表达水平仍明显低于对照组1,差异有统计学意义(P<0.05)。但csh1基因表达水平明显升高,稍高于对照组1,且与27.9 mmol/L去甲亚精胺组对比差异有统计学意义(P<0.05)。
3 讨论
白色念珠菌是人体常见的共生真菌之一,当机体免疫功能低下时,白色念珠菌可引起口腔和阴道黏膜疾病和全身性疾病[15-16]。白色念珠菌也是义齿性口炎的主要致病真菌。有研究表明,去甲亚精胺对沙门氏菌、变异链球菌、大肠杆菌、铜绿假单胞菌细菌生物膜的形成均有不同程度的抑制[17]。本实验研究了去甲亚精胺对常见致病真菌白色念珠菌生物膜形成的作用,结果表明去甲亚精胺能显著抑制白色念珠菌生物膜的形成且能抑制白色念珠菌毒力相关基因的表达。

图5 SEM观察去甲亚精胺和氟康唑对生物膜形成的作用(×2 000)
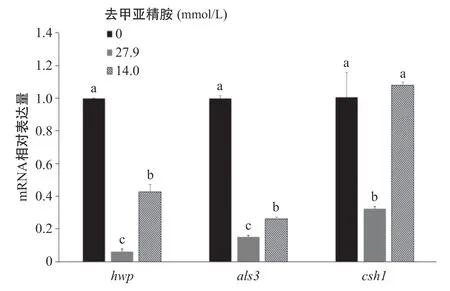
图6 0、27.9和14.0 mmol/L去甲亚精胺对白色念珠菌hwp、als3和csh基因相对表达量的影响
结晶紫、XTT、CFU计数和SEM的结果表明,适当浓度的去甲亚精胺可抑制白色念珠菌生物膜形成,降低白色念珠菌代谢活性,减少生物膜的生物量。研究表明去甲亚精胺可通过调节生物膜的pH值、CO2[18]和促进胞外多糖离散[19]等机制抑制细菌生物膜的形成。去甲亚精胺对抑制白色念珠菌生物膜形成的具体分子机制有待进一步研究。
SEM观察发现,当去甲亚精胺的浓度≥55.9 mmol/L时,白色念珠菌主要以酵母相的形态存在;当去甲亚精胺的浓度≤27.9 mmol/L时,抑制生物膜形成的作用减弱,酵母相白色念珠菌数量明显高于菌丝相白色念珠菌。菌丝相和酵母相是白色念珠菌2种不同的存在形态。菌丝相比酵母相具有更强的黏附、入侵宿主细胞和引起炎症等能力[20]。白色念珠菌在体外条件下通常以酵母相的形态存在,环境中的营养、pH值、细胞表面的接触感应和黏附相关蛋白的分泌可促进白色念珠菌从酵母相向菌丝相转化[21]。
本研究发现,去甲亚精胺能明显降低白色念珠菌als3、csh1和hwp基因的表达水平。hwp与白色念珠菌丝相形成相关,als3与黏附相关,csh1与疏水性表达相关[22]。结合SEM的结果,去甲亚精胺通过降低黏附相关基因的表达,减少细胞外基质的产生,从而起到抑制生物膜形成的作用,并且通过抑制真菌由酵母相向菌丝相转换,降低白色念珠菌的致病性。值得关注的是当去甲亚精胺的浓度为14.0 mmol/L 时,其对生物膜形成没有明显的抑制作用,PCR结果显示与白色念珠菌黏附相关的基因chs1表达水平较高,且高于对照组1。通过SEM可以发现,真菌生物膜表面有较多细胞外基质产生,csh1基因表达升高,造成黏附相关蛋白升高,引起真菌向菌丝相形态转换。这在生物膜的形成中是否起到决定作用有待进一步研究。
综上所述,本研究表明适当浓度的去甲亚精胺不仅能有效抑制白色念珠菌生物膜的形成,且能显著降低白色念珠菌致病毒力相关基因表达的水平。去甲亚精胺可能是一种潜在的抗真菌药物,但是对于真菌是否会对其产生耐药性及其生物安全性问题,仍需进一步研究。
