一种新型纤维蛋白原β链错义突变导致的遗传性低纤维蛋白原血症
2019-06-03朱丽青张海月罗莎莎方薇薇刘斯奇苏看看杨丽红王明山
朱丽青,张海月,罗莎莎,方薇薇,刘斯奇,苏看看,杨丽红,王明山
(温州医科大学附属第一医院 医学检验中心,浙江 温州 325015)
遗传性纤维蛋白原缺陷症(congenital fibrinogen deficiency,CFD)是一种少见的出血性疾病,分为I型和II型2 种类型。I型患者血浆中纤维蛋白原(fibrinogen,Fg)数量减少,包括低纤维蛋白原血症和无纤维蛋白原血症;II型患者血浆中Fg数量正常,但出现功能缺陷,主要包括异常纤维蛋白原血症和异常低纤维蛋白原血症[1]。基因突变是导致CFD的分子基础,可发生于Fg Aα链、Bβ链和γ链,突变类型包括错义突变、移码突变、无义突变及大片段缺失等[2]。本研究对1例遗传性低纤维蛋白原血症进行了表型检测和基因分析,并且运用Swiss-PdbViewer等生物信息学工具对突变进行预测分析,初步探讨引起遗传性低纤维蛋白原血症的机制。
1 对象和方法
1.1 对象
1.1.1 病例资料:先证者,女,30岁,此次因乳腺小叶增生来温州医科大学附属第一医院就诊。术前常规凝血功能检查发现凝血酶原时间(prothrombin time,PT)和凝血酶时间(thrombin time,TT)轻度延长,纤维蛋白原活性(fibrinogen activity,Fg:C)和血浆纤维蛋白原的抗原(fibrinogen antigen,Fg:Ag)明显降低,分别为0.82 g/L和1.19 g/L,其他凝血指标均无明显异常,肝肾功能正常。患者无诉鼻衄、出血难止、自发性出血等症状,亦无血栓病史。该家系的系谱图见图1。

图1 遗传性低纤维蛋白原血症家系图
1.1.2 正常对照:选取我院体检中心150名健康体检者为正常对照,用以排除基因多态性。其中男78名,女72名,年龄26~59(38.6±24.8)岁。健康对照确认无肝肾功能疾病,无出血与血栓史,采样前均已知情同意。
1.2 方法
1.2.1 仪器:STA-R全自动凝血功能分析仪(法国STAGO公司)、Beckman Coulter LX20PRO全自动生化分析仪(美国Beckman公司)、PCR扩增仪(ABI Thermal cycler 2720,美国ABI公司)、凝胶电泳仪(上海BIO-RAD公司)、凝胶成像系统(上海天能公司)。
1.2.2 引物:共包括29对引物(由上海交通大学医学院附属瑞金医院检验科王学锋教授馈赠)[3],覆盖了纤维蛋白原基因FGA、FGB、FGG所有外显子及侧翼序列和启动子区,其基因序列分别为:GenBank M64982、M64983、M10014。
1.2.3 试剂:常规凝血项目试剂盒为法国STAGO公司原装配套试剂,Fg:Ag检测试剂盒购自浙江伊利康生物技术有限公司,血液基因组DNA提取试剂盒及PCR扩增试剂盒均购自北京天根生化科技有限公司。
1.2.4 样本采集:本研究已通过本院伦理委员会批准,并已签订先证者及其家系成员的知情同意书。共采集该家系2代6名成员及正常对照组的外周血标本,用109 mmol/L枸橼酸钠以1:9抗凝,3 000 r/min离心10 min后,上层血浆于2 h内进行凝血指标检测;下层血细胞-40 ℃冻存,用于DNA抽提。
1.2.5 凝血项目分析:在Stago-R全自动血凝仪上检测活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、PT、TT、Fg:C、D-二聚体(D-dimer,D-D)和纤维蛋白(原)降解产物 (fibrinogen degradation product,FDP);Beckman Coulter LX20全自动生化分析仪上检测Fg:Ag。
1.2.6 Fg突变位点筛查:用全血DNA抽提试剂盒提取先证者及其家系成员外周血DNA。PCR法扩增先证者FGA、FGB、FGG基因所有外显子及侧翼序列和启动子区。PCR反应总体积为50 μL,包括PCR Master Mix 25 μL、双蒸水18 μL、DNA模板3 μL和上下游引物各2 μL。反应条件为:94 ℃预变性5 min; 94 ℃ 30 s,56~60 ℃退火30 s,72 ℃延伸1 min; 30个循环后72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳鉴定后,送上海桑尼生物科技有限公司测序分析(所用测序仪为ABI PRISM 3730)。测序结果用Chromas软件与GeneBank中的相应序列进行比对(M64982、M64983、M10014),并对150名健康对照者进行该位点检测,以排除基因多态性的可能。
1.2.7 生物信息学分析:基于已知的Fg结构模型(http://www.rcsb.org/pdb,PDB ID:1FZA),分别用Swiss-PDViewer、在线分析系统(http://www.uniprot.org/align)对突变蛋白的结构、突变位点的保守性进行预测分析。
2 结果
2.1 凝血指标检测 先证者PT和TT均轻度延长,Fg:C和Fg:Ag明显降低。先证者父亲和儿子的Fg:C和Fg:Ag也均有不同程度降低,TT也延长,他们的D-D和FDP均在正常范围;其他家系成员的Fg:C、Fg:Ag及相关凝血指标均在正常范围(见表1)。
2.2 基因检测 先证者FGB基因发现第3外显子存在c.425T>G杂合突变(见图2),导致Fg第121位亮氨酸被替换为精氨酸(Leu121Arg)。通过分析其家系成员,发现其父亲和儿子FGB基因也携带有c.425T>G杂合突变。针对该突变位点,我们对150名健康体检者的相应位点进行筛查,均未发现该突变,排除了基因多态性的可能性。检索突变数据库(http://www.geht.org/databaseang/fibrinogen)及查阅文献显示:该突变类型为国际上尚未见报道的新突变。
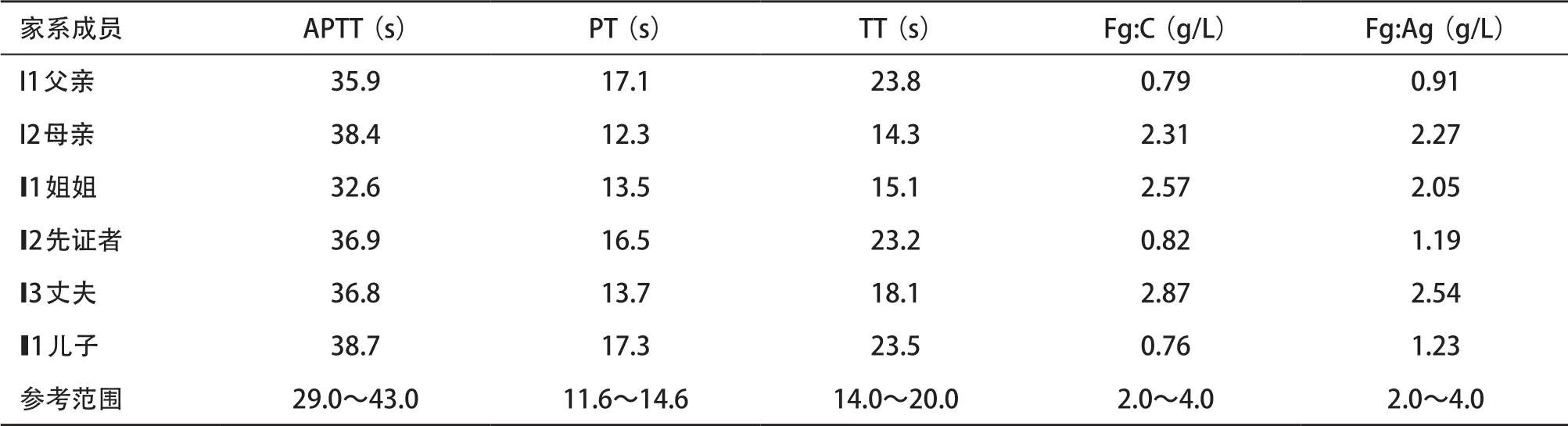
表1 先证者及其家系成员凝血指标及表型检测结果
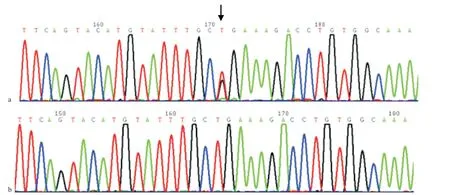
图2 纤维蛋白原FGB 基因第3外显子的测序结果
2.3 Fg Leu121Arg突变蛋白的模型预测分析 Leu121 位于FgBβ链三股螺旋的初始部位,紧挨着卷曲螺旋结构域,为非极性疏水氨基酸,当突变为Arg后,改变了氨基酸的极性。Swiss-PDViewer模型预测分析发现,当Leu121突变为Arg后,在Arg121和Try117、Met118、Trp125之间新增了氢键(见图3)。ClustalX-2.1-win软件蛋白同源性分析发现:Leu121在小鼠、人类、黑猩猩、犬、牛等多种脊椎动物间有较高的保守性(见表2)。
3 讨论
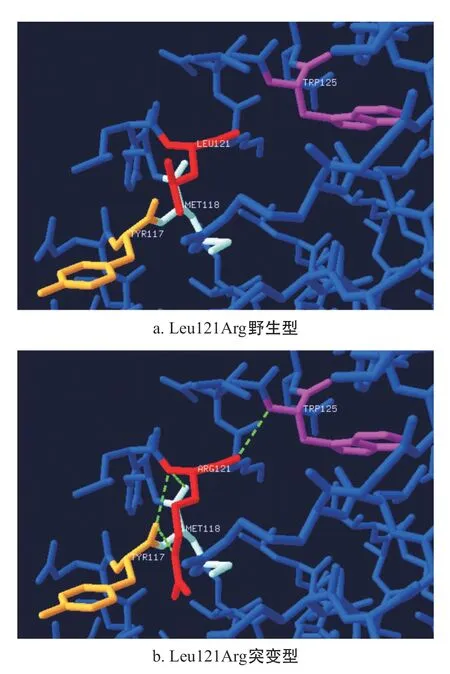
图3 Leu121Arg突变模型分析
Fg又称为凝血因子I,由Aα、Bβ、γ 3条多肽链构成,是血浆中含量最高的凝血因子,在凝血和止血过程中均起到了非常重要的作用。Fg的3条多肽链以对称性二聚体(Aα、Bβ、γ)2的形式存在,分别由FGA、FGB、FGG3个独立的基因编码[4]。这3个基因的缺陷可导致Fg含量或(和)功能异常,分别导致遗传性无纤维蛋白原血症、遗传性低纤维蛋白原血症、遗传性异常纤维蛋白原血症及遗传性异常低纤维蛋白原血症[5]。目前已报道的位于Fg基因(FGA、FGB和FGG)的突变类型共有300余种,包括错义突变、无义突变、剪切突变以及移码突变。这些突变主要发生在Aα链上,其次为γ链,而Bβ链最为少见。查阅突变数据库(HGMD,http://www.hgmd.cf.ac.uk/ac/all.php),到目前为止,发生在Bβ链上的突变类型仅报道有97种,大都位于Bβ链的C端[6]。
本研究中,我们发现1例位于β链三股螺旋初始部位的Leu121Arg错义突变,引起遗传性低纤维蛋白原血症:先证者Fg:C和Fg:Ag分别为0.82 g/L和1.19 g/L,其父亲和儿子的Fg:C和Fg:Ag也明显降低。基因分析发现:他们在FGB基因第3外显子的425位均有T>G杂合突变,导致Leu121Arg错义突变。蛋白同源性分析显示:Leu121在脊椎动物中有较高的保守性,提示该位点对于Fg正常结构和功能非常重要。Leu121Arg突变,有可能影响了Fg的结构,导致蛋白稳定性下降。此外,PDViewer蛋白预测分析软件发现:非极性疏水氨基酸Leu121突变为极性氨基酸Arg121,一方面改变了氨基酸的疏水性;另一方面,导致Arg121和Try117、Met118、Trp125之间新增了氢键。因而,该突变有可能影响了突变蛋白的二级结构,导致其折叠、构象及稳定性改变,引起血浆Fg水平降低。
查阅文献和检索Fg基因突变数据库(http://www.geht.org/databaseang/fibrinogen)发现,Leu121Arg为首次发现的新突变。Leu121位于Fg Bβ链三股螺旋的初始部位,紧挨Bβ链的卷曲螺旋结构域。以往研究表明:Bβ链的合成被认为是Fg合成组装的限速步骤[6-7]。其中,卷曲螺旋结构域对于Fg Aα、Bβ、γ链的正常组装至关重要[8];而C端则与Fg分泌密切相关[6]。HANSS等[9]曾报道1例由Fg Met118Lys突变引起的低纤维蛋白原血症,该突变因为改变了氨基酸极性,导致Fg分子构像发生改变,先证者伴有出血表现及流产病史。Leu121邻近Met118,两者均位于Bβ链毗邻卷曲螺旋结构域的区域,因此,我们推测,Leu121Arg突变也有可能通过影响该结构域的稳定性,导致Fg的组装异常,引起低纤维蛋白原血症。
综上所述,本研究发现了一个位于B β 链Leu121Arg错义突变引起的遗传性低纤维蛋白原血症家系,该突变可能通过改变氨基酸极性,影响氢键形成等影响突变体的稳定性,导致遗传性低纤维蛋白原血症。其具体机制有待进一步的体外表达研究。

表2 蛋白同源性分析结果
