和厚朴酚通过UbcH8诱导AML1-ETO蛋白降解
2019-06-03李海英周斌吴建波邢冲云
李海英,周斌,吴建波,邢冲云
(温州医科大学附属第一医院,浙江 温州 325015,1.中心实验室;2.血液内科)
AML1-ETO易位是急性髓细胞白血病(acute myeloid leukemia,AML)中最常见的染色体异常之一。由此产生的AML1-ETO融合蛋白由野生型AML1蛋白的NH2末端部分和几乎整个ETO蛋白质序列组成,AML1-ETO通过抑制正常的AML1功能在白血病转化中发挥起始和关键性作用[1]。AML1-ETO与其他基因突变如CEBPA[2]、c-kit[3]或RTK[4]协同迅速诱导白血病的发生。
和厚朴酚(Honokiol,HNK)是一种从植物厚朴的茎和皮中分离得到的天然酚类化合物[5],能通过靶向多种信号传导分子包括Wnt1-β-catenin[6]、JAK2/STAT3[7-8]和表皮生长因子受体(epidermal growth factor receptor,EGFR)[9],发挥抗肿瘤和抗血管生成活性。我们已经报道过HNK对AML有治疗作用[10],并在前期实验中发现HNK能引起AML1-ETO蛋白的降解。本实验旨在研究HNK降解AML1-ETO蛋白的可能机制。
1 材料和方法
1.1 细胞培养 人AML1-ETO+白血病细胞株Kasumi-1 购自ATCC,培养在含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2、饱和湿度培养箱中。分别将10、20、40 μmol/L HNK加入细胞上清液中,待24 h和48 h后提取mRNA和蛋白。10 μg/mL放线菌酮(美国Sigma公司)分别加入含或不含40 μmol/L HNK的Kasumi-1细胞中,于0、4、8、12、16、24 h提取蛋白进行检测。
1.2 Western blot检测相关蛋白的表达 相关抗体包括AML1(美国CST公司)、ETO(美国Santa Cruz Bio-technology公司)、UbcH8(美国Abcam公司)、β-actin(德国Merck Millipore公司)。按标准流程操作,在Bio-Rad ChemiDoc XRS+化学发光成像系统上拍照,使用Quantity One分析软件分析灰度值。
1.3 mRNA的提取和实时定量PCR(qRT-PCR) TRIzol 法提取总RNA,用反转录试剂盒(美国Fermentas公司)合成cDNA,用AML1-ETO和UbcH8上下游引物PCR扩增,以GAPDH为内参,SYBR Green荧光染料法相对定量,使用ABI7500荧光定量PCR仪检测。引物由上海生工合成,序列见表1。
1.4 基因芯片分析 从40 μmol/L HNK处理24 h的Kasumi-1细胞中提取总RNA,通过Super Script II 反转录酶(美国Invitrogen公司)将总RNA转化为cDNA并扩增,将cDNA杂交到人基因芯片3’IVT表达试剂盒(美国Affymetrix公司)上。使用PartekGS6.5 软件包(美国Affymetrix公司)进行分位数标准化和随后的数据处理。由阵列表示的所有基因在特定产物的熔解曲线上显示单峰。使用由制造商提供的基于Excel的PCR阵列数据分析软件来分析基因表达。基因科技(上海)股份有限公司完成了基因芯片分析。

表1 引物序列
1.5 质粒的构建 为了产生UbcH8(UBE2L6;NM_ 004223)过表达质粒,通过PCR扩增人UbcH8编码序列,然后将其克隆到反转录病毒载体pMSCV-puro(美国Clontech公司)中。设计针对UbcH8的基因特异性短发夹RNA(shRNA),并将其克隆到反转录病毒载体pSIREN-RetroQ(美国Clontech公司)中。所有质粒构建的引物序列如表1所示。
1.6 包装反转录病毒和细胞转染 将HEK-293T细胞(4×106)铺在10 cm培养皿中。24 h后,用包装质粒Gap-pol和VSV-G载体将MSCV-puro-UbcH8、MSCV-puro-AML1-ETO、pSIREN-UbcH8或阴性对照载体共转染到HEK-293T细胞中。转染48 h后从上清液中收集病毒,并进一步通过0.45 μmol/L滤器(德国Merck公司)过滤。将白血病细胞(2×105/mL)悬浮于含有8 μg/mL polybrene(美国Sigma公司)的病毒上清液中并以2 000 r/min离心2 h。嘌呤霉素 2 μg/mL(美国MCE公司)加入到上清液中1周以选择阳性克隆。
1.7 t(8;21)白血病小鼠模型 从上海斯莱克实验动物有限责任公司购买雄性无胸腺裸鼠和C57BL/6小鼠(4周龄),动物许可证号:SCXK(沪)2012-0002,并将其放置在垫料笼中,12 h光暗循环,可用的食物和水。对于裸鼠的异种移植模型,将1×107个Kasumi-1细胞与高浓度的Matrigel基质胶(美国BD公司)1:1比例混合,皮下注射到每只裸鼠的右侧。2周后,将小鼠随机分为2组。1组小鼠(n=5)每周3次腹膜内注射溶于20%脂肪乳剂的HNK(3 mg/d);另1组小鼠(n=5)接受等体积的脂肪乳剂,并作为对照组。当肿瘤细胞接种6周后,处死小鼠,实验终止,收集每只小鼠的肿瘤组织。记录肿瘤体积。使用等式V(inmm3)=A×B2/2来测量肿瘤体积,其中A是最大直径,B是垂直直径。所有组的肿瘤组织迅速在液氮中冷冻备用。
1.8 统计学处理方法 采用SPSS19.0软件。计量资料两两比较用独立样本t检验,多组比较用单因素方差分析,不同时间2组间比较用重复测量资料的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 HNK诱导AML1-ETO蛋白的降解 将携带内源性AML1-ETO的Kasumi-1细胞分别用10、20和40 μmol/L HNK处理不同的时间,Western blot检测结果表明,HNK能减少Kasumi-1细胞中的AML1-ETO融合蛋白,并且具有浓度和时间依赖性(见图1A-C);然而,HNK并没有改变Kasumi-1细胞中的AML1-ETO mRNA表达水平(见图1D)。将Kasumi-1细胞用含有或不含HNK的蛋白质合成抑制剂放线菌酮处理不同时间,结果发现,HNK处理的Kasumi-1细胞中AML1-ETO蛋白的半衰期明显短于未处理的细胞(见图1E),表明HNK处理后AML1-ETO蛋白的稳定性变低。
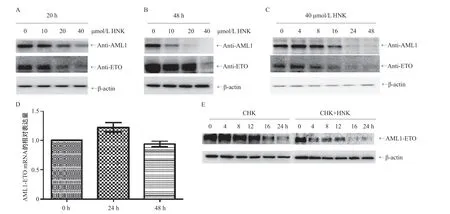
图1 HNK诱导的AML1-ETO降解
2.2 通过基因芯片分析寻找目标基因 使用基因芯片分析来比较HNK处理前后的Kasumi-1细胞中mRNA表达,结果表明,HNK增加了1 168个不同的基因(>2倍)和降低了212个不同的基因(<2倍)(见图2A-B),其中UbcH8(一种E2结合酶[11])表达提高了约4倍(见图2C)。
2.3 UbcH8在HNK诱导的AML1-ETO蛋白降解中的作用 将Kasumi-1细胞用40 μmol/L HNK处理24 h和48 h,HNK显著增加Kasumi-1细胞中UbcH8的mRNA和蛋白表达(P<0.05),见图3A-B。用反转录病毒MSCV-UbcH8转染Kasumi-1细胞,使Kasumi-1细胞中的UbcH8过表达,实验结果显示,UbcH8的过度表达有效地诱导了AML1-ETO的降解(见图3C)。UbcH8被特定的shRNA敲除后,在Kasumi-1细胞中,2个独立的shRNA有效地降低了UbcH8蛋白的表达(见图3D)。此外,稳定敲除UbcH8的Kasumi-1细胞用HNK处理,结果表明,敲除UbcH8后HNK对AML1-ETO蛋白的降解被阻断(见图3E)。
2.4 HNK在Kasumi-1异种移植小鼠模型中的作用 HNK处理的小鼠中的肿瘤体积显著小于对照小鼠中的肿瘤,见图4A。与对照小鼠相比,HNK处理后小鼠的肿瘤生长速度显著降低,见图4B。与对照小鼠相比,用HNK处理过的小鼠获得的肿瘤中AML1-ETO的蛋白质水平显著降低,UbcH8表达增加,差异有统计学意义(P<0.05),见图4C。

图2 基因芯片分析结果
3 讨论
t(8;21)易位产生AML1-ETO蛋白,它能抑制普通AML1蛋白的功能,导致造血细胞生物学特性改变,从而在白血病的转化过程中起到关键作用[12-14]。 转基因小鼠研究显示,单独AML1-ETO基因表达并不能诱发白血病,AML1-ETO联合其他致癌基因如WT1(Wilm’s tumor-1)、KRAS等快速诱导转基因小鼠白血病[15-16]。进一步研究发现AML1-ETO联合低氧诱导因子(hypoxia-inducible factor 1α,HIF1α)增强白血病细胞增殖,促进小鼠白血病发生发展[17]。这些研究结果提示:t(8;21)易位阳性的M2型AML的发生是在AML1-ETO融合蛋白的基础上需要联合其他遗传学改变,也就是所谓的“二次打击”,共同作用,最终引发白血病。
HNK是从植物厚朴的干皮、根及树叶中提取的中药单体,最近研究结果显示HNK对乳腺癌、甲状腺癌、肺癌、口腔鳞癌等有很好的疗效[18-22]。我们已经报道过HNK可以诱导AML细胞周期停滞和凋亡,但对正常的造血干细胞没有影响[10]。我们又在前期实验中发现HNK能够降解白血病细胞中的AML1-ETO蛋白,因此我们进一步研究了HNK降解AML1-ETO蛋白的可能机制。
我们在实验中发现,HNK对AML1-ETO的降解具有时间和浓度依赖性,时间越长,浓度越高,Kasumi-1 细胞中AML1-ETO蛋白量越低;但是HNK并没有影响AML1-ETO mRNA的表达,说明其对AML1-ETO的调控是在转录之后。我们将HNK加入CHX处理后的Kasumi-1细胞,发现AML1-ETO蛋白半衰期变短,也说明HNK对AML1-ETO的调控是在蛋白层面上。

图3 UbcH8在HNK诱导的AML1-ETO降解中的作用
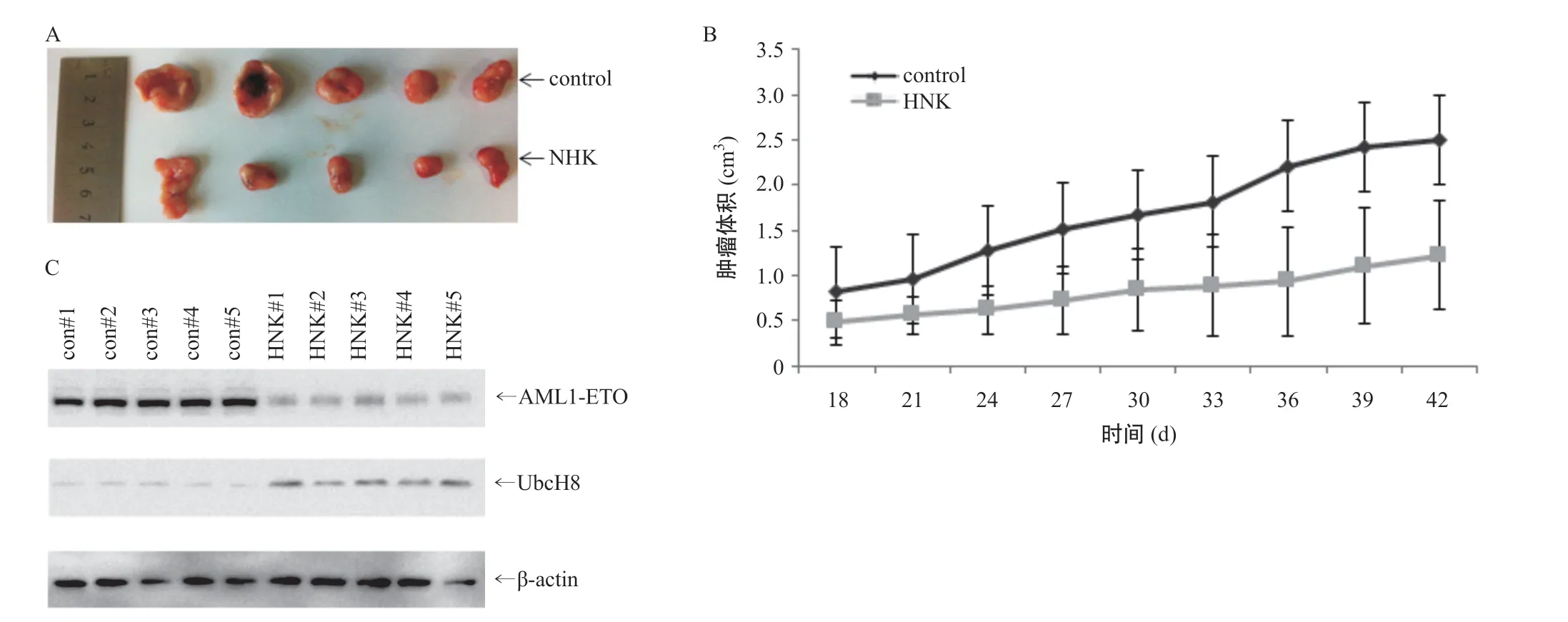
图4 HNK在裸鼠Kasumi-1异种移植模型中的抗肿瘤作用
我们又通过基因芯片分析寻找到UbcH8,发现HNK能增加它的表达,qRT-PCR和Western blot结果也证明了这一点。UbcH8是一种E2结合酶,能催化泛素与蛋白底物结合,使泛素活化,从而导致底物被蛋白酶降解。有文献报道,UbcH8能介导AML1-ETO蛋白的降解[23],因此我们猜测UbcH8在HNK降解AML1-ETO过程中起到关键作用。
为了证明UbcH8的作用,我们用反转录病毒转染Kasumi-1细胞,使UbcH8过表达,结果AML1-ETO蛋白减少;而在稳定敲除了UbcH8的Kasumi-1细胞中,即使加入HNK,也不能引起AML1-ETO蛋白表达的下降,说明HNK对AML1-ETO蛋白的降解正是通过UbcH8来介导的。我们猜测,HNK可能是通过泛素-蛋白酶体系来降解AML1-ETO蛋白,UbcH8在其中起关键作用。其具体的作用机制,将是我们后续实验的重点。
最后,我们构建了异种移植小鼠模型,经过HNK处理的小鼠肿瘤体积小于对照组,肿瘤生长速度也下降,从HNK处理的小鼠体内获得的肿瘤中提取蛋白,检测发现AML1-ETO蛋白下降,而UbcH8升高。这证明了HNK具有成为临床治疗t(8;21)白血病患者药物的可能。
已经证明消除白血病发生的起始因素是非常有效的治疗策略。例如,用于慢性髓细胞白血病的BCR-ABL的药物格列卫[24],用于t(15;17)的急性早幼粒细胞白血病中的PML-RARa的全反式维甲 酸[25-26]已经在治疗白血病中取得了重大的进展。但是,到目前为止还没有专门针对AML1-ETO融合蛋白的药物用于临床治疗。作为一种中草药中提取的天然化合物,HNK能有效地降解AML1-ETO蛋白,有可能为临床治疗t(8;21)白血病提供帮助。
