靶向STAT3信号通路小分子抑制剂的设计、合成及其生物活性
2019-06-03何琴张焕杜旭泽郭焘宁叶发青
何琴,张焕,杜旭泽,郭焘宁,叶发青
(温州医科大学 药学院,浙江 温州 325035)
信号转导和转录激活因子(signal transduction and activators of transcription,STAT)蛋白家族是一类能将信号从细胞外传导至细胞核内,进而引起相应的靶基因转录的胞浆蛋白[1-3]。STAT3是STAT蛋白家族7个成员(STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B和STAT6)之一,能够参与细胞增殖、分化和凋亡,调节血管生成等生物活动,具有多种重要的生物功能[4-7]。STAT3 的信号通路主要有表皮生长因子受体(epidermal growth factor receptor,EGFR)信号传导通路、IL-6介导的JAK-STAT3途径和SRC基因介导的信号传导途径。当细胞因子(如IL-6)或生长因子(如EGFR)等识别激活受体后,受体复合物募集STAT3,STAT3磷酸化、二聚化及核易位,与相应靶基因结合,调节靶基因的表达[2,8-9]。研究表明,在皮肤癌[10]、肺癌[11]等多种癌细胞中存在STAT3异常表达和持续激活的现象,但在正常组织细胞中STAT3瞬时激活,且受到严格调控[2,12]。此外,STAT3的过度激活还能产生免疫抑制作用,因此,阻断STAT3的异常活化不仅能抑制肿瘤细胞的恶性增殖,还可增强机体的免疫能力[13-14]。所以,STAT3作为研究抗肿瘤药物的热门靶点之一,受到广泛的关注。
目前,STAT3抑制剂主要分为肽类、拟肽类及非肽类小分子抑制剂。虽然肽类和拟肽类STAT3抑制剂具有较高的活性,但存在透过细胞膜较困难,在体内肽键容易代谢,生物利用度较低等问题,因此,STAT3小分子抑制剂的发现成为一大热点[1-2,15-16]。但是市场上尚没有经FDA批准的用于癌症临床治疗的STAT3小分子抑制剂。因此,开发活性较强,不良反应小,安全性高,类药性好的STAT3小分子抑制剂具有重要的意义。
STAT3小分子抑制剂S3I-V4-01是通过计算机模拟筛选获得的[17-18],对STAT3具有一定选择性,能够有效抑制STAT3的二聚化及磷酸化,对人乳腺癌细胞MDA-MB-231、胰腺癌细胞Panc-1及前列腺癌细胞DU145仅具有适度的抗增殖作用,IC50分别为(82.4±1.4)μmol/L、 (197.6±2.1)μmol/L和 (75.4±3.4)μmol/L。本研究通过对STAT3小分子抑制剂S3I-V4-01进行结构修饰,以提高其对肿瘤细胞的抗增殖活性,设计思路如图1所示,合成了2个系列化合物,分别为Z和H系列化合物,并初步探索了目标化合物的生物活性。

图1 目标化合物Z系列及H系列
1 材料和方法
1.1 化学合成
1.1.1 仪器与试剂:若无特殊说明,普通化学试剂均为分析纯,购自上海晶纯化学品有限公司,无需进一步纯化即可使用。薄层色谱硅胶板购自六安良臣硅源材料有限公司。柱层析硅胶采用青岛海洋化工厂的薄层层析硅胶(200~300目)。UPLC-MS分析在Bruker Esquire HCT系统上测定。1H NMR和13C NMR实验在25 ℃下用Bruker JEOL-AL-300FT核磁共振仪采集,以残留溶剂峰作为内标。
1.1.2 中间体Z1、H1的合成:将2-氨基-6-氯-9H-嘌呤(1 mmol)和相应的酰氯(1.5 mmol)反应,以吡啶(12 mL)为溶剂,用薄层色谱法(thin layer chromatography,TLC)监测反应进程,常温搅拌过夜。待原料反应后,静置,减压抽滤,干燥滤渣并称重,得到相应的中间体[19]。
2-环己基酰胺-6-氯-9H-嘌呤(Z1):白色固体,产率为82%;ESI-MS[M+H]+:280.1;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.988(s,1H,9-purine-H),9.989(s,1H,CONH),8.558(s,1H,8-purine-H),2.173-2.115(m,1H,cyclohexyl),7.400(m,10H,cyclohexyl);13C NMR(150 MHz,DMSO-d6)δ(ppm):171.138,152.231,151.436,149.442,143.554,127.421,42.217,28.997,22.868.
2-(3-甲基苯甲酰胺)-6-9H-嘌呤(H1):白色固 体,产率为89%;ESI-MS[M+H]+:288.2;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.879(s,1H,9-purine-H),9.847(s,1H,CONH),8.644(s,1H,8-purine-H),8.423~8.356(m,2H,Ph-H),7.221~7.216(m,2H,Ph-H),2.331(s,3H,-CH3);13C NMR(150 MHz,DMSO-d6)δ(ppm):166.004,152.115,151.428,149.538,143.883,138.012,134.101,128.330,124.441,21.217.
1.1.3 目标化合物Z2-Z5及H2-H5的合成:将2-环己基酰胺-6-氯-9H-嘌呤(Z1,1.0 mmol),2-(3-甲基苯甲酰胺)-6-氯-9H-嘌呤(H1,1.0 mmol)分别与相应的苄胺(1.5 mmol)反应,以三乙胺(1.5 mmol)为催化剂,正丁醇(10 mL)为溶剂,120 ℃加热回流 3 h,用TLC监测反应进程。待原料反应后,冷却静置,减压抽滤,并用正丁醇洗涤2次,干燥滤渣并称重,得到相应的产物[20]。
2-环己基酰胺-6-(3-甲氧基苄基)-9H-嘌呤(Z2):白色固体,产率48.4%;ESI-MS[M+H]+:381.2;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.974(s,1H,9-purine-H),10.321(s,1H,CONH),9.687(s,1H,8-purine-H),7.214~7.188(m,1H,Ph-H),7.106~6.947(m,1H,Ph-H),6.803~6.769(m,1H,Ph-H),6.705~6.691(m,1H,Ph-H),4.663(d,J=3.000 Hz,2H,-CH2),3.720(s,3H,-OCH3),3.706(s,1H,-NH),2.382(s,1H,cyclohexyl),1.812~1.600(m,4H,cyclohexyl),1.383~1.322(m,4H,cyclohexyl),1.222~1.022(m,2H,cyclohexyl);13C NMR(150 MHz,DMSO-d6)δ(ppm):170.124,168.127,158.268,156.263,155.005,139.516,139.234,135.234,129.452,128.511,115.416,114.331,44.983,43.567,29.785,28.567,27.456,26.786,20.251.
2-环己基酰胺-6-(2-甲氧基苄胺)-9H-嘌呤(Z3):白色固体,产率53.4%;ESI-MS[M+H]+:381.3;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.984(s,1H,9-purine-H),9.580(s,1H,CONH),7.924(s,1H,8-purine-H),7.391~7.380(m,1H,Ph-H),7.300~7.274(m,1H,Ph-H),7.245~7.191(m,1H,Ph-H),7.166~7.140(m,1H,Ph-H),4.744(d,J=3.000 Hz,2H,-CH2),3.620(s,3H,-OCH3),3.606(s,1H,-NH),2.352(s,1H,cyclohexyl),1.764~1.744(m,4H,cyclohexyl),1.683~1.663(m,4H,cyclohexyl),1.612~1.597(m,2H,cyclohexyl);13C NMR(150 MHz,DMSO-d6)δ(ppm):172.124,169.127,158.2134,157.263,156.005,139.346,139.454,135.267,129.432,128.531,115.445,114.321,44.945,43.567,29.756,28.437,27.456,20.231。
2-环己基酰胺-6-苄胺-9H-嘌呤(Z4):白色固体,产率43.1%;ESI-MS[M+H]+:351.3;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.983(s,1H,9-purine-H),9.589(s,1H,CONH),7.759(s,1H,8-purine-H),7.462~7.424(m,2H,Ph-H),7.400(t,1H,J=5.400 Hz,Ph-H),7.392~7.322(m,2H,Ph-H),4.644(d,J=3.000 Hz,2H,-CH2),3.626(s,1H,-NH),2.362(s,1H,cyclohexyl),1.664~1.644(m,4H,cyclohexyl),1.653~1.643(m,4H,cyclohexyl),1.630~1.598(m,2H,cyclohexyl);13C NMR(150 MHz,DMSO-d6)δ(ppm):171.124,169.135,158.219,157.573,156.009,139.365,139.497,135.287,129.457,128.558,115.475,114.576,44.967,43.538,29.756,28.447,27.456,26.466。
2-环己基酰胺-6-(2-氯苄胺)-9H-嘌呤(Z5):白色固体,产率87.5%;ESI-MS[M+H]+:385.3;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.934(s,1H,9-purine-H),9.570(s,1H,CONH),7.934(s,1H,8-purine-H),7.730~7.632(m,1H,Ph-H),7.434~7.384(m,1H,Ph-H),7.271~7.242(m,1H,Ph-H),7.203~7.178(m,1H,Ph-H),4.744(d,J= 3.000 Hz,2H,-CH2),3.360(s,1H,-NH),2.346(s,1H,cyclohexyl),1.774~1.764(m,4H,cyclohexyl),1.684~1.673(m,4H,cyclohexyl),1.614~1.597(m,2H,cyclohexyl);13C NMR(150 MHz,DMSO-d6)δ(ppm):171.124,169.157,158.214,157.263,156.005,139.346,139.454,135.267,129.432,129.531,115.445,114.321,44.945,29.756,28.437,26.466,20.231。
2-(3-甲基苯甲酰胺)-6-(3-甲氧基苄胺)-9H-嘌呤(H2):白色固体,产率44.2%;ESI-MS[M+H]+:389.4;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.985(s,1H,9-purine-H),9.621(s,1H,CONH),7.723(s,1H,8-purine-H),7.767~7.650(m,3H,Ph-H),7.347~7.340(m,1H,Ph-H),7.204~7.178(m,2H,Ph-H),7.017~6.953(m,1H,Ph-H),6.771~6.754(m,1H,Ph-H),4.630(d,J=2.400 Hz,2H,-CH2),4.510(s,3H,-OCH3),3.839(s,1H,-NH),2.366(s,3H,-CH3);13C NMR(150 MHz,DMSO-d6)δ(ppm):168.365,166.367,156.237,154.243,154.051,139.546,139.456,135.146,129.847,128.343,119.567,115.446,44.963,19.552,10.324。
2-(3-甲基苯甲酰胺)-6-(2-甲氧基苄胺)-9H-嘌呤(H3):白色固体,产率43.4%;ESI-MS[M+H]+:389.2;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.885(s,1H,9-purine-H),10.202(s,1H,CONH),8.899(s,1H,8-purine-H),7.726~7.720(m,1H,Ph-H),7.523~7.445(m,1H,Ph-H),7.347~7.324(m,1H,Ph-H),7.263~7.211(m,1H,Ph-H),6.980~6.957(m,1H,Ph-H),6.873~6.849(m,1H,Ph-H),6.823~6.800(m,2H,Ph-H),4.375(d,J=2.400 Hz,2H,-CH2),3.824(s,3H,-OCH3),3.814(s,1H,-NH),2.355(s,3H,-CH3);13C NMR(150 MHz,DMSO-d6)δ(ppm):168.375,166.335,156.262,154.256,154.151,139.546,139.456,135.146,130.847,128.343,119.567,116.446,44.963,19.552,12.324.
2-(3-甲基苯甲酰胺)-6-苄胺-9H-嘌呤(H4):白色固体,产率43.3%;ESI-MS[M+H]+:359.3;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.096(s,1H,9-purine-H),10.207(s,1H,CONH),8.115(s,1H,8-purine-H),7.747~7.704(m,1H,Ph-H),7.407~7.394(m,2H,Ph-H),7.360~7.351(m,3H,Ph-H),7.301~7.276(m,1H,Ph-H),7.218~7.193(m,2H,Ph-H),4.707(d,J=3.000 Hz,2H,-CH2),3.383(s,1H,-NH),2.356(s,3H,-CH3);13C NMR(150 MHz,DMSO-d6)δ(ppm):169.134,167.235,156.245,155.236,154.041,139.536,137.414,135.146,129.838,128.365,119.487,115.356,44.963,19.552。
2-(3-甲基苯甲酰胺)-6-(2-氯苄胺)-9H-嘌呤(H5):白色固体,产率46.3%;ESI-MS[M+H]+:393.2;1H NMR(600 MHz,DMSO-d6)δ(ppm):12.844(s,1H,9-purine-H),9.552(s,1H,CONH),8.560(s,1H,8-purine-H),7.962~7.605(m,2H,Ph-H),7.446~ 7.430(m,2H,Ph-H),7.374~7.359(m,2H,Ph-H),7.165~7.150(m,2H,Ph-H),5.319(d,J=2.400 Hz,2H,-CH2),3.337(t,J=6.000 Hz,1H,-NH),1.337(s,3H,-CH3);13C NMR(150 MHz,DMSO-d6)δ(ppm):168.746,166.169,156.195,154.246,153.656,138.585,138.254,134.164,129.852,129.381,119.467,115.389,44.983,19.538。
1.2 生物活性研究
1.2.1 材料与仪器:人表皮鳞癌细胞A431、人非小细胞肺癌细胞A549购自中国科学院上海生命科学研究院细胞资源中心;RPMI-1640、DMEM培养液、胰蛋白酶、1%青霉素和链霉素、胎牛血清购于美国Gibco 公司;转染试剂X-tremeGENE HP DNA Transfection Reagent购自德国Roche公司;pSTAT3-Luc(Cat# LR0077)购自美国Panomics公司;双荧光素酶报告系统试剂盒Dual-Luciferase Reporter Assay System购自威格拉斯生物技术(北京)有限公司。所用仪器主要有CO2培养箱、TGL-16G型台式离心机购自上海医疗器械有限公司;正置、倒置荧光显微镜购自日本尼康公司;酶联免疫检测仪购自美谷分子仪器(上海)有限公司。
1.2.2 细胞培养:A431细胞在含有10%胎牛血清的DMEM培养基中培养,A549细胞在含有10%胎牛血清的RPMI-1640培养基中培养,常规置于37 ℃,5% CO2的培养箱内孵育。当细胞融合到80%左右时可传代。
1.2.3 荧光素酶报告基因法检测p-STAT3实验[21]:将细胞A431以每孔2×104个细胞的密度接种于96孔板中,并加入含有10%胎牛血清的DMEM培养基,使用之前报道的方法在接种后4 h进行瞬时转染[21]。 每孔转染的DNA(包括pSTAT3-Luc和内部对照载体海肾)的量为0.5 μg。转染6 h后,将成功转染的细胞用10 μmol/L的S31-V4-01或待测目标化合物处理24 h,然后使用双荧光素酶报告基因试剂盒在酶标 仪上测定活性。相对荧光素酶活力单位(relative luciferase units,RLU)是萤火虫荧光素酶的绝对活性与海肾荧光素酶的绝对活性的比值。进行3次独立实验以获得平均值。
1.2.4 目标化合物对肿瘤细胞的抗增殖实验:采用MTT法[22]对人表皮鳞癌细胞A431、人非小细胞肺癌细胞A549进行抗肿瘤细胞增殖实验。体外培养A431、A549 细胞至对数生长期后,收集细胞,1 000 r/min离心5 min,弃上清,用适量培养基悬浮,将细胞悬液接种到96 孔细胞培养板中,使细胞为8×103个/孔,并放置细胞培养箱(37 ℃,5% CO2)中培养。培养48 h后,每孔加入用DMSO溶解的终浓度为10 μmol/L的各待测化合物,每个化合物设6个复孔。设1组阳性对照孔,2组阴性对照孔。给药48 h后,每孔中加入20 μL用PBS配制的MTT溶液(5 mg/mL),继续在细胞培养箱(37 ℃,5% CO2)中培养4 h。从培养箱中移出96孔板,弃去孔中的溶液,每孔加入150 μL的DMSO溶液,并于摇床上摇匀10 min;最后在酶标仪上检测紫外吸收波长在490 m处的吸光值,根据公式计算出相应的细胞抑制率。本实验进行至少重复3次以减少实验误差。
1.3 统计学处理方法 采用SPSS25.0软件进行统计学分析。计量资料以±s表示,多组间比较用单因素方差分析,组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 目标化合物的合成 本研究共8个目标化合物的合成路线及结构如图2所示,以2-氨基-6-氯-9H-嘌呤为起始原料,分别与环己酰氯、3-甲基苯甲酰氯反应,吡啶为溶剂,室温下搅拌过夜,TLC监测反应结束后,静置抽滤,干燥滤渣,得中间体Z1、H1;Z1、H1以三乙胺为缚酸剂,正丁醇为溶剂,与相应苄胺在加热回流条件下反应3 h,反应结束后,冷却静置,将正丁醇减压抽滤,并用正丁醇洗涤2次,干燥滤渣,得目标产物。
2.2 目标化合物对STAT3信号转导通路的影响 利用荧光素酶报告基因法检测化合物对STAT3信号转导通路的影响。在用pSTAT3-Luc载体瞬时转染后,测定A431细胞中的STAT3启动子活性。目标化合物对STAT3信号转导通路的活性结果如图3所示,用 10 μmol/L目标化合物和阳性对照S3I-V4-01处理后,能抑制A431细胞中的STAT3启动子活性,其中化合物H2、H4与S3I-V4-01的效果相当,化合物H3的抑制程度较S3I-V4-01更强,其抑制率约为58%。
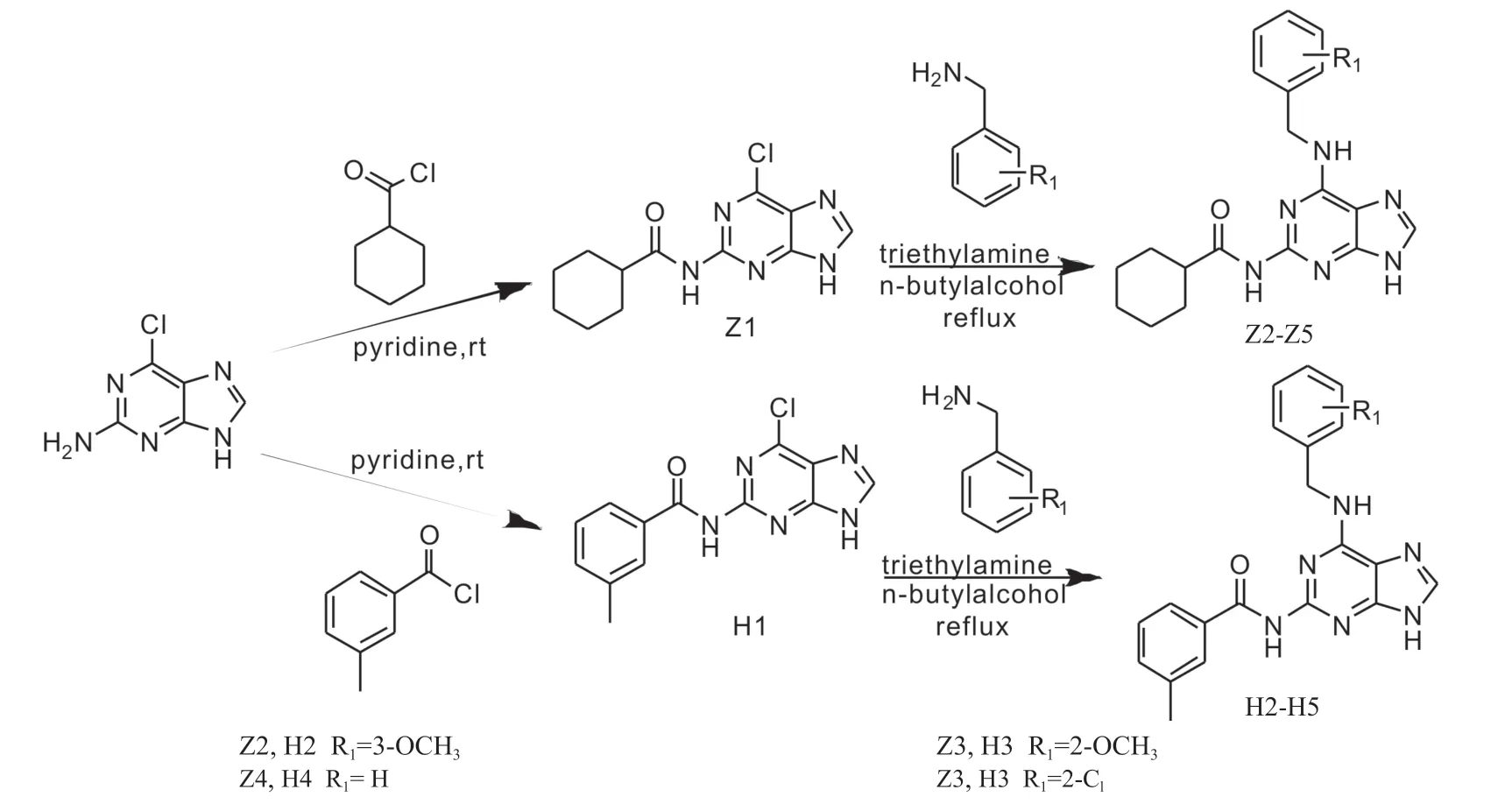
图2 目标化合物Z2-5、H2-5的合成路线及结构

图3 目标化合物对STAT3信号转导通路的影响
2.3 目标化合物对肿瘤细胞增殖的影响 人表皮鳞癌细胞A431[23]、人非小细胞肺癌细胞A549[24]中存在STAT3过度激活的情况,因此本实验选择在这2种细胞系上检测目标化合物对肿瘤细胞增殖的影响。在人表皮鳞癌细胞A431中,大部分目标化合物的抑制率超过50%,其中有3个目标化合物的抑制率与阳性对照S3I-V4-01相当,分别为Z3、Z4及H4;化合物H2和H3的抑制效果优于S3I-V4-01;H系列化合物的抗增殖作用总体比Z系列强(见图4A)。在人非小细胞肺癌细胞A549中,大部分目标化合物的抑制效果较差,但是化合物H3的抑制率仍略高于阳性对照S3I-V4-01,且对A431细胞也有较理想的抑制作用(见图4B)。通过对A431细胞抗增殖作用的初步构效关系研究发现:①分别比较化合物Z4与Z5,H4与H5,氯原子的引入不会明显改善化合物的抗增殖作用;②苄基苯环上的邻位取代比间位取代的抗增殖效果更佳,如化合物Z2与Z3,H2与H3;③嘌呤6位氨基上的间甲基苯环取代化合物抑制细胞增殖作用比环己烷取代化合物强,如Z5和H5。
3 讨论
STAT3是EGFR、IL-6/JAK及SRC等多个致癌性酪氨酸激酶信号通路的汇聚焦点,在多种肿瘤组织和器官中都过表达[25-26]。STAT3的持续激活是肿瘤形成和发展所必需的,STAT3的异常磷酸化不仅能破坏机体的正常免疫功能,增强肿瘤的免疫逃逸能力,还可以阻碍正常的炎症反应,从而形成利于肿瘤发生发展的肿瘤微环境[27],因此,STAT3小分子抑制剂的研究对于肿瘤治疗具有重要意义。
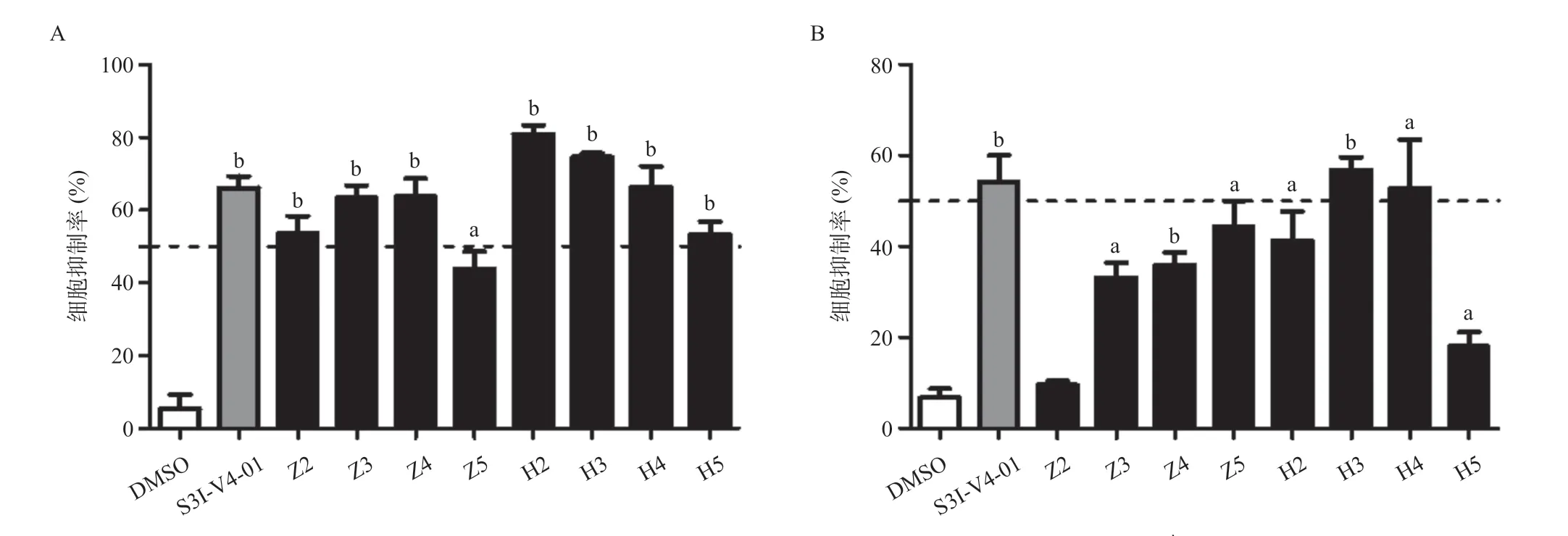
图4 目标化合物抑制肿瘤细胞增殖作用
本研究对已报道的STAT3 小分子抑制剂S3IV4-01进行结构改造,合成了Z系列和H系列两类共8个目标化合物,并在体外对其进行初步的生物活性探索实验。为验证目标化合物是否为STAT3靶向抑制剂,运用荧光素酶报告基因法检测其对STAT3信号转导通路的影响,结果表明在10 μmol/L浓度下,化合物H2、H4与S3I-V4-01的效果相当,化合物H3抑制作用最强且优于S3I-V4-01。由于肿瘤细胞的增殖能力在肿瘤研究过程中至关重要,本研究采用MTT实验检测目标化合物对STAT3过表达的肿瘤细胞A431和A549的抗增殖能力,结果表明目标化合物对A431细胞的抑制作用比A549更佳,化合物H4抗肿瘤细胞增殖能力与S3I-V4-01相当,化合物H3对A431和A549的抑制效果最优均强于阳性对照S3I-V4-01。最佳化合物H3对STAT3信号转导通路的阻滞效果最优,抗细胞增殖作用最强,化合物抗肿瘤活性的趋势和对STAT3抑制相一致,说明化合物的靶向选择性较好。
综上所述,通过对STAT3小分子抑制剂S3I-V4- 01的合理改造,合成并筛选出了抗肿瘤细胞增殖活性更强,且能阻断STAT3信号转导通路的化合物H3,后续的结构修饰可在H3上进行以提高抗肿瘤活性。
