I群禽腺病毒的分离鉴定与同源性分析
2019-02-22矫海婷刘德萍宋翠萍李东阳任慧英吴延功
矫海婷,张 灿,刘德萍,宋翠萍,李东阳,任慧英,吴延功
(1. 青岛农业大学,山东青岛 266109;2. 中国动物卫生与流行病学中心,山东青岛 266032;3. 荣成市城西畜牧兽医站,山东荣成 264300)
I群禽腺病毒(FAdV-I)最早于1963年在美国首次被报道,可广泛感染家禽和野禽。2013年,我国开始报道在鸡群中发现该病毒。2015年该病毒在山东、河南、江苏、河北以及东北等地区流行,感染家禽主要表现为心包积液和肝脏肿大,又称“心包积液-肝炎综合征”。近年来,该病毒在我国各地鸡群中的流行状况日益严重,导致鸡群死淘率升高,造成严重经济损失[1-2]。FAdV-I根据限制性酶切图谱分为A、B、C、D、E 5个种,根据血清交叉中和反应又分为12个血清型[3]。FAdV-I属于腺病毒A型,在我国流行的血清型主要为4、8和11型[4-6]。PCR 技术现已广泛应用于动物传染病诊断。目前已经报道了基于六邻体蛋白(Hexon)、DNA 聚合酶等基因建立的FAdV-I各血清型PCR诊断方法[8-10]。Hexon位于FAdV-I病毒粒子表面,是主要的中和抗原和保护性抗原,与病毒的分型和致病性密切相关,通常用于FAdV-I的诊断和疫苗研发[7]。本试验主要针对山东、吉林、黑龙江等地的发病禽类进行FAdV-I分离,针对Hexon基因进行PCR鉴定,并对分离到的FAdV-I毒株进行分子流行病学分析,从分子水平了解当前FAdV-I的流行特征,以期为该病毒防控和疫苗研发提供理论基础。
1 材料与方法
1.1 病料、鸡胚及细胞株
疑似FAdV-I感染的病死鸡病料(76份):取自山东、吉林、黑龙江等地的病死鸡;SPF鸡胚:来自青岛康信孵化场;鸡肝癌细胞(LMH)(货号BNCC337930):购自北纳创联生物技术有限公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank公布的Hexon基因序列(MG734665.1)设计FAdV-I特异性引物,送青岛华大基因研究所合成。序列如下:FAdV-I-F: GGTCGACCTATTTCGACATCAAG;FAdV-I-R:CAGCTCGACCACCACGTTCATG。预期扩增的目的条带大小为742 bp。
1.2.2 病料处理 剖解疑似发病鸡,采集肝脏病料样品,加入5倍体积的无菌PBS;将肝脏病料研磨成匀浆,反复冻融3次,4 000 r/min离心5 min,取上清,经0.22 μm无菌滤器过滤,将滤液保存备用。
1.2.3 病毒DNA提取 取50~100 mg肝脏病料,剪碎后加入500 μL 10% 的SDS和8 μL蛋白酶K,55 ℃水浴6 h;取上清,分别加入400 μL氯仿和平衡酚抽提,振荡15 s,4 ℃条件下12 000 r/min离心20 min;取上清重复抽提2~3次,直至上清液清晰透明;取上清,加入2倍体积的无水乙醇混匀,-20 ℃ 条件下静置 30~60 min,4 ℃条件下12 000 r/min离心15 min,弃上清;在沉淀中加入75%的无水乙醇,轻轻混匀,4 ℃ 12 000 r/min,离心10 min,弃上清;将沉淀重复洗2次,弃上清,稍晾干,加入ddH2O 30 μL重溶,4 ℃保存备用。
1.2.4 病毒PCR检测 以提取的病毒DNA为模板、FAdV-I-F/FAdV-I-R为引物进行PCR扩增,反应体系及反应条件见表1。PCR反应条件:对扩增的PCR产物进行1%琼脂糖凝胶电泳,凝胶成像仪下察看电泳结果,将扩增得到的PCR产物送青岛华大基因研究所测序,对测序结果与NCBI网站GenBank数据库进行同源性比对分析。
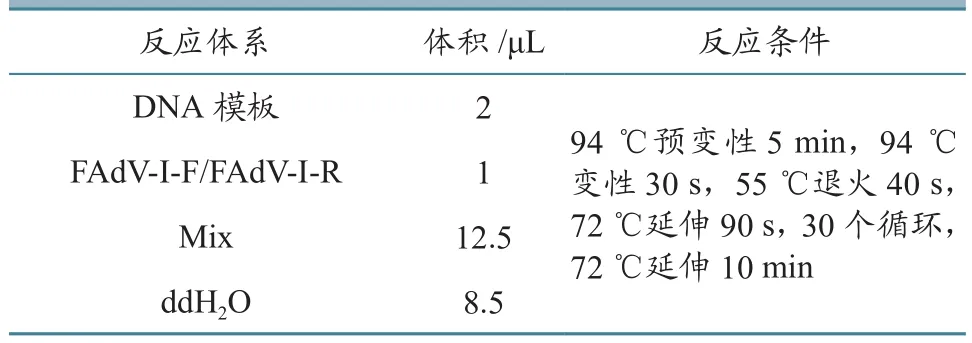
表1 PCR反应体系及反应条件
1.2.5 病毒分离与传代 将PCR检测阳性的病死鸡肝脏病料无菌条件下制备组织匀浆,反复冻融3次,4 000 r/min离心15 min;0.22 μm滤器过滤,取0.2 mL滤液接种9~11 d的SPF鸡胚尿囊腔,每个样品接种5枚;同时设接种生理盐水对照组。将接种鸡胚在37 ℃培养箱孵育,每天照蛋2次,观察鸡胚死亡情况;弃去24 h内死亡的鸡胚,收集24~96 h死亡的鸡胚尿囊液,盲传3代;将未致死鸡胚在5 ℃条件下静置4 h以上,收集尿囊液。将收集的尿囊液和肝组织匀浆用0.22 μm滤器过滤除菌,分别接种生长至80%~90%的鸡肝癌细胞(LMH),于5% CO2培养箱中37 ℃孵育1~2 h,然后加入含有2%胎牛血清和1%双抗的细胞培养液,72 h内观察细胞病变,收集病毒,-80 ℃冰箱保存。
2 结果与分析
2.1 病毒分离及鉴定
病死鸡病理剖检主要表现为心包积液,肝脏肿大,有出血点或出血斑等病理变化,初步推测为FAdV-I感染(图1)。从76份病料中分别提取总DNA,以FAdV-I-F/FAdV-I-R为引物进行PCR扩增。1%琼脂糖凝胶电泳结果显示,有10份样品经PCR扩增得到了742 bp大小的目的条带,与预期片段大小相同(图2),FAdV-I阳性检出率为13%。
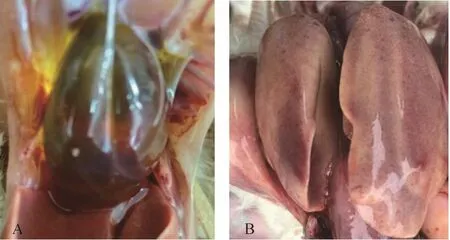
图1 病死鸡病理剖检病变
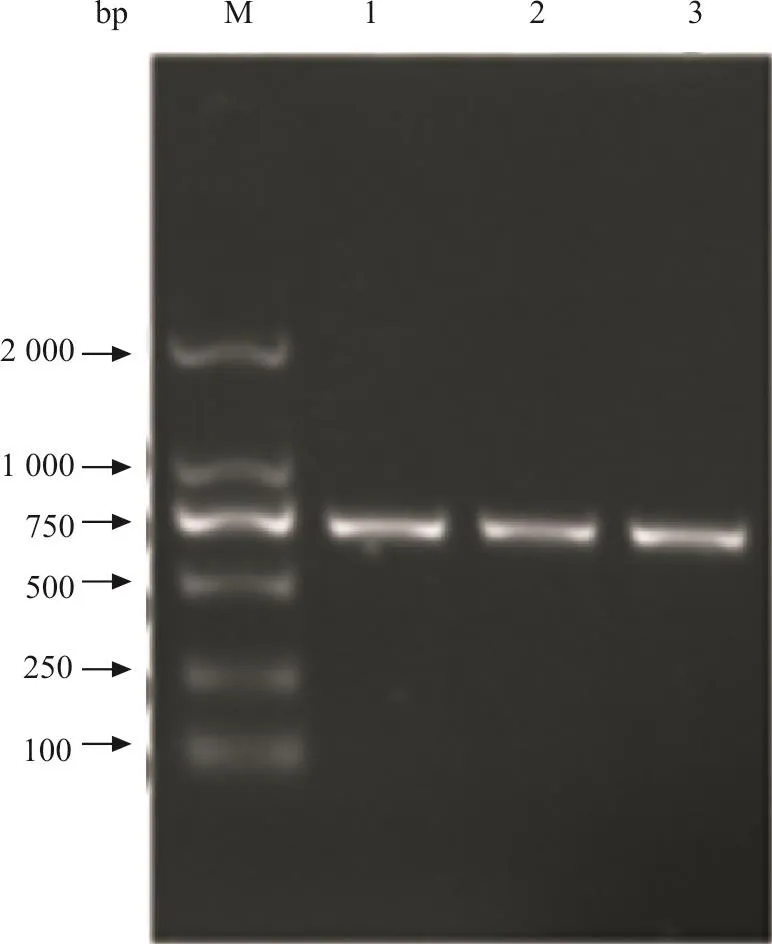
图2 FAdV-I PCR扩增结果
2.2 病毒分离株序列分析
样品的PCR鉴定结果显示,扩增得到的10个目的片段均为FAdV-I的Hexon基因片段,因此确定10份病料样品中含有FAdV-I。根据病料来源及送检时间,分别将毒株命名为SDWF170315、SDQD161224、SD161115、SDWF170706、SD170728、SDBZ170314、LN170514、LN170531、HLJ170728、SDWF171208。
将10株FAdV-I序列提交到GenBank数据库进行同源性比对,发现这10株FAdV-I的血清型可分为4种:SDWF171208为血清4型,与厄瓜多尔来源毒株同源性最高;SDWF170706、SD170728、HLJ170728、LN170514、LN17053、SDBZ170314为血清8b型,与秘鲁、厄瓜多尔、韩国、匈牙利等国家毒株的同源性最高;SD161115为血清型9型,与我国湖北省分离到的毒株同源性最高;SDWF170315、SDQD161224为血清11型,分别与沙特阿拉伯、美国毒株的同源性最高(图3)。
2.3 病毒分离与传代
2.3.1 鸡胚病毒培养 利用鸡胚接种尿囊腔,共分离到10株FAdV-I。将分离到的毒株分别在鸡胚上盲传3代,发现鸡胚在72 h内均死亡,死亡鸡胚主要表现为皮下、背部出血,肝脏肿大、出血。与正常鸡胚相比,死胚胚体明显小于正常鸡胚,说明病毒影响了鸡胚的生长发育。
2.3.2 细胞病毒培养 将分离到的10株FAdV-I接种生长至70%~90% 的LMH细胞,发现72 h左右即产生了明显的细胞病变。正常的细胞形态呈扁圆铺路石状(图4-A),而病变细胞变大、变圆,集聚成不规则的葡萄串似的串珠状,细胞间隙增大,最终致细胞崩解(图4-B)。
3 讨论
近年来,FAdV-I在我国各地广泛流行,严重危害养禽业。本试验从山东、吉林、黑龙江等地送检的病料中分离FAdV-I并进行PCR鉴定,可以了解这些地区的FAdV-I流行现状。
FAdV-I在鸡胚尿囊腔和LMH细胞系上生长良好。病毒接种鸡胚后,在鸡胚不同部位的滴度各不相同。本试验发现卵黄囊中的病毒滴度最高。另外,鸡胚接毒的前几代收毒后,用PCR方法检测不到病毒,继续盲传后,才能获得阳性结果。分析其原因可能是病毒在鸡胚或细胞系上培养需要一个传代适应过程。LMH细胞系具备比鸡胚原代肝细胞更强的增殖能力,目前已成功用于FAdV-I多个血清型毒株的培养和增殖[11]。本试验发现,部分病料同时接种鸡胚和LMH细胞系,结果在LMH细胞中未观察到病变,而鸡胚却被致死;随后将鸡胚中收集的病毒继续接种LMH细胞,发现细胞产生病变,因而推测鸡胚更有利用于病毒的分离和传代。

图3 FAdV-I分离株同源性分析结果
FAdV-I包括12种血清型,不同血清型毒株引起的临床症状和病理变化存在差异,其中1、2、4和8型均能引起心包积液-肝炎综合征。牛登云等[12]报道2014—2016年我国鸡群中普遍存在腺病毒感染,且引起死淘率升高,临床上主要以4型和8型为主。4型主要引起心包积液,而8b型主要引起包涵体肝炎。尹燕博[13]对 2007—2017年我国主要养殖区流行的禽腺病毒进行检测,发现主要血清型依次为11、4和8型,且常与鸡传染性贫血病病毒混合感染。本试验从76份病料中共分离到10株FAdV-I, 其中 6株 为 8b型,2株为11型,另2株分别为4和9型,提示山东、吉林、黑龙江等地流行的FAdV-I以8b型为主。FAdV-I在2014年之前主要以11型流行为主,2014年之后,蛋鸡中流行的以4型为主,肉鸡中流行的仍以11型为主,2017年之后8型检出率明显升高[13]。本试验通过分离毒株的血清型鉴定,也证实了当前FAdV-I的流行血清型在分离地区已经转变为以8型为主。当前腺病毒感染的防控主要以免疫血清4型灭活疫苗为主。鉴于不同血清型不能提供完全的交叉保护,当鸡群中流行的FAdV-I血清型发生转变后,往往导致免疫失败。本次从山东、吉林、黑龙江等地分离到的FAdV-I毒株中,8b血清型占到60%,暗示着当前的4型灭活疫苗不能有效防控该病。这应引起养禽业足够的重视,需制备相应血清型疫苗。
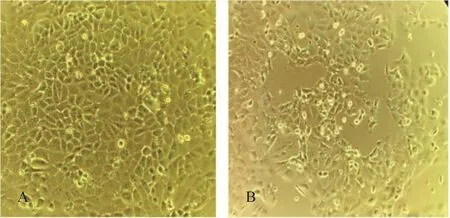
图4 FAdV-I培养在LMH细胞系(10×)
4 结论
本研究对山东、黑龙江、吉林等地规模养鸡场的76份疑似FAdV-I感染病料,进行病毒分离、PCR鉴定及同源性分析,结果从上述地区样品中均分离到病毒,共计10株,分离率为13%;鉴定出4种血清型,其中血清8b型6株,占比60%。这说明山东、黑龙江、吉林等地均存在一定的FAdV-I流行,优势血清型转变为8b型,因此需制备相应的血清型疫苗来有效防控这些地区AdV-I流行。
