洛克沙胂完全抗原的制备及其单克隆抗体的研制
2019-02-22刘红亮王奇奇张改平祁艳华周景明刘燕凯马丽萍王爱萍
刘红亮,王奇奇,张改平,祁艳华,周景明,刘燕凯,马丽萍,王爱萍
(郑州大学生命科学学院,河南郑州 450000)
洛克沙胂(Roxarsone,ROX),化学名为3-硝基-4-羟基苯胂酸,是一种人工合成的有机砷化物,也是在世界范围内应用非常广泛的一种饲料添加剂[1],在提高饲料转化率、促进动物生长、增加体质量等方面具有重要作用[2],同时还有抗菌、抗球虫作用[3]。有人认为,As3+、As5+在动物体内同时存在时可以相互转化[4],起着氧化剂和还原剂的双重作用,从而影响机体的物质代谢。ROX大量使用后会被动物机体吸收,可蓄积在动物的肝脏、肾脏、脾脏以及骨骼中,导致细胞代谢紊乱,使动物中枢神经系统失调,并随着人类对畜产品的摄入进入人体内,最终对人体健康造成严重危害[5]。如果一些含砷的畜禽排泄物进入环境,也会对环境(水、土壤)造成巨大污染[6]。鉴于以上危害,我国农业农村部2018年发布公告[7],禁止在食品动物中使用ROX。因此,建立有效的ROX检测方法十分必要。
目前最常用的ROX检测方法是高效液相色谱法[8]、气相色谱法[9]、高效液相色谱-氢化物发生-原子荧光联用法[10]等。但这些方法对仪器设备和样品的前处理要求较高,不适合对样品的大批量快速检测[11]。而免疫分析法对样品要求低,且灵敏度高[12]、特异性强[13-14]。已有研究人员制备了针对ROX的多抗,并且建立了检测方法[15]。但多克隆抗体批间差异较大,非特异性反应强,并且稳定性较差[16]。而单克隆抗体可以克服以上缺点,但单抗的研制是建立免疫分析法的关键,因此抗ROX单克隆抗体研制十分必要。
1 材料与方法
1.1 仪器
分光光度计:美国Thermo fisher公司产品;高速冷冻离心机:德国Eppendorf公司产品;磁力搅拌器:德国IKA公司产品;Gel DocTMXR+凝胶成像系统:美国Bio-Rad公司产品。
1.2 试剂
洛克沙胂(ROX,纯度≥97.9%):德国Dr.Ehrenstorfer标准品;3-氨基-4羟基苯胂酸(HAPA)、碳二亚胺(EDC):国药集团化学试剂有限公司产品;N-羟基琥珀酰亚胺(NHS)、牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA)、胎牛血清:美国Sigma公司产品。
1.3 实验动物
6~8周龄BALB/c雌性小鼠:本实验室饲养。
1.4 人工抗原合成与鉴定
1.4.1 半抗原设计 HAPA与半抗原ROX的结构类似,与ROX相比,HAPA 苯环上第3位碳原子的化学基团由亚硝基变为氨基(图1)。亚硝基需要经改造生成氨基后才能与蛋白质进行偶联,而与亚硝基相比,氨基可直接与BSA和OVA上的羧基反应,因此最终选择HAPA作为半抗原分子与BSA偶联,合成完全抗原。
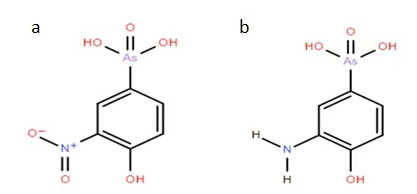
图1 HAPA和ROX的结构式
1.4.2 碳二亚胺法(EDC)法合成完全抗原及鉴定称取20 mg BSA、55 mg EDC、33 mg NHS,充分溶解于2 mL PBS中,4 ℃条件下避光搅拌6 h,得到反应液A;称取10 mg HAPA,加入到3 mL的PBS中,滴加的同时进行搅拌,使其充分溶解,得到反应液B;将B液逐滴加入到A液中,4 ℃搅拌过夜;4 ℃条件下用PBS透析3 d,离心弃去沉淀,上清即为免疫原HAPABSA。包被原HAPA-OVA的合成方法同上。分别采用SDS-PAGE和紫外分光光度法对合成的完全抗原进行鉴定。
1.5 免疫BALB/c小鼠及免疫效果评价
取 3只 6~8周 龄 雌 性 BALB/c小 鼠, 用HAPA-BSA免疫(20 μg/只)。首次免疫时将HAPA-BSA与等体积的弗氏完全佐剂混合,并用手持均质机乳化后,对小鼠进行多点皮下注射;首次免疫后第3周进行第2次免疫,此后每隔2周将免疫原与弗氏不完全佐剂等体积混合乳化后对小鼠进行免疫;第4次免疫后1周,腹腔注射2倍皮下免疫剂量的完全抗原,进行加强免疫。
以HAPA-OVA为检测原,在第4次免疫后1周断尾取血,用间接ELISA法测定免疫血清效价、间接竞争ELISA测敏感性。
间接ELISA法测定血清效价:HAPA-OVA包被浓度为2.0 ng/μL,以断尾采血的不同稀释度血清为第一抗体,HRP标记的羊抗小鼠抗体为第二抗体,未免疫小鼠血清为阴性对照。间接竞争ELISA测定敏感性:方法同上,但在加入50 μL一定稀释度的血清之前,预先在孔内加入50 μL浓度 分别为 1 000、500、250、125、62.5、31.25、15.5、7.75、3.9、2.0 ng/μL 的 ROX 标准液。
1.6 细胞融合及亚克隆筛选阳性单克隆细胞株
加强免疫3 d后,对小鼠眼球采血并将其脱颈处死,取脾脏进行细胞融合。将骨髓瘤细胞与小鼠脾脏细胞按一定比例进行细胞融合,在融合后第10天对融合细胞进行检测;将筛选到的阳性细胞进行敏感性检测,选择效价高且敏感性强的细胞株进行亚克隆;三轮亚克隆后筛选得到可以稳定分泌单克隆抗体的杂交瘤细胞株,测定其细胞上清效价及IC50值。
1.7 单克隆抗体大量制备、纯化及初步鉴定
取雌性BLAB/c小鼠,腹腔注射500 μL液体石蜡,10 d后注射同样体积的杂交瘤细胞(细胞数为106个);10 d后抽取小鼠腹腔腹水,用辛酸-硫酸铵法对小鼠腹水进行纯化,测定腹水效价和IC50值,并用SDS-PAGE鉴定纯度,同时测定抗体对HAPA的IC50值,计算交叉反应率。
2 结果
2.1 紫外光谱法鉴定人工合成抗原
紫外扫描结果显示:HAPA-OVA紫外光谱最大吸收峰在228 nm左右,相比于载体蛋白OVA和半抗原HAPA的紫外最大吸收峰均有偏移(图2-a),HAPA-BSA紫外光谱最大吸收峰与HAPAOVA相同(图2-b),初步证明完全抗原合成成功。
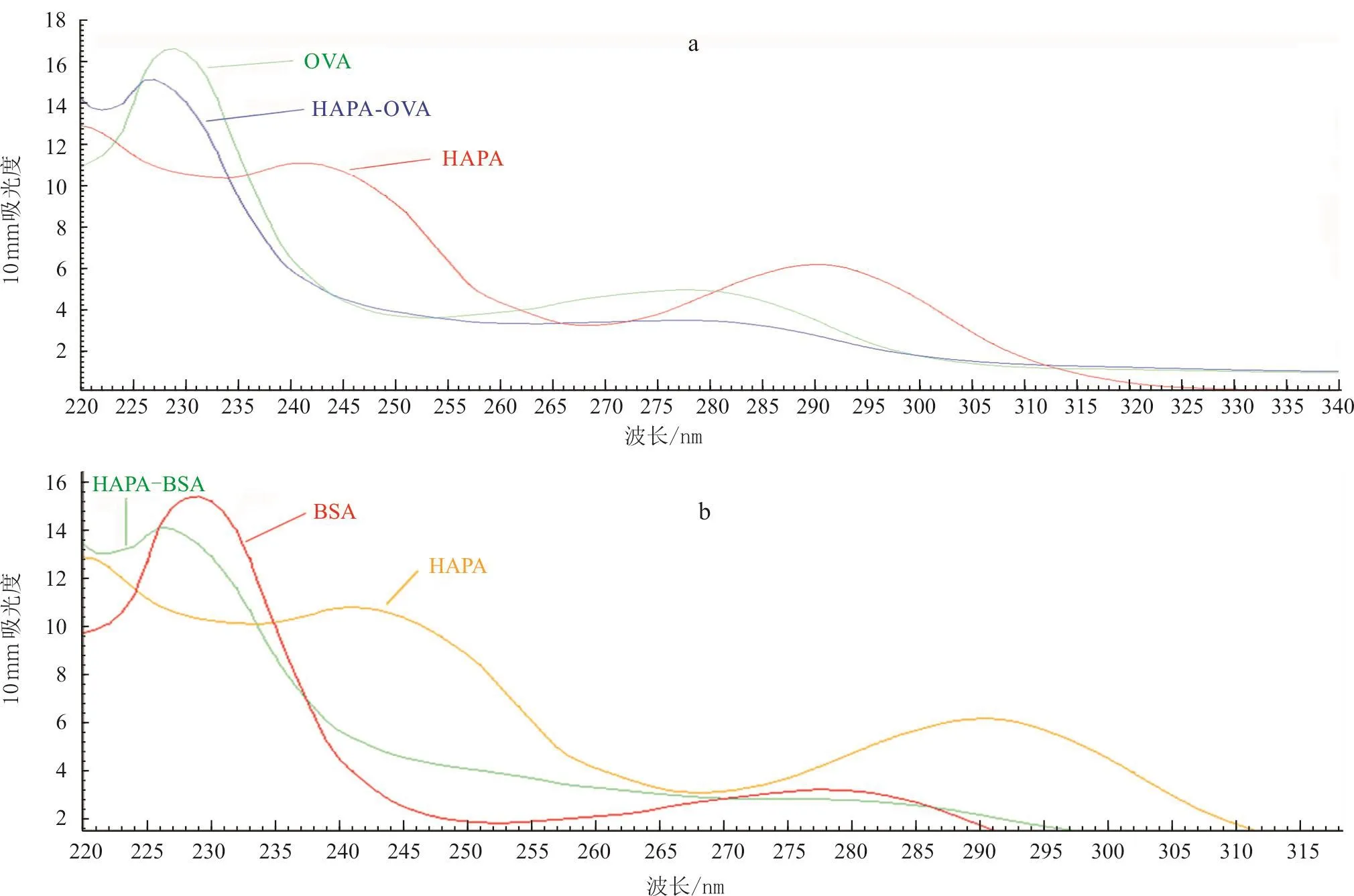
图2 HAPA-OVA和HAPA-BSA紫外扫描鉴定结果
2.2 SDS-PAGE鉴定人工合成抗原
HAPA-BSA蛋白浓度为0.237 mg/mL。电泳结果(图3)显示,与载体蛋白相比,合成的完全抗原HAPA-BSA有明显的拖尾现象,表明HAPA与载体蛋白BSA偶联成功。
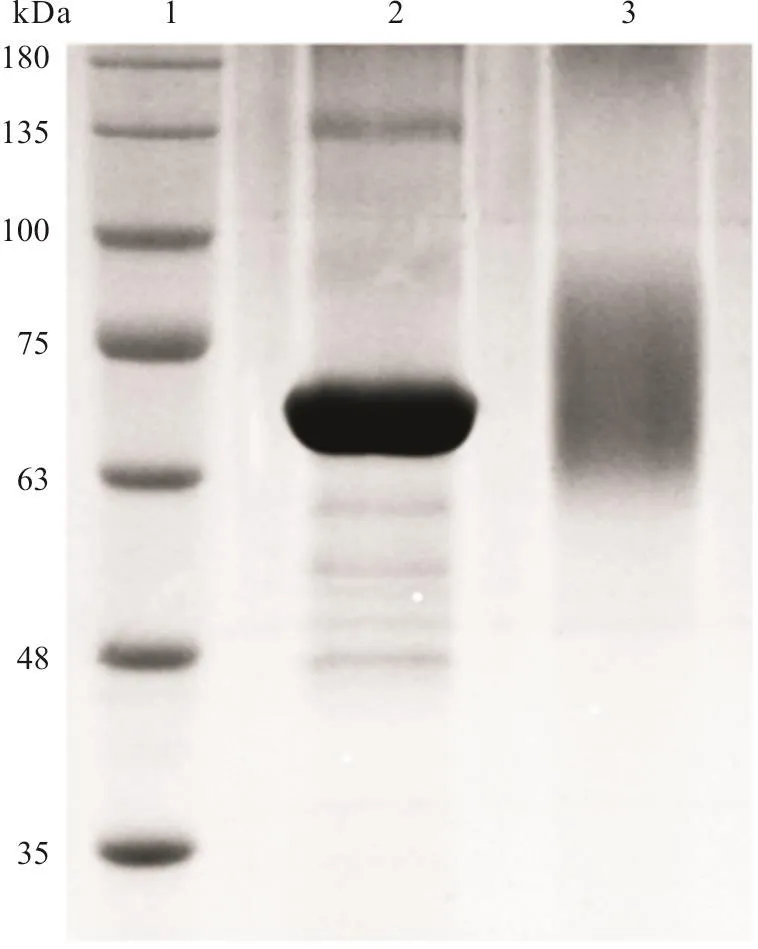
图3 HAPA-BSA的 SDS-PAGE鉴定
2.3 间接ELISA测定血清效价及敏感性
第3次免疫后1周,用间接ELISA测定的3只小鼠血清效价为1号小鼠1/6 400、2号1/12 800、3号1/3 200(图4-a),选择血清效价最高的2号小鼠,测定其IC50值为63.533 ng/μL(图4-b)。
2.4 细胞融合及单克隆细胞株筛选
细胞融合后10 d,用ELISA检测阳性细胞株,经过3轮亚克隆后得到1株可以稳定分泌抗ROX单克隆抗体的细胞株,命名为G12,细胞上清效价可达到1/512(图5-a),IC50值为3.147 ng/μL(图 5-b)。
2.5 单克隆抗体大量制备及纯化
辛酸-硫酸铵法纯化腹水后,测定纯化前后腹水的效价均为1/102 400(图6-a),纯化后腹水IC50值为1.433 ng/μL(图6-b);SDS-PAGE鉴定结果显示,纯化后的腹水纯度较高(图6-c)。抗体对HAPA的IC50值为0.943 ng/μL,交叉反应率为151.96 %。
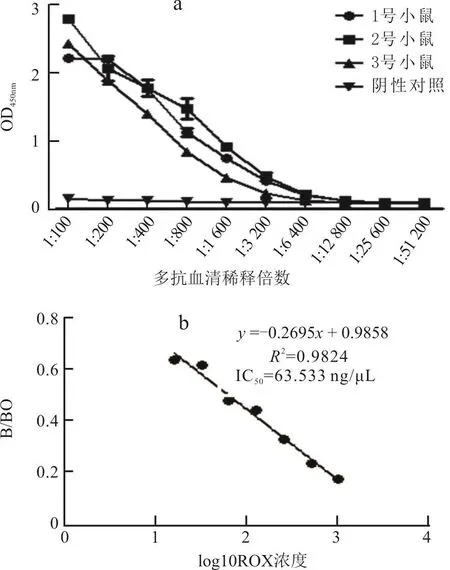
图4 小鼠多抗血清效价及2号小鼠血清IC50值
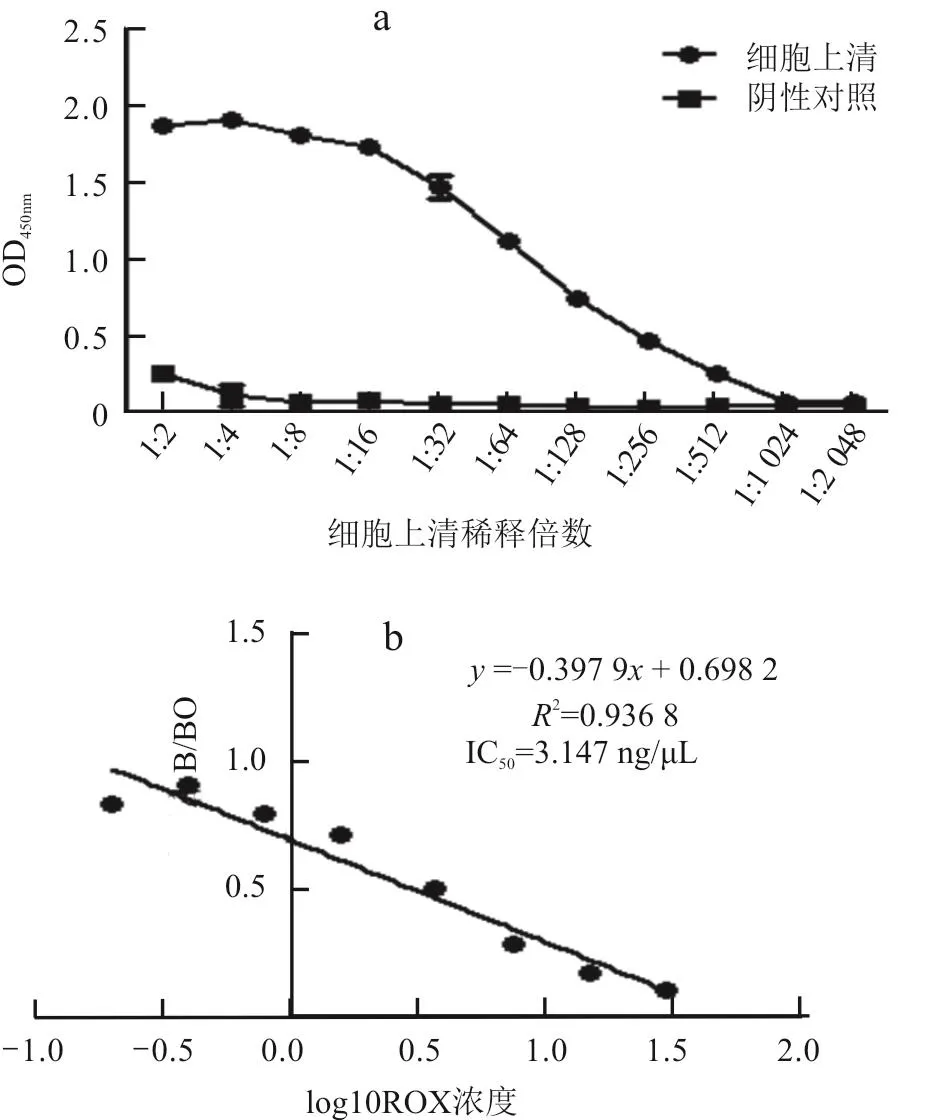
图5 细胞上清效价及其IC50值
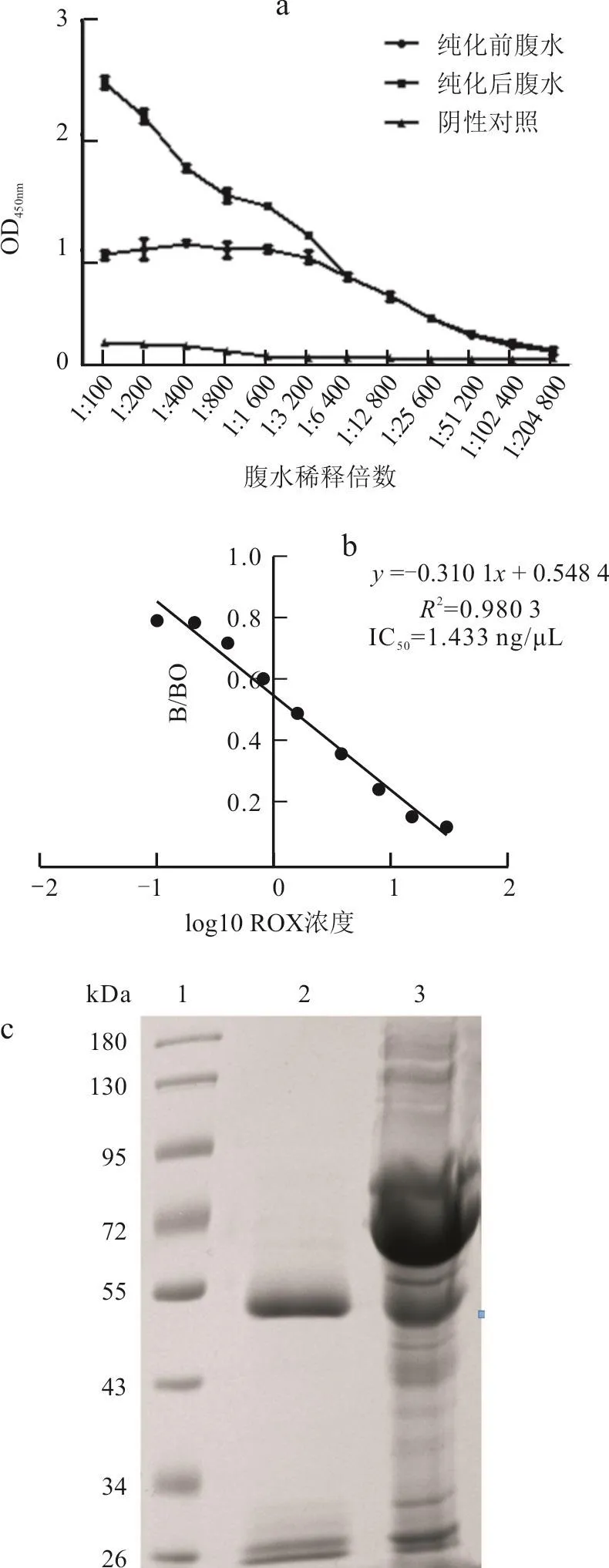
图6 纯化前后腹水效价、纯化后腹水IC50值和纯化后腹水纯度鉴定
3 讨论
ROX 是一种小分子半抗原,必须和大分子蛋白偶联制备完全抗原后才能具有免疫原性。完全抗原合成是研制抗ROX单克隆抗体最基本的,也是最重要的一步。在进行偶联方法选择时,要避免破坏小分子半抗原结构。与ROX相比,HAPA上的氨基可以直接与蛋白质上的羧基在一定条件下脱水缩合生成肽键。因此,将ROX的结构类似物HAPA分别与BSA、OVA偶联并作为免疫原和包被原,通过紫外光谱扫描并利用SDS-PAGE方法,对合成的完全抗原进行鉴定,确定其合成成功。为了探索ROX与BSA、OVA的最佳偶联方法,采用琥珀酸酐-混合酸苷法、1,4-丁二醚法和琥珀酸酐-EDC法,对ROX羟基进行改造。经过对合成的完全抗原进行紫外光谱、SDS-PAGE凝胶鉴定分析,并对其免疫效果进行评价,发现免疫效果与预期不符。免疫后的小鼠血清不能产生识别ROX的抗体,推测可能是因为在对ROX苯环上的羟基进行改造时,破坏了砷酸基团上的羟基,从而导致ROX结构被破坏,进而导致免疫后机体不能产生针对ROX的单克隆抗体。
4 结论
本研究最终研制出了可以识别ROX的单克隆抗体,其效价可达到1/102 400,IC50值为1.433 ng/μL,从而为建立更稳定、准确、快速的ROX免疫学快速检测方法打下了基础。
