人羊膜上皮细胞移植改善AD样病变模型大鼠学习记忆能力
2016-01-12董世桃,方宁,胡龙淼等
人羊膜上皮细胞移植改善AD样病变模型大鼠学习记忆能力*
董世桃1,方宁1,胡龙淼1,陈代雄1△,赵春华2
(1遵义医学院附属医院细胞工程重点实验室,贵州 遵义 563003;2中国医学科学院基础医学研究所组织工程研究中心,北京 100005)
[摘要]目的: 观察人羊膜上皮细胞(hAECs)对阿尔茨海默病(AD)样病变大鼠模型的治疗效应。方法: 采用胰蛋白酶消化法分离hAECs,流式细胞术分析表型。48只雄性SD大鼠随机分为假手术组、模型组、培养基组和hAECs移植组,每组12只。采用双侧脑室注入脂多糖(LPS)复制AD样病变大鼠模型。AD样病变大鼠海马区移植5×105个hAECs。细胞移植后2周,Morris水迷宫试验观察行为学变化,HE和硫磺素S染色观察海马病理变化,免疫组化染色检测β-淀粉样蛋白42(Aβ42)、Tau蛋白和乙酰胆碱(ACh)的变化, 流式细胞术检测外周血T淋巴细胞亚群的变化,流式微球阵列捕获技术(cytometric bead array,CBA)检测血清细胞因子含量,免疫荧光染色检测海马区人细胞核抗原阳性细胞及其神经元特异性核蛋白(NeuN)的表达。结果: 与模型组和培养基组比较,hAECs移植组大鼠逃避潜伏期明显缩短(P<0.01),跨域平台次数明显增加(P<0.05);海马神经元病损减轻,Aβ沉积减轻(P<0.05),磷酸化Tau蛋白水平下降(P<0.05),ACh增加(P<0.05);外周血Th1和Th17细胞百分比下降(P<0.05),而Th2和Treg细胞升高(P<0.05);IL-2和IFN-γ水平下调(P<0.05),而IL-4上调(P<0.05);移植区可见hAECs,并表达NeuN。结论: hAECs可明显改善AD样病变模型大鼠空间辨别性学习记忆能力,减轻海马病理损伤,其免疫调节效应可能发挥重要作用。
[关键词]阿尔茨海默病; 人羊膜上皮细胞; β-淀粉样蛋白; 学习记忆障碍
[中图分类号]R392.1[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.019
[文章编号]1000-4718(2015)11-2047-06
[收稿日期]2015-08-20[修回日期] 2015-10-12
[基金项目]*国家自然科学基金资助项目(No. 30901542);广东省自然科学基金自由申请项目(No. 2014A030313055);产学研合作项目(No. 2014B090901043);广东省科技计划(No. 2012B031800056);中山大学高校基本业务费青年教师培育资助项目(No. 12ykpy44)
通讯作者△Tel: 020-85252170; E-mail: doctorwanghui@126.com
Transplantation of human amnion epithelial cells improves learning and memory function in Alzheimer’s disease-like pathology rat modelDONG Shi-tao1, FANG Ning1, HU Long-miao1, CHEN Dai-xiong1, ZHAO Chun-hua2
(1KeyLaboratoryofCellEngineeringofGuizhouProvince,AffiliatedHospitalofZunyiMedicalCollege,Zunyi563003,China;2CenterofTissueEngineering,InstituteofBasicMedicalSciences,ChineseAcademyofMedicalSciences,Beijing100005,China.E-mail:cellgene@163.com)
ABSTRACT[]AIM: To observe the treatment effect and its immune regulation of human amnion epithelial cells (hAECs) on Alzheimer’s disease (AD)-like pathology rat model. METHODS: The hAECs were isolated from amnion with trypsin digestion, and the phenotype of hAECs was analyzed by flow cytometry. SD rats (n=48) were randomly divided into sham control group, model group, medium group and hAECs group. AD-like pathology rat model was induced by bilateral intraventricular injection of lipopolysaccharide (LPS). hAECs (5×105) were injected into the hippocampus of the AD-like pathology rats. At 2 weeks after transplantation, the animals were tested by Morris water maze to observe the function of learning and memory. The pathological change of the brain was observed by HE staining. The expression of amyloid β-protein 42 (Aβ42) and Tau protein and the level of acetylcholine (ACh) in the injury brain were determined by immunohistochemistry. The survival and differentiation of hAECs in the hippocampus were measured by immunofluorescent technique. The percentages of lymphocyte subsets in the peripheral blood mononuclear cells were analyzed by flow cytometry. The contents of serum cytokines were detected by cytometric bead array. RESULTS: Compared with model group and medium group, hAECs group showed shortened escape latency (P<0.01), increased frequency of going through the platform (P<0.05), reduced loss of hippocampal neurons, decreased expression of Tau protein and Aβ42 in the hippocampus (P<0.05), increased ACh level in the hippocampus (P<0.05), decreased percentages of Th1 and Th17 subsets, increased percentages of Th2 and Treg cells (P<0.05), decreased concentrations of IFN-γ and IL-2 in the serum, and increased concentration of IL-4 (P<0.05). CONCLUSION: hAECs improve the cognitive learning and memory function and alleviate pathologic damage of hippocampus through immune regulation in AD-like pathology rats.
[KEY WORDS]Alzheimer’s disease; Human amniotic epithelial cells; Amyloid β-protein; Learning and memory impairment
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的退行性神经系统疾病,其发病机制尚不完全清楚,治疗方法十分有限。随着干细胞技术的发展和对干细胞生物学特性的深入了解,干细胞移植可望成为治疗AD的有效手段。近年来,人们对人羊膜上皮细胞(human amniotic epithelial cells,hAECs)的生物学特性进行了深入的研究,证明从足月分娩胎盘羊膜分离的hAECs仍保留了胚胎干细胞的某些特性,不表达HLA-A、B、C、DR抗原和共刺激分子(B7-1和B7-2)[1-2],能合成、释放多巴胺、乙酰胆碱(acetylcholine,ACh)和多种神经营养因子[3-4]。hAECs的这些生物学特性为治疗神经系统退行性疾病提供了可能。目前尚未见有关hAECs治疗AD的报道。本实验旨在观察hAECs移植对AD样病变大鼠模型的治疗效应及其可能机制,为临床治疗AD提供实验依据。
材料和方法
1动物
清洁级成年雄性SD大鼠48只,体重250~300 g,购自第三军医大学动物中心,许可证号为SCXK (渝) 2012-0006。实验中动物处置符合科技报《关于善待实验动物的指导意见》的规定。
2主要试剂
LG-DMEM培养基和胎牛血清购自Gibco;用于流式细胞术(flow cytometry,FCM)的荧光标记抗体和细胞因子流式细胞微球阵列(cytometric bead array,CBA)检测试剂盒购自BD;鼠抗人波形蛋白抗体、脂多糖和硫磺素S购自Sigma;鼠抗人CK19 抗体购自GeneTech;鼠抗人细胞核抗原抗体、小鼠抗大鼠乙酰胆碱(ACh)抗体和荧光标记的小鼠抗大鼠神经元特异性核蛋白(NeuN)抗体购自Millipore;兔抗大鼠β-淀粉样蛋白42(amyloid β-protein 42,Aβ42)抗体和磷酸化Tau抗体购自Abcam。
3主要方法
3.1hAECs分离、培养及表型分析经产妇知情同意采集足月剖宫产胎盘,按本室建立的方法从羊膜提取hAECs[5]。将分离的hAECs悬浮于含10% 胎牛血清、1% GlutaMAX、1%β-巯基乙醇、1%非必需氨基酸(non-essential amino acid,NEAA)和10 μg/L表皮生长因子(epidermal growth factor,EGF)的L-DMEM培养基中,按5×105/cm2接种于培养瓶,于37 ℃、5% CO2、饱和湿度条件下培养。细胞生长面积达80%以上即进行传代培养,至第3代用于细胞治疗,并采用流式细胞仪(BD)检测其表型。荧光标记抗体为CD29-PE、CD44-FITC、CD73-PE、E-Cad-PE、CD326-FITC、CD49f-FITC、CD34-PE、CD45-FITC、CD80-FITC、CD86-PE和HLA-DR-FITC,同型对照为相应荧光素标记的小鼠IgG,每份样品采集细胞数 ≥20 000个,采用Cell Quest软件分析。为了排除羊膜间充质干细胞的污染,制备hAECs爬片,采用免疫组化染色检测上皮标志CK19。
3.2AD模型制备与分组参照文献[6]造模。动物麻醉后固定于脑立体定位仪上,保持前后囟水平。术区常规消毒,暴露前囟,根据大鼠脑立体定位图谱[7],侧脑室注射点的座标定位为前囟后1 mm,距离矢状缝1.5 mm,颅骨下3.5 mm。双侧脑室注入脂多糖溶液(终浓度为10 g/L),每侧5 μL。术后1周进行Morris水迷宫测试,与正常组大鼠逃避潜伏期和跨越平台次数比较,差异具有统计学显著性判为AD造模成功。随机数字表法将AD大鼠随机分为模型(model)组、培养基(medium)组和hAECs移植组(hAECs),设假手术(sham)组作为平行对照,每组12只。Sham组以10 μL生理盐水代替脂多糖, 其余操作同模型组。
3.3hAECs移植取第3代hAECs,用L-DMEM培养基制成细胞悬液。造模后2周,hAECs移植组大鼠用7%水合氯醛腹腔注射麻醉,根据大鼠脑立体定位图谱确定海马区注射位点,座标定位为前囟后3 mm、距离矢状缝2.2 mm、颅骨下3.5 mm,每只注射10 μL hAECs悬液(含5×105个细胞)。Medium组以相同的部位注射等体积L-DMEM培养基。Model和sham组不作处理。
3.4行为学检查hAECs移植前、后进行Morris水迷宫定位航行和空间探索实验[8],以评价大鼠学习记忆能力。定位航行实验每天上、下午各1次,持续5 d。将大鼠面向池壁分别从4个象限放入水中,摄像记录其找到平台所需时间即逃避潜伏期。如果 120 s内未能找到平台,则引导至平台上,停留30 s,其逃避潜伏期记录为120 s。取4个象限平均值为该次实验的成绩。定位航行实验结束后进行空间探索实验,撤除平台后任选一个入水点将鼠放入水中,摄像记录其在2 min内跨越原平台所在位置的次数。
3.5病理学检查hAECs移植后2周,各组大鼠在麻醉下,经腹主动脉抽取外周血,主动脉弓灌注4%多聚甲醛,取脑组织,4%多聚甲醛固定,石蜡包埋切片,进行以下检测:(1)常规HE染色观察海马神经元形态变化;(2)硫磺素S染色观察海马区Aβ沉积;(3)免疫组化染色检测Aβ42、Tau蛋白及ACh:石蜡切片常规脱蜡致水,柠檬酸钠缓冲液抗原修复,3% H2O210~15 min,山羊血清封闭液20 min,滴加 I 抗(兔抗大鼠Aβ42抗体、兔磷酸化Tau蛋白抗体和小鼠抗大鼠ACh抗体,均1∶100稀释), 4 ℃过夜,滴加免疫组化试剂盒A液室温孵育30 min,DAB显色,苏木素复染,显微镜观察。每张切片海马区随机取3个视野, 用Image-Pro Plus 6.0软件分析阳性产物积分吸光度(IA),以12张切片的平均IA值表示检测物的相对表达量。
3.6免疫荧光染色脑冰冻切片山羊血清封闭,滴加 I 抗MAB1281 (1∶100),4 ℃孵育过夜,滴加 II 抗羊抗小鼠IgG-FITC,37 ℃孵育1 h,PBS洗涤,滴加NeuN-PE抗体,37 ℃孵育1 h,PBS洗涤,DAPI复染,荧光显微镜观察。
3.7流式细胞术检测T细胞亚群外周血加入等体积PBS稀释,用淋巴细胞分离液提取单个核细胞。加人0.02 mg/L的佛波酯、1 mg/L的离子霉素和10 mg/L的布雷菲德菌素A,37 ℃培养箱孵育4 h。收集细胞,调整细胞浓度至l×109/L。取细胞悬液200 μL,加入5 μL Ab CD4-APC,室温避光孵育30 min,4%多聚甲醛固定20 min,加破膜缓冲液作用10 min。按组合方案加入相应的小鼠抗大鼠Ab IFN-γ-FITC、IL-4-PE、IL-17-FITC和FoxP3-PE,用相应荧光素标记的小鼠IgG作为同型对照。室温避光孵育30 min,PBS充分洗涤,1%多聚甲醛固定,4 ℃避光放置。所有样本24 h内上机检测,每份样品采集的细胞数 ≥20 000个,采用Cell Quest软件分析CD4+IFN-γ+(Th1)、CD4+IL-4+(Th2)、CD4+Foxp3+(Treg)和CD4+IL-17+(Th17)亚群百分率。
3.8流式微球阵列检测细胞因子先用BD Calibrite Beads试剂通过BD FACSComp软件设置FCM的基本参数(设门、电压、补偿),随后用试剂盒中的细胞因子标准品按梯度法稀释成1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128和1∶256,加上最高浓度和阴性对照制定细胞因子标准曲线。待测样品1 500 r/min离心5 min,吸取50 μL上清液于待测管中,加入50 μL 5种捕获微球混合物,孵育1 h,加入50 μL PE检测试剂,室温避光孵育2 h。加入1 μL洗液,1 500 r/min离心5 min,弃上清,加入300 μL洗液上机检测。采用 BD CBA分析软件,自动绘制出标准曲线,测出待测样品中细胞因子IL-2、IL-4、IL-10、IFN-γ和TNF-α的含量。
4统计学处理
实验数据采用SPSS 19.0软件进行统计学处理,以均数±标准差(mean±SD)表示。各组间比较采用单因素方差分析;组间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结果
1hAECs形态及表型特征
原代hAECs形态呈三角形、圆形,第3代hAECs贴壁生长,多为卵圆形,呈铺路石样生长,表达上皮标志CK19,见图1。第3代hAECs不表达CD34、CD45、CD80、CD86和HLA-DR,表达CD29、CD44、CD73、CD49f、E-Cad和CD326,见图2。
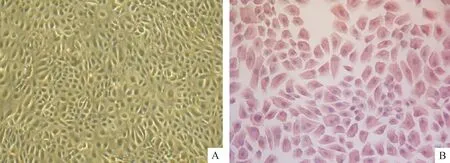
Figure 1.The morphology of cultured hAECs and positive expression of CK19 (×100). A: primary hAECs; B: positive expression of CK19.
图1hAECs形态及CK19免疫组化染色
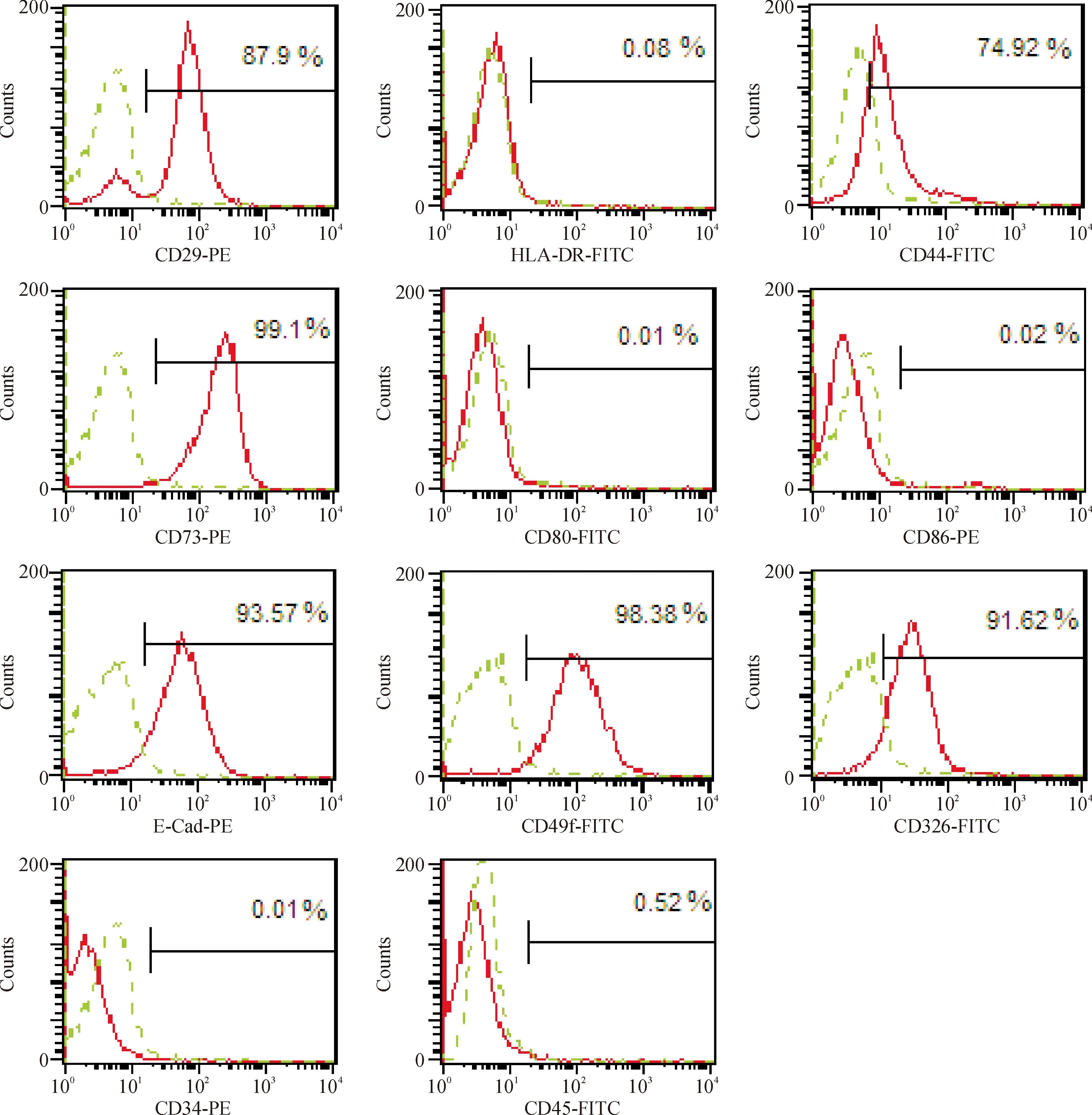
Figure 2.The phenotypic analysis of hAECs by flow cytometry analysis.
图2hAECs流式细胞术表型分析
2行为学检查结果
与模型组和培养基组比较,hAECs移植后2周,逃避潜伏期明显缩短(P<0.01),跨越平台次数明显增加(P<0.05);而与假手术组比较差异无统计学意义,见图3、4。
3脑组织病理变化
模型组和培养基组大鼠海马齿状回颗粒层神经元层数和数量减少,细胞间隙变大,排列紊乱,部分细胞体积缩小,细胞核固缩,并有变性、坏死;海马区大量Aβ沉积,Aβ42和磷酸化Tau蛋白均明显上调,其平均IA值显著高于假手术组(P<0.01),而ACh呈弱阳性,其平均IA值明显低于假手术组(P<0.05)。hAECs移植后2周,AD样病变大鼠海马神经元的损伤明显减轻, 细胞形态和排列大致正常;Aβ沉积明显减少, Aβ42和磷酸化Tau蛋白均明显下调,其平均IA值均明显低于模型组和培养基组(P<0.05);而ACh水平增加,其IA值高于模型组和培养基组,见图5、表1。
4hAECs在海马区分布及分化
hAECs移植后第2周,海马区可见人细胞核特异性抗原阳性细胞,其中多数细胞表达NeuN(MAB1281+/NeuN+细胞),见图6。

Figure 3.The changes of escaping latency from AD-like pathology rats 2 weeks after hAECs transplantation. Mean±SD.n=12.#P<0.05,##P<0.01vssham group;**P<0.01vsmodel group and medium group.
图3hAECs移植后2周AD样病变大鼠逃避潜伏期的变化

Figure 4.The changes of the frequency of going though platform from the AD-like pathology rats 2 weeks after hAECs transplantation. Mean±SD.n=12.#P<0.05vssham group;*P<0.05vsmodel group and medium group.
图4hAECs移植后2周AD样病变大鼠跨越平台次数的变化
5外周血T淋巴细胞亚群变化
与假手术组比较,模型组和培养基组外周血Th1和Th17细胞亚群明显升高(P<0.05),Th2和Treg细胞无明显改变;与模型组和培养基组比较,hAECs细胞治疗后2周AD大鼠Th1和Th17细胞明显降低(P<0.05),Th2和Treg细胞明显升高(P<0.05),见表2。
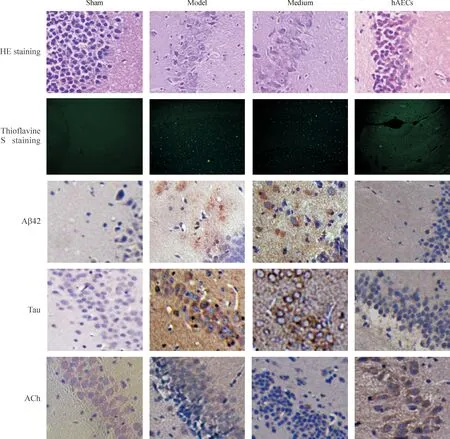
Figure 5.The pathological changes of brain tissues from the AD-like pathology rats 2 weeks after hAECs transplantation (×200).
图5hAECs 移植后2周AD样病变大鼠脑组织病理变化
表1各实验组大鼠海马区Aβ42、Tau 及ACh的变化
Table 1.The changes of Aβ42, ACh and Tau in the hippocampus in different groups (Mean±SD.n=12)
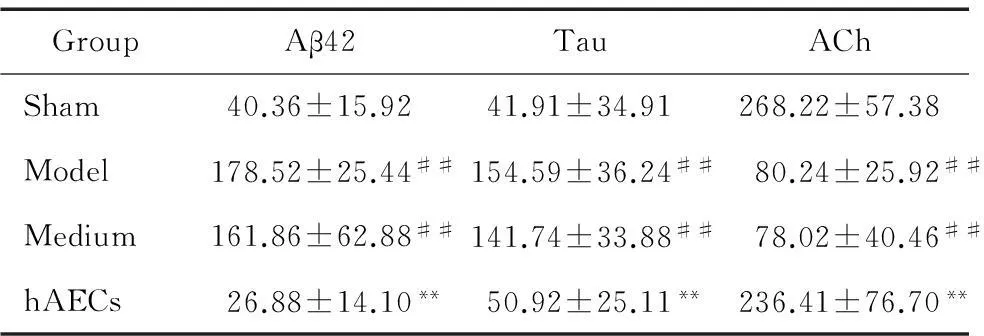
GroupAβ42TauAChSham40.36±15.9241.91±34.91268.22±57.38Model178.52±25.44##154.59±36.24##80.24±25.92##Medium161.86±62.88##141.74±33.88##78.02±40.46##hAECs26.88±14.10**50.92±25.11**236.41±76.70**
##P< 0.01vssham group;**P<0.01vsmodel group and medium group.
6血清细胞因子的变化
模型组和培养基组血清Th1型细胞因子IFN-γ和IL-2含量较之假手术组明显升高(P<0.05);与模型和培养基组比较,hAECs移植后2周大鼠IFN-γ和IL-2水平明显下降(P<0.05),而Th2型细胞因子IL-4明显升高(P<0.05),TNF-α和IL-10则无明显变化,见表3。
讨论
细胞类型的鉴定是细胞治疗过程中重要的质控环节。目前尚无公认的hAECs表型鉴定谱系标志。
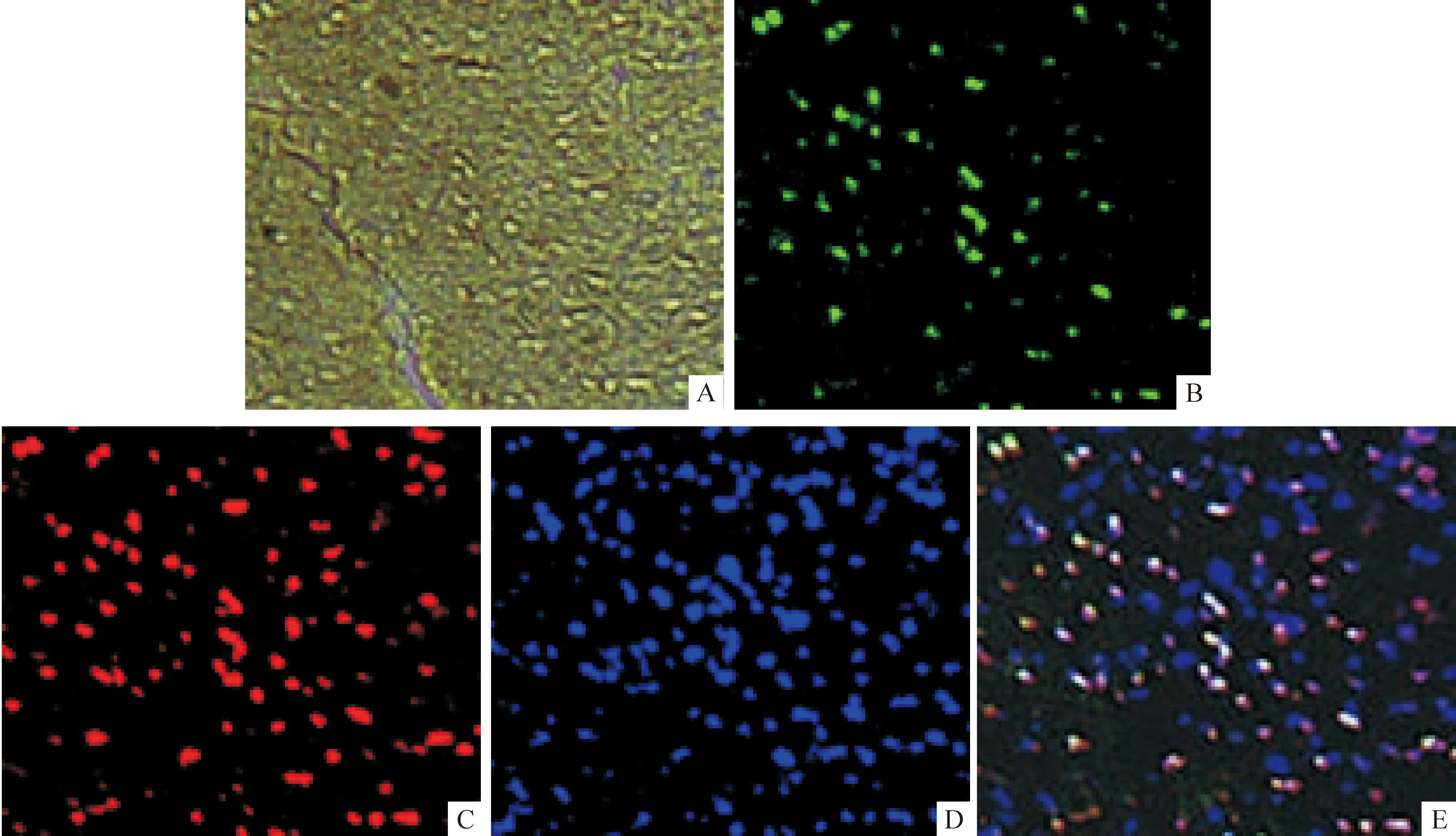
Figure 6.The expression of NeuN in the hAECs in hippocampus (immunofluorescence staining, ×200). A: bright field; B: human nuclear antigen positive; C: NeuN positive; D: DAPI staining; E: Merged.
图6海马区植活的hAECs表达NeuN

表2 各实验组外周血T淋巴细胞亚群百分率
#P<0.05vssham group;△P<0.05vsmodel group;▲P<0.05vsmedium group.
本实验结果显示,用于移植的第3代hAECs不表达CD34、CD45、CD80(B7-1)、CD86(B7-2)和HLA-DR, 高表达CD29、CD44、CD73、CD49f、CD326(Ep-CAM)、E-Cad和CK19,说明用于移植的第3代hAECs仍保持了良好的上皮细胞表型特征。值得指出的是hAECs不表达HLA-DR以及共刺激分子B7-
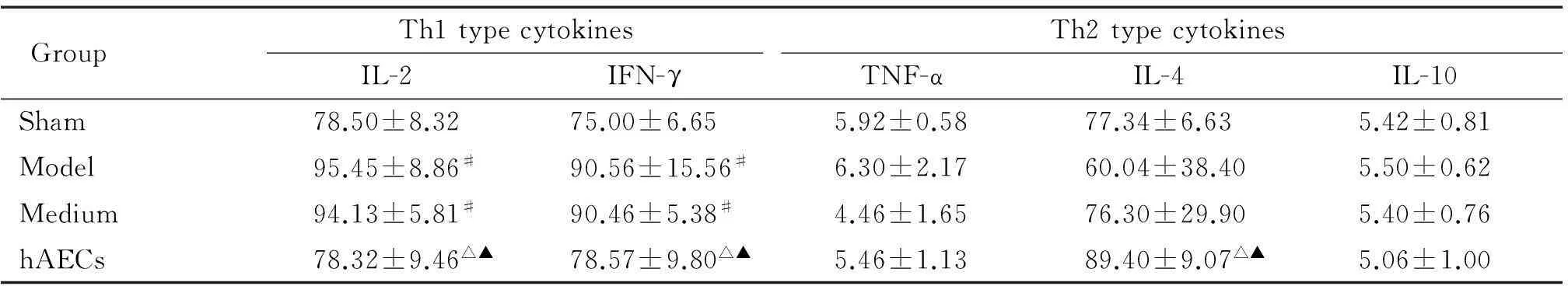
表3 各实验组血清细胞因子含量的比较
#P<0.05vssham group;△P<0.05vsmodel group;▲P<0.05vsmedium group.
1 和B7-2,说明hAECs具有不被异种或同种异基因免疫细胞识别的免疫豁免特性。
目前常用的AD样病变造模方式有物理损伤、化学损伤及转基因老年动物等方法,但都很难精确反映人类AD发病机制和病理过程,迄今为止尚无一个公认的最佳AD样病变造模方法。本实验采用LPS直接注入双侧脑室建立大鼠AD样病变模型,主要病理变化表现为大脑海马区神经元明显减少,大量Aβ沉积,磷酸化Tau蛋白呈阳性反应,伴有空间识别性学习、记忆障碍,表明用LPS建立的AD样病变模型能较好地模拟AD的病理特征和临床表现。水迷宫实验结果显示,AD样病变大鼠hAECs海马区移植后2周,逃避潜伏期缩短,测试第3天至第5天达与假手术组明显差别,跨域平台象限的次数也接近假手术组,说明AD样病变大鼠空间识别性学习和记忆能力得以明显改善。病理检查发现,hAECs治疗组大鼠海马齿状回颗粒层神经元增多,Aβ沉积减少,Tau蛋白异常磷酸化减轻,ACh水平明显升高。这些证据表明,hAECs移植均可明显改善AD样病变大鼠认知功能和减轻脑组织特征性的病理改变。
Aβ在细胞外异常沉积和异常磷酸化Tau蛋白形成的神经纤维缠结(neurofibrillary tangles,NFT)是AD最主要的病理学特征。 普遍认为,Aβ聚集是AD的起始因子,Aβ沉积可对兴奋性突触和抑制性中间神经元的ACh释放产生神经毒性作用,导致广泛的突触功能异常,同时选择性攻击GABA能抑制性神经元,使皮质和海马内兴奋性神经元抑制减弱而过度兴奋,从而引起神经环路或网络功能异常,导致认知能力障碍[9-11]。Aβ以多种形式存在于生物体内,其中Aβ40和Aβ42是最主要的亚型,后者较前者多2个疏水氨基酸,更容易在脑内聚集,具有更强的毒性和成纤维性[12-13]。Tau蛋白主要分布于神经元轴突,与微管结合有助于轴突的正常生理功能。大量Aβ可引发Tau蛋白过度磷酸化,过度磷酸化的Tau蛋白聚集在神经元树突棘,一方面可进一步增强Aβ诱导的兴奋性神经毒性作用[14];另一方面,可导致脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的轴突运输异常,使突触容易疲劳而影响神经递质的释放[15]。本实验发现,hAECs移植后,AD样病变大鼠脑组织中Aβ42表达和磷酸化Tau蛋白水平均明显下降。提示由hAECs介导的Aβ42和Tau蛋白下调可能在改善AD样病变模型大鼠认知功能方面起重要作用。
炎症和免疫反应是AD发病机制中的重要环节,免疫活性细胞和免疫因子在AD炎症反应中发挥重要作用[16]。Aβ C端的T细胞表位(Aβ17-21和Aβ29-42 C端)是引起细胞毒作用的核心肽段,可诱导Th1细胞,促进炎症反应。迄今尚未见有关AD模型动物免疫病理变化的报道。本实验LPS诱导的AD模型具有明显的免疫病理特征,表现为Th1和Th17细胞反应过亢,促炎性Th1型细胞因子IL-2和IFN-γ水平升高。实验发现,hAECs移植后AD大鼠外周血Th1和Th17细胞百分率明显下降,Th2和FoxP3+Treg细胞明显升高,Th1类细胞因子IL-2和IFN-γ水平下调,Th2类细胞因子IL-4上调。Th17是一类重要的介导炎症反应的细胞,通过分泌IL-17参与各种炎症反应过程。FoxP3+Treg不仅可抑制自身反应性T细胞增殖,而且在调节机体外源性抗原免疫反应过程中发挥重要作用。本实验结果提示,hAECs可通过抑制Th1和Th17,上调Th2和FoxP3+Treg,从而抑制AD的炎症/免疫反应。据此推测,由hAECs介导的免疫调节作用可能在减轻AD神经组织免疫损伤中发挥重要作用。
hAECs治疗AD的机制还不完全清楚。相对于其它成体干细胞如MSCs,hAECs具有某些独特的生物学特性,针对神经性疾病治疗最值得关注的价值成分是其神经生物学特性和抗炎作用。hAECs能合成、释放脑源神经营养因子、神经营养因子3、神经生长因子及其它一些未知的神经生长因子,发挥激活神经细胞再生作用[17]。hAECs还能合成、分泌儿茶酚胺和ACh[3-4],有助于改善AD、帕金森病、亨廷顿病等神经退行性疾病所引起的认知功能下降。在抗炎方面,hAECs可通过FasL、TRAIL、MIF等免疫抑制因子抑制免疫细胞的趋化活性,抑制T细胞增殖,诱导巨噬细胞由M1型(致炎型)向M2型(抗炎型)转化,从而发挥抗炎作用[18-19]。我们早先研究证明,hAECs可通过上调FoxP3+Treg和下调Th17改善自身免疫性脑脊髓炎大鼠神经组织的免疫损伤[20]。这些研究结果提示, hAECs对AD样病变模型大鼠疗效的生物学原理可能涉及其旁分泌机制介导的神经营养、抗炎和免疫调节作用。
hAECs由胚胎上胚层(epiblast)衍化而来,其功能与胚胎发育尤其是神经分化、母-胎免疫耐受及胎儿发育稳态环境有关,而且仍保留了胚胎干细胞的某些特性,向神经元分化无跨胚层障碍。实验结果显示,移植到AD样病变大鼠海马中的hAECs表达NeuN,这是移植后微环境诱导分化的结果,还是其本身就表达NeuN,还不清楚。因此,尚不能确定移植的hAECs已分化为神经元样细胞,有待进一步验证。另一方面,即使hAECs移植后能分化为神经元,它能否与宿主建存神经元整合,并重建新的神经环路,值得深入研究。
[参考文献]
[1]Banas RA, Trumpower C, Bentlejewski C, et al. Immunogenicity and immunomodulatory effects of amnion-derived multipotent progenitor cells[J].Hum Immunol, 2008, 69(6): 321-328.
[2]Pratama G, Vaghjiani V, Tee JY, et al. Changes in culture expanded human amniotic epithelial cells:implications for potential therapeutic applications[J]. PLoS One, 2011, 6(11): e26136.
[3]Elwan MA. Synthesis of dopamine from L-3,4-dihydroxyphenylalanine by human amniotic epithelial cells[J]. Eur J Pharmacol, 1998, 354(1): R1-R2.
[4]Sakuragawa N, Misawa H, Ohsugi K, et al. Evidence for active acetylcholine metabolism inhuman amniotic epithelial cells: applicable to intracerebral allografting for neurologic disease[J]. Neurosci Lett,1997, 232 (1):53-56.
[5]方宁,张路,宋秀军. 人羊膜上皮细胞的分离培养及鉴定[J]. 遵义医学院学报, 2009, 32(2):121-123.
[6]Hauss-Wegrzyniak B, Vraniak PD, Wenk GL. LPS-induced neuroinflammtory effects do not recover with time[J]. Neuroreport, 2000, 11(85):1759-1763.
[7]包新民,舒斯云. 大鼠脑立体定位图谱[M]. 第1版. 北京:人民卫生出版社, 1991:44-45.
[8]Kumar A, Seghal N, Naidu PS, at al. Colehicines-induced neurotoxity as an animal model of sporadic dementia of Alzheimer’s type[J] . Pharmacol Rep, 2007, 59(3):274-283.
[9]Selkoe DJ. Alzheimer’s disease is a synaptic faiture[J]. Science, 2002, 298(5594):789-791.
[10]Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to the-rapeutics[J]. Science, 2002, 297(5580): 353-356.
[11]Huang JK, Ma PL, Ji SY, et al. Age-dependent alterations in the presynaptic active zone in a Drosophila model of Alzheimer’s Disease[J]. Neurobiol Dis, 2013, 51: 161-167.
[12]Fukumoto H, Asami-Odaka A, Suzuki N, et al. Amyloid β protein deposition in normal aging has the same characteristics as that in Alzheimer’s disease. Predominance of Aβ42(43) and association of Aβ40 with cored plaques[J]. Am J Pathol, 1996, 148(1):259-265.
[13]Jarrett JT, Barger EP, Lausbury PT. The carboxy terminus of the beta amyloid protein is critical for the seeding of amyloid formation: implications for the pathogenesis of Alzheimer’s disease[J]. Biochemistry, 1993, 32(18):4693-4697.
[14]Ittner LM, Götz J. Amyloid-β and tau: a toxicpasdedeuxin Alzheimer’s disease[J]. Nat Rev Neurosci, 2011, 12(2):65-72.
[15]Schiudowshi K, Belarbi K, Buée L. Neurotrophic factors in Alzheimer’s disease: role of axonal transport[J]. Genes Brain Behav, 2008, 7(Suppl 1):43-56.
[16]McGeer EG, McGeer PL. The importance of inflammatory mechanisms in Alzheimer’s disease[J]. Exp Gerontol, 1998, 33(5):371-378.
[17]Uchida S, Inanaga Y,Kobayashi M, et al. Neurotrophic function of conditioned medium from human amniotic epithelial cells[J]. Neurosci Res, 2000, 62(4): 585-590.
[18]Li H, Niederkorn JY, Neelam S, et al. Immunosuppressive factors secreted by human amniotic epithelial cells[J].Invest Ophthalmol Vis Sci, 2005, 46(3): 900-909.
[19]Manuelpillai U, Lourensz D, Vaghjiani V, et al. Human amniotic epithelial cell transplantation induces markers of alternative macrophage activation and reduces established hepatic fibrosis[J]. PLoS One, 2012, 7(6):e38631.
[20]李丹,方宁,陈代雄,等. 人羊膜上皮细胞治疗大鼠实验性自身免疫性脑脊髓炎的效应及免疫调节作用[J]. 中国免疫学杂志,2013, 29(10): 1011-1016.
(责任编辑: 林白霜, 罗森)

