米诺环素后处理通过抑制PARP过度活化减轻心肌缺血/再灌注损伤
2016-01-12张利群,陈冬,齐国先
米诺环素后处理通过抑制PARP过度活化减轻心肌缺血/再灌注损伤*
张利群1△,陈冬2,齐国先3
(1沈阳医学院护理学院人文教研室,辽宁 沈阳 110034; 中国医科大学附属第一医院2中心实验室,3心内科,辽宁 沈阳 110001)
[摘要]目的: 探讨米诺环素后处理能否通过抑制多腺苷二磷酸核糖聚合酶1(PARP-1)过度活化减轻大鼠心肌缺血/再灌注(I/R)损伤。方法: 结扎大鼠冠状动脉左前降支45 min,再灌注2 h,建立心肌I/R模型。将90只雄性Wistar 大鼠随机分为假手术(sham)组, I/R组,低、高剂量米诺环素组及PARP抑制剂3-氨基苯甲酰胺(3-AB)组。氯化三苯基四氮唑(TTC)和伊文思蓝双染法检测心肌梗死范围,HE 染色观察心肌组织形态学改变,TUNEL 法评估心肌细胞凋亡程度,酶联免疫吸附法测定血清肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)含量,Western blot法检测再灌注心肌及外周血白细胞内PARP-1活化产物多腺苷二磷酸核糖(PAR)的表达。结果: 与sham组比较,心肌、外周血白细胞内PAR表达及血清TNF-α、IL-1β含量明显升高。与I/R组比较,米诺环素低、高剂量及3-AB后处理组均能显著减少梗死范围及心肌细胞凋亡程度,同时明显降低心肌、外周血白细胞内PAR表达及血清TNF-α、IL-1β含量。米诺环素高剂量组与3-AB组比较无显著差异。结论: 米诺环素后处理可能通过抑制心肌及外周血白细胞PARP过度活化减轻大鼠心肌I/R损伤。
[关键词]多腺苷二磷酸核糖聚合酶; 米诺环素; 后处理; 心肌缺血再灌注损伤
[中图分类号]R363[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.014
[文章编号]1000-4718(2015)11-2016-05
[收稿日期]2015-04-23[修回日期] 2015-08-24
通讯作者△Tel: 0759-2633626; E-mail: 276798575@qq.com
Minocycline postconditioning protects myocardium from ischemia-reperfusion injury through attenuating poly(ADP-ribose) polymerase excessive activationZHANG Li-qun1, CHEN Dong2, QI Guo-xian3
(1DepartmentofHumanity,SchoolofNursing,ShenyangMedicalCollege,Shenyang110034,China;2CentralLaboratory;3DepartmentofCardiology,TheFirstAffiliatedHospital,ChinaMedicalUniversity,Shenyang110001,China.E-mail:sunflowerzlq@163.com)
ABSTRACT[]AIM: To investigate whether minocycline postconditioning protects rat myocardium from ischemia-reperfusion (I/R) injury through attenuating poly(ADP-ribose)polymerase-1 (PARP-1) excessive activation. METHODS: The left anterior descending coronary artery was ligated for 45 min and then reopened for 2 h to establish the rat model of myocardial ischemia-reperfusion injury. The male Wistar rats (n=90) were randomly divided into sham group, I/R group, low- and high-dose minocycline groups, and 3-aminobenzamide (3-AB, PARP inhibitor) group. The myocardial infarct size was measured by Evans blue and 2,3,5-triphenyltetrazolium chloride (TTC) staining. The morphological changes of the myocardium were observed with HE staining. The cardiomyocyte apoptosis was detected using in situ TDT-mediated dUTP nick end labeling (TUNEL). The level of tumor necrosis factor α (TNF-α) and interleukin 1β (IL-1β) in the serum were measured by ELISA. The content of poly(ADP-ribose) (PAR) in the reperfused myocardium and peripheral leukocytes were detected by Western blot. RESULTS: Compared with sham group, PAR expression, TNF-α content and IL-1β concentration increased in all other groups. Compared with I/R group, treatment with low and high doses of minocycline and 3-AB significantly reduced the infarct size and myocardial apoptosis. PAR expression, TNF-α content and IL-1β concentration in low- and high- dose minocycline groups and 3-AB group all decreased. No significant difference of the above parameters between high-dose minocycline group and 3-AB group was observed. CONCLUSION: Minocycline postconditioning may attenuate myocardial ischemia-reperfusion injury by depressing the activation of PARP-1 in cardiomyocytes and peripheral leukocytes in rats.
[KEY WORDS] Poly(ADP-ribose) polymerase; Minocycline; Postconditioning; Myocardial ischemia-reperfusion injury
目前缺血性心脏病已成为导致人类死亡的首位原因,心肌再灌注治疗使其死亡率下降了几乎接近一半。然而,再灌注犹如一把双刃剑,由此引发的额外心肌损伤显著削弱了由其带来的临床益处[1-2]。心肌缺血/再灌注(ischemia-reperfusion,I/R)损伤发病机制的研究仍然是心血管领域的重点与热点。前临床研究证实,心肌I/R可以使心肌细胞和内皮细胞产生大量活性氧和氮簇,这些物质诱导的DNA损伤将激活核酶多腺苷二磷酸核糖聚合酶1[poly (ADP-ribose) polymerase-1,PARP-1][3],PARP-1活化并不只局限于心肌局部,外周血白细胞内也存在PARP-1活化产物PAR的过度表达[4-5]。PARP-1过度活化成为缺血再灌注介导细胞功能障碍和死亡的一个关键途径,PARP-1抑制剂可能成为心肌缺血再灌注损伤急性心肌保护的重要治疗手段[3]。新近发现许多内源性和外源性因子能调节PARP-1活性[6],其中四环素类抗生素即为一类调节PARP-1活性的外源性因子。
米诺环素(minocycline,M)是一种半合成的四环素衍生物,最近研究发现米诺环素能减轻I/R对心肌的损伤[7],但其多采用预处理与腹腔注射方式给药,并且使用剂量是临床常规抗感染、抗炎剂量的30倍[8]。因此,本研究首次采用低剂量米诺环素3 mg/kg,相当于临床应用标准剂量200 mg[8],观察其后处理对I/R心肌的作用,并探讨其对再灌注心肌及循环血白细胞内PAR表达及血清炎症细胞因子的影响,为米诺环素防治心肌再灌注损伤的可行性和临床转化提供理论依据。
材料和方法
1动物、试剂及仪器
雄性Wistar大鼠90只,体重300~340 g,由中国医科大学实验动物中心提供。盐酸米诺环素、PARP抑制剂3-氨基苯甲酰胺(3-aminobenzamide,3-AB)、Histopaque-1083和2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride, TTC)购自Sigma;单克隆小鼠抗大鼠PAR购自Alexis Biochemicals;伊文思蓝(Fluka);大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(购自R&D);考马斯亮蓝蛋白测定试剂盒(南京建成科技有限公司);TUNEL试剂盒(南京凯基生物科技发展有限公司)。小动物呼吸机(成都泰盟科技有限公司);石蜡切片机(Leica);光学显微镜(Olympus);酶标仪(ThermoLab System)。
2I/R大鼠模型的制备和实验分组
大鼠用10%水合氯醛4 mL/kg腹腔注射麻醉,气管切开插管行小动物呼吸机辅助呼吸,潮气量10 mL/kg,吸呼比1∶1.5,呼吸频率75 min-1。在第4肋间行左胸廓切开术,暴露心脏,打开心包,挤出大部分心脏,暴露肺动脉圆锥与左心耳根部间的左冠状静脉。以左冠状静脉为标志,用5-0缝线在左冠状静脉下穿线,连同左冠状静脉一起在距冠状动脉前降支根部1~2 mm形成一个直径约5 mm的活结,将穿有27 G针管长度约5 mm的硅胶管置于活结中,结扎后,见左室游离壁立即变白 (或发绀)及心电图ST段抬高或QRS波宽高畸形并持续存在为结扎成功。45 min后拔出硅胶管,使冠状动脉血流再通,再灌注时局部组织充血及心电图ST段回落或QRS变窄。全程监测大鼠肛温,通过热垫和台灯维持大鼠体温在37 ℃~38 ℃。假手术组动物手术全过程与其它组相同,但只穿线不结扎冠状动脉。
健康雄性Wistar大鼠随机分为假手术(sham)组、缺血再灌注(I/R)组、低剂量(3 mg/kg)米诺环素(low-dose minocycline, LM)后处理(LM+I/R)组、高剂量(10 mg/kg)米诺环素(high-dose minocycline, HM)后处理(HM+I/R)组、3-AB(20 mg/kg)后处理(3-AB+I/R)组,每组各18只。各组于再灌注前10 min由股静脉注射给药,I/R组给等量生理盐水,每2 h给药1次,共给药2次。再灌注2 h后颈静脉取血用于外周血白细胞内PAR及血清细胞因子检测,之后随机取6只进行组织病理形态学检测及心肌凋亡细胞原位测定,6只大鼠行心肌缺血危险区、梗死范围测定,6只大鼠行再灌注心肌PAR测定。
3主要方法
3.1血标本和外周血白细胞准备再灌注2 h后,先从颈静脉取血5 mL置于肝素化试管中,使用Histopaque-1083分离单个核细胞[4]。具体操作:将5 mL Histopaque-1083置于离心管底部,小心轻移5 mL抗凝全血至其顶部,注意避免混合,室温下以800×g离心15 min,后用吸管抽吸血浆层至0.5 cm厚包含单个核细胞的不透明层,将单个核细胞移进清洁的离心管,再悬浮于磷酸盐缓冲液(phosphate-buffered saline,PBS)内,室温下以250×g离心10 min,用PBS冲洗2次后,分离的单个核细胞使用梯度降温法后于-70 ℃冰箱中保存备用。
3.2心肌缺血危险区、梗死范围测定再灌注2 h后,再次原位结扎冠状动脉,从左心室腔注入2%伊文氏兰3 mL,未缺血心肌组织染成蓝色,缺血心肌不染色,即为缺血危险区。剪去右心室和心房,冻存后切厚度为2 mm的横断面切片4~5个,缺血左室部分置于37 ℃下1%的TTC溶液中孵育20 min,染色后将心脏切片以10%甲醛溶液固定6 h。白、红和蓝3种颜色分别代表梗死区、非梗死的缺血区和非缺血区,非梗死的缺血区和梗死区一起作为缺血危险区(area at risk, AAR)。缺血危险区用缺血危险区心肌重量与左室重量之比(AAR/LV)表示,而梗死范围(infarct size,IS)用梗死区心肌重量与缺血危险区心肌重量之比(IS/AAR)表示。
3.3心肌组织病理形态学的测定再灌注2 h后,迅速留取左心室前壁缺血中心区同一部位全层心肌组织,4%的多聚甲醛固定12 h,石蜡包埋,HE染色,光镜下观察缺血区心肌形态学和炎症细胞浸润情况。
3.4心肌凋亡细胞原位测定再灌注2 h后,迅速留取左心室前壁缺血中心区同一部位全层心肌组织,4%的多聚甲醛固定12 h,石蜡包埋,用TUNEL法检测细胞凋亡,具体操作按试剂盒说明书进行。光镜下正常心肌细胞核呈蓝色,棕色为TUNEL染色凋亡细胞,每张切片随机选取10个视野,计数凋亡阳性细胞,以凋亡细胞数/细胞总数作为凋亡指数(apoptotic index,AI),反映各组心肌细胞凋亡的情况。
3.5血清TNF-α和IL-1β含量测定再灌注2 h,颈静脉取血2 mL,静置后4 ℃下3 000 r/min,离心10 min分离出血清,应用 ELISA 法检测血清TNF-α和IL-1β含量,检测方法按照检测试剂盒使用说明进行。
3.6心肌和外周血白细胞的PARP活化产物PAR测定采用Western blot方法检测各组再灌注心肌和外周血白细胞的PAR表达。分别取心肌组织或细胞匀浆液离心后应用Bradford 进行蛋白含量检测。取蛋白20 μL(50 μg)上样于10%十二烷基硫酸钠-聚丙烯酞胺凝胶上,电泳电压120 V,转膜后封闭,按照1∶400稀释PAR,1∶2 000稀释β-actin抗体37 ℃孵育1 h,放入4 ℃冰箱过夜进行 I 抗杂交,取相对应 II 抗杂交,ECL发光,将胶片于成像系统中拍照,以 Quantity One 4.6.2 成像软件分析电泳带的灰度值,选择PARP-1自身糖基化在内的高分子量片段,即116 kD以上灰度值与相应的β-actin的灰度值的比值为各个样本PAR的表达量。
4统计学处理
用SPSS 17.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK法。以P<0.05 为差异有统计学意义。
结果
1米诺环素后处理对大鼠心肌损伤的影响
1.1心肌组织病理形态学改变光镜下观察,sham组的心肌细胞排列整齐,着色均匀,肌纤维横纹清晰,无细胞肿胀,未见变性坏死和炎性细胞浸润;I/R组的心肌肌纤维排列紊乱,着色不均匀,细胞肿胀明显,心肌细胞间隙水肿严重,肌纤维部分断裂,横纹模糊或消失,可见心肌细胞呈片状坏死,坏死区细胞核碎裂或崩解,周围有炎性细胞浸润; LM+I/R组、HM+I/R组及3-AB+I/R组的心肌细胞排列基本规整,部分心肌细胞水肿变性,肌纤维间隙水肿,但明显少于I/R组,炎性细胞浸润减少。与I/R组相比,心肌组织结构明显改善,见图 1。

Figure 1.The effects of minocycline on myocardial injury in rats.
图1米诺环素对大鼠心肌组织损伤的影响
1.2心肌缺血危险区和梗死范围各组大鼠心肌缺血危险区范围的差异均无统计学意义;与I/R组比较,LM+I/R组、HM+I/R组及3-AB+I/R组均能显著减小梗死范围(P<0.05);与LM+I/R组比较,HM+I/R组减小梗死范围更显著(P<0.05)。HM+I/R组与3-AB+I/R组比较无显著差异,见图2、表1。
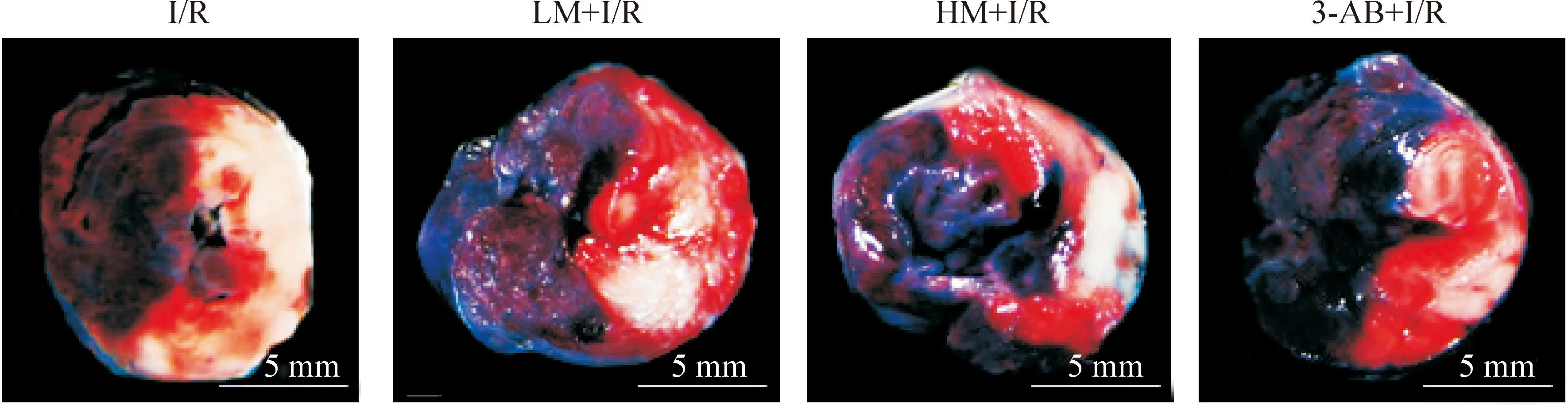
Figure 2.The effects of minocycline on myocardial area at risk and infarct size in the rats.
图2米诺环素对大鼠心肌缺血危险区和梗死范围的影响
表1米诺环素对大鼠心肌缺血危险区、梗死范围和血清TNF-α、IL-1β含量的影响
Table 1.The effects of minocycline on myocardial area at risk, infarct size and serum contents of TNF-α and IL-1β in the rats (Mean±SD)

TreatmentAAR/LV(%.n=6)IS/AAR(%.n=6)TNF-α(ng/L.n=12)IL-1β(ng/L.n=12)Sham——52.34±6.2744.38±5.18I/R51.18±4.9458.48±5.39234.34±24.79*153.13±11.98*LM+I/R49.23±3.3641.50±4.30#163.59±12.87*#91.74±9.23*#HM+I/R49.45±3.6433.11±3.94#△129.18±7.56*#△73.05±9.05*#△3-AB+I/R50.06±5.2237.58±3.88#138.57±8.58*#77.16±9.62*#
*P<0.05vssham group;#P<0.05vsI/R group;△P<0.05vsLM+I/R group.
1.3大鼠心肌细胞凋亡指数TUNEL染色后正常细胞核染蓝色,凋亡细胞核呈棕色。Sham组大鼠心肌中极少量TUNEL染色阳性细胞,I/R组大鼠染色阳性细胞明显增多,AI明显增高(P<0.05);与I/R组比较,LM+I/R组、HM+I/R组及3-AB+I/R组染色阳性细胞明显减少,AI明显降低(P<0.05)。HM+I/R组与3-AB+I/R组比较差异不显著(P>0.05),见图3。
2米诺环素后处理对大鼠血清TNF-α和IL-1β的影响
与sham组比较,I/R组血清TNF-α和IL-1β含量均明显增高(P<0.05);与I/R组比较,LM+I/R组、HM+I/R组及3-AB+I/R组血清TNF-α和IL-1β含量显著降低(P<0.05);与LM+I/R组比较,HM+I/R组更能显著减小血清TNF-α和IL-1β含量(P<0.05)。HM+I/R组与3-AB+I/R组比较差异无统计学意义,见表1。
3米诺环素后处理对大鼠外周血白细胞PAR表达的影响
与sham组比较, I/R组外周血白细胞内PAR表达明显增高(P<0.05);与I/R组比较,LM+I/R组、HM+I/R组和3-AB+I/R组均能显著减低外周血白细胞内PAR表达(P<0.01);与LM+I/R组比较,HM+I/R组减小外周血白细胞内PAR表达更显著(P<0.05)。HM+I/R组与3-AB+I/R组比较差异无统计学意义,见图4。
4米诺环素后处理对大鼠再灌注心肌PAR表达的影响
与sham组比较, I/R组再灌注心肌内PAR表达显著升高(P<0.05);与I/R组比较,LM+I/R组、HM+I/R组和3-AB+I/R组均能明显减低再灌注心肌内PAR表达(P<0.01);与LM+I/R组比较,HM+I/R组减小再灌注心肌内PAR表达更显著(P<0.05)。HM+I/R组与3-AB+I/R组比较差异无统计学意义,见图5。
讨论
目前认为能量代谢障碍、氧自由基生成增多和细胞内钙超载是I/R损伤发生的主要机制[9-10],以上机制多涉及I/R损伤的上游,其下游更接近细胞死亡的机制仍不十分清楚。PARP-1是一种存在于除酵母外所有真核细胞核内的蛋白酶,对维持细胞染色体稳定、DNA 修复和复制、细胞凋亡和死亡及基因转录起重要作用[11]。研究证实I/R后生成的自由基可以导致DNA断裂, 进而激活PARP-1。PARP-1活化是包括缺血/再灌注、循环休克和系统炎症等各类组织损伤的最终共同效应分子。PARP-1过度活化,一方面,消耗其底物烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+),减低糖酵解、电子传递和三磷酸腺苷(adenosine triphosphate,ATP)形成的速率,同时合成大量PARP活化产物PAR,进而导致细胞功能障碍和死亡;另一方面,PARP-1活化对炎症调节途径起重要的作用[3]。PARP抑制剂即通过干预坏死和炎症使此类疾病获益。

Figure 3.The effects of minocycline postconditioning on the myocardial cell apoptosis in the rats. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsI/R group.
图3米诺环素后处理对大鼠心肌细胞凋亡的影响
研究发现再灌注早期PARP即显著活化,PARP-1活化主要出现在再灌注期,而非缺血期[12],再灌注早期PARP的快速并持续的活化,证明再灌注本身在心肌缺血损伤的基础上进一步加重了心肌的损伤,以上不仅证实了再灌注损伤的存在,而且提示再灌注将引发严重的致死性心肌损害。PARP-1活化为再灌注损伤所特有改变,这更强调了PARP-1活化在再灌注损伤中的作用,并且再灌注后持续高表达的PAR可能与再灌注后心肌梗死范围扩大相关。自从1997年首次报道了PARP抑制剂3-AB通过对心肌PARP活性的抑制减少心肌梗死范围[13],其后,许多对啮齿动物以及大型动物模型的研究进一步证实了不同的PARP抑制剂对缺血和再灌注损伤的心肌有保护作用[11]。Ikai等[14]于1980年对正常人和大鼠外周血内PAR的研究发现,淋巴细胞和单核细胞内存在极少量的PAR表达,而中性粒细胞和嗜酸性粒细胞内未检测到PAR。Murthy等[4]2004年首次报道了大鼠心肌缺血再灌注后外周血白细胞内PAR表达显著增加。人类研究结果也提示血管的再通启动氧化/氮化应激,心肌再灌注干预能产生系统的氧化反应,急诊再血管化患者再灌注早期外周血白细胞内PAR表达显著增高,而慢性心肌缺血择期再血管化患者再灌注早期并未出现PARP-1活化[5]。以上研究再次证实PARP-1活化是急性心肌缺血再灌注后的产物,同时也可能成为致死性再灌注损伤存在的标志。研究发现心肌梗死患者循环血白细胞内PARP-1活化与心梗后系统中增加的炎症因子相关。急性ST段抬高心肌梗死患者应用新型PARP-1抑制剂INO-1001的临床研究提示[15],抑制PARP-1未见明显减少心肌损伤标志物的水平,但能显著降低患者血浆C反应蛋白和炎症标志物白细胞介素6的水平,上述研究揭示了外周血PARP-1活化在心肌缺血再灌注损伤发病过程中的重要作用。

Figure 4.The effects of minocycline postconditioning on poly(ADP-ribose) (PAR) expression in peripheral leukocytes in the rats. Mean±SD.n=12.*P<0.05vssham group;#P<0.05vsI/R group;△P<0.05vsLM+I/R group.
图4米诺环素后处理对大鼠外周血白细胞PAR表达的影响

Figure 5.The effects of minocycline postconditioning on poly(ADP-ribose) (PAR) in the reperfused myocardium in the rats. Mean±SD.n=6.*P<0.05vssham group;#P<0.05vsI/R group;△P<0.05vsLM+I/R group.
图5米诺环素后处理对大鼠再灌注心肌PAR表达的影响
本研究通过结扎大鼠冠状动脉建立心肌I/R损伤模型,对再灌注心肌及外周血白细胞内PARP活化的最终产物PAR及血清中炎症细胞因子TNF-α及IL-1β进行了检测,结果显示再灌注心肌与外周血白细胞中PARP-1同时被激活,提示心肌局部再灌注损伤足以引发系统外周血白细胞内PARP-1的活化,心肌缺血再灌注导致局部心肌产生大量氧化/氮化应激产物,再灌注使血液流经缺血心肌,心肌中持续的自由基和氧化氮化产物引起外周血中单个核细胞内DNA损伤,DNA单链断裂进而导致了PARP的活化,同时早期大量的DNA单链断裂所致的持续未修复状态也可能成为PARP持续活化的基础。循环白细胞内的PARP活化可能进一步介导缺血再灌注损伤的某些系统效应,如炎症介质的产生以及远隔器官的损伤。本研究结果提示外周血白细胞内PARP-1的活化与系统中增高的炎症细胞因子TNF-α及IL-1β相关,抑制PARP-1的活化的同时也明显降低了血清中的炎症细胞因子表达。以往研究显示抑制PARP-1活化能调节前炎症基因和蛋白的活化和表达,其中NF-κB是调节这些蛋白的关键转录因子,PARP-1的缺乏或其药理学抑制能压低NF-κB的活化,抑制前炎症基因的表达[16]。本课题组前期研究进一步发现,再灌注早期外周血白细胞PARP-1活化产物PAR的表达与心肌梗死大小具有相关性,白细胞内PAR表达与心肌PAR表达存在相关性[17]。
在临床上米诺环素主要用于治疗关节炎及其它感染性疾病,近年发现其除抗菌作用外还具有抗炎、抗凋亡、基质金属蛋白酶抑制剂以及氧自由基清除等多效性,因其具有的高度亲脂性和组织中高浓度分布特性而备受关注[7-8],研究发现米诺环素预处理不仅对多种神经系统疾病具有显著的神经保护作用[18],对缺血再灌注损伤肾脏[19]及心肌也有保护作用。然而,在急性缺血性心肌损伤中米诺环素均应用剂量(45~90 mg/kg)较高,是临床常规抗感染、抗炎剂量的30倍,且多采用腹腔注射或经口途径给药,而研究也发现腹腔注射米诺环素会导致药物延迟吸收及腹膜激惹[8],而急性心肌保护中静脉给药途径更能快速达到有效血药浓度进而渗透心肌发挥作用。因此,本研究通过与PARP抑制剂3-AB对比,选择与米诺环素临床应用标准剂量200 mg相当的给药剂量3 mg/kg[8],再灌注前10 min经静脉注射给药,结果显示,低剂量米诺环素后处理能明显改善心肌损伤,表现为显著减少心肌梗死范围,减低再灌注早期心肌细胞的凋亡,其心肌保护机制涉及对心肌和循环PARP-1活性的抑制及对系统炎症反应的调节,即通过抑制再灌注心肌内PARP-1过度活化,减少循环白细胞内PAR表达,进一步减少血清中炎症细胞因子TNF-α及IL-1β的含量,减轻系统的炎症反应,同时也证实低剂量米诺环素足以抑制心脏PARP-1的过度活化,高剂量米诺环素的心肌保护作用优于PARP-1抑制剂3-AB。以上结果提示米诺环素可能作为一种PARP抑制剂安全地应用于临床急性心肌缺血的保护,而外周血白细胞内PARP的过度活化程度可能作为PARP抑制剂药效学监测的标记物。
[参考文献]
[1]Yellon DM, Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med, 2007, 357(11):1121-1135.
[2]Dominguez-Rodriguez A, Abreu-Gonzalez P, Reiter RJ. Cardioprotection and pharmacological therapies in acute myocardial infarction: Challenges in the current era[J]. World J Cardiol, 2014, 6(3):100-106.
[3]Pacher P, Szabó C. Role of poly(ADP-ribose) polymerase 1 (PARP-1) in cardiovascular diseases: the therapeutic potential of PARP inhibitors[J]. Cardiovasc Drug Rev, 2007, 25(3):235-260.
[4]Murthy KG, Xiao CY, Mabley JG, et al. Activation of poly(ADP-ribose) polymerase in circulating leukocytes during myocardial infarction[J]. Shock, 2004, 21(3):230-234.
[5]Tóth-Zsámboki E, Horváth E, Vargova K, et al. Activation of poly(ADP-ribose) polymerase by myocardial ischemia and coronary reperfusion in human circulating leukocytes[J]. Mol Med, 2006, 12(9-10):221-228.
[6]Szabo C, Pacher P, Swanson RA. Novel modulators of poly(ADP-ribose) polymerase[J]. Trends Pharmacol Sci, 2006, 27(12):626-630.
[7]Tao R, Kim SH, Honbo N, et al. Minocycline protects cardiac myocytes against simulated ischemia-reperfusion injury by inhibiting poly(ADP-ribose) polymerase-1[J]. Cardiovasc Pharmacol, 2010, 56(6): 659-668.
[8]Bahrami F, Morris DL, Pourgholami MH. Tetracyclines: drugs with huge therapeutic potential[J]. Mini Rev Med Chem, 2012,12(1):44-52.
[9]郑耀富,殷然,王梦洪,等. 肝X受体通过调控GLUT-4减轻心肌缺血/再灌注损伤[J]. 中国病理生理杂志, 2014, 30(1):18-24.
[10]Frank A, Bonney M, Bonney S, et al. Myocardial ischemia reperfusion injury: from basic science to clinical bedside[J]. Semin Cardiothorac Vasc Anesth, 2012, 16(3):123-132.
[11]Sodhi RK, Singh N, Jaggi AS. Poly(ADP-ribose) polymerase-1 (PARP-1) and its therapeutic implications[J]. Vascul Pharmacol, 2010, 53(3-4):77-87.
[12]Szabó G, Liaudet L, Hagl S, et al. Poly(ADP-ribose) polymerase activation in the reperfused myocardium[J]. Cardiovasc Res, 2004, 61(3):471-480.
[13]Zingarelli B, Cuzzocrea S, Zsengellér Z, et al. Protection against myocardial ischemia and reperfusion injury by 3-aminobenzamide, an inhibitor of poly (ADP-ribose) synthetase[J]. Cardiovasc Res, 1997, 36(2):205-215.
[14]Ikai K, Ueda K, Hayaishi O. Immunohistochemical demonstration of poly(adenosine diphosphate-ribose) in nuclei of various rat tissues[J]. J Histochem Cytochem, 1980, 28(7):670-676.
[15]Morrow DA, Brickman CM, Murphy SA, et al. A rando-mized, placebo-controlled trial to evaluate the tolerability, safety, pharmacokinetics, and pharmacodynamics of a potent inhibitor of poly(ADP-ribose) polymerase (INO-1001) in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention: results of the TIMI 37 trial[J]. J Thromb Thrombolysis, 2009, 27(4):359-364.
[16]Aguilar-Quesada R, Munoz-Gamez JA, Martin-Oliva D, et al. Modulation of transcription by PARP-1: consequences in carcinogenesis and inflammation[J]. Curr Med Chem, 2007, 14(11):1179-1187.
[17]Zhang LQ, Qi GX, Jiang DM, et al.Increased poly(ADP-ribosyl)ation in peripheral leukocytes and the reperfused myocardium tissue of rats with ischemia/reperfusion injury: prevention by 3-aminobenzamide treatment[J]. Shock, 2012, 37(5):492-500.
[18]Li C, Yuan K, Schluesener H. Impact of minocycline on neurodegenerative diseases in rodents: a meta-analysis[J]. Rev Neurosci, 2013, 24(5):553-562.
[19]Xia D, Shen K, Zhong W, et al. Administration of minocycline ameliorates damage in a renal ischemia/reperfusion injury model[J]. Clin Invest Med, 2011, 34(2):E55-E63.
(责任编辑: 林白霜, 罗森)

