ARHI基因抑制U937白血病细胞株生长并诱导其G2/M期阻滞及凋亡
2016-01-12陆英,刘相富,刘玲玲等
ARHI基因抑制U937白血病细胞株生长并诱导其G2/M期阻滞及凋亡*
陆英1△,刘相富1,刘玲玲2,李芳1,覃雪玲1,林东军1, 2△
(中山大学附属第三医院1输血科,2血液科,广东 广州 510630)
[摘要]目的: 探讨抑癌基因ARHI在急性髓细胞白血病中的表达情况,同时探索其对U937细胞生长的影响。方法: RT-PCR方法检测急性髓细胞白血病细胞株、人胚肾细胞293FT、白血病原代细胞以及健康志愿者血细胞中ARHI mRNA的表达情况。构建高表达ARHI的MSCV-IRES-GFP-ARHI 质粒转染U937细胞,MTT法连续8 d检测细胞活性绘制生长曲线。新鲜培养基重悬U937细胞24 h后,采用流式细胞术检测细胞周期以及细胞凋亡。结果: 293FT细胞、健康志愿者血细胞中均检测到ARHI mRNA表达,而白血病细胞株以及白血病患者原代细胞中未检测到该基因的表达。生长曲线显示高表达ARHI基因的U937(U937-ARHI)细胞在第6~8天细胞活力低于对照(U937-GFP)组。高表达ARHI的U937细胞G2/M期细胞比例及细胞凋亡率均高于对照组(P<0.05)。结论: ARHI在急性髓系白血病细胞中的表达减低;高表达ARHI基因能抑制U937细胞生长、阻滞其细胞周期在G2/M期并促进细胞凋亡。
[关键词]ARHI基因; 急性髓细胞白血病; 细胞周期; 凋亡
[中图分类号]R733.72[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.005
[文章编号]1000-4718(2015)11-1956-05
[收稿日期]2015-03-25[修回日期] 2015-09-24
[基金项目]*广东省科技计划(No.2012B031800063);广东省卫生厅基金资助项目(No. B2012111)
通讯作者△Tel: 020-85252230; E-mail: songwangcai@yahoo.com
ARHIgene inhibits cell growth, induces G2/M phase arrest and apoptosis of acute myeloid leukemia cell line U937LU Ying1, LIU Xiang-fu1, LIU Ling-ling2, LI Fang1, QIN Xue-ling1, LIN Dong-jun1, 2
(1DepartmentofBloodTransfusion,2DepartmentofHematology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:xiaolu1196@163.com;lindongjun0168@163.com)
ABSTRACT[]AIM: To investigate the expression of aplasia rashomolog member I (ARHI) gene in acute myeloid leukemia cells (AML) and to study the effects of ARHI on the growth of AML cell line U937.METHODS: The mRNA expression of ARHI in AML cells, 293FT cells, AML primary cells and healthy volunteer blood cells were detected by RT-PCR. After transfection with the MSCV-IRES-GFP-ARHI plasmid to the U937 cells, the growth curve was analyzed by MTT assay. U937 cells were re-suspended by fresh medium and cultured for 24 h, then the cell cycle distribution and apoptotic rate were determined. RESULTS: The mRNA of ARHI was positively detectable in 293FT cells and healthy volunteer blood cells instead of AML cell line and AML primary cells. The growth curve showed that cell viability in U937 cells with high expression of ARHI (U937-ARHI) was lower than that in the control cells (U937-GFP) on 6th~8th day. The ratio of G2/M phase and apoptotic rate in the U937-ARHI cells were increased compare with control group(P<0.05). CONCLUSION: The mRNA level of ARHI is low in AML cells. High expression of ARHI gene in U937 cells inhibits cell growth, arrests the cells at G2/M phase and induces apoptosis.
[KEY WORDS]ARHIgene; Acute myeloid leukemia; Cell cycle; Apoptosis
急性白血病是一种来源于造血干细胞的恶性克隆性疾病,其发病机制涉及到多种因素,其中抑癌基因的失活在白血病发生发展中起重要作用。抑癌基因又称为肿瘤抑制基因,是一类能抑制细胞过度增殖、促进细胞分化从而抑制肿瘤形成的基因,它的丢失或失活可能导致肿瘤发生。目前已经发现多种抑癌基因包括P53、P16、P73、RUNX3等均与白血病的发病有关[1-4]。
ARHI基因定位于人染色体1p31,总长大约8 kb,其中包括2个外显子,1个内含子。ARHI为Ras超家族成员之一,属于小GTP结合蛋白,与Ras、Rap基因有着50%~60%的同源性,但是Ras/Rap家族均存在效应区YDPTIEDSY,而ARHI则拥有独特的基序YLPTIENTY[5]。ARHI基因最早是在1999年由Yu等[6]从卵巢和乳腺上皮细胞及其癌细胞中克隆而来,与大部分Ras超家族成员不同的是,ARHI表现为抑癌基因,目前研究较多的是其在实体肿瘤中的作用,ARHI基因表达缺失与肿瘤进展以及不良预后相关[7-8]。然而ARHI在白血病细胞中的作用尚未见相关报道,本实验将探索ARHI在急性髓细胞白血病(acute myeloid leukemia,AML)中的表达情况及其对细胞生长的影响。
材料和方法
1试剂与仪器
RPMI-1640培养基购自Gibco;胎牛血清购自杭州四季青公司;构建载体所用的酶包括高保真DNA聚合酶、BglII 限制性内切酶、SalI 限制性内切酶、T4 DNA连接酶以及Taq DNA聚合酶均购自TaKaRa;反转录试剂盒以及RT-PCR反应试剂盒购自Thermo;MTT、碘化丙啶以及RNase A购自Sigma。细胞培养箱、PCR仪以及酶标仪购自Bio-Rad;荧光倒置显微镜购自Olympus;流式细胞仪购自BD。
2细胞培养
U937细胞、293FT 细胞为中山大学附属第三医院血液实验室保存细胞;AML原代细胞取自本院血液科患者的骨髓;正常外周血标本取自健康志愿者。U937为悬浮细胞,接种于含10%新生牛血清的RPMI-1640培养基中,置37 ℃、5% CO2、饱和湿度的培养箱中传代培养,2~3 d换液1次。293FT 细胞系为贴壁细胞,培养于含有 10% 四季青血清的 DMEM 培养基中,置于37 ℃、5% CO2、饱和湿度细胞培养箱中培养,2 d传代1次。
3方法
3.1全长基因的扩增查找GenBank里ARHI基因的编码序列,mRNA开放编码阅读框ORF:其编码氨基酸的CDS为295~985。设计引物扩增编码蛋白质序列基因全长。上游引物序列为5’-CCAGATCTATGGGTAACGCCAGCTTTGGCT-3’,下游引物序列为5’-GGCCCGTCGACTCACATGATTATGCACTTG-3’,酶切位点前面设置保护碱基。
3.2反转录及RT-PCR利用 TRIzol 法提取白血病细胞株以及原代细胞的RNA,按照反转录试剂盒说明书合成 cDNA。然后利用PCR扩增ARHI基因(690 bp)。 反应条件为95 ℃ 5 min; 95 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸 10 min。
3.3MSCV-IRES-GFP-ARHI载体的构建双酶切PCR产物和MSCV-IRES-GFP质粒,酶连反应获取目的质粒,通过转化、挑克隆以及摇菌扩增质粒。
3.4构建稳定高表达ARHI的细胞株提取MSCV-IRES-GFP-ARHI 重组载体质粒,pKat质粒以及pVSV-G质粒。将293FT 细胞以适宜的密度接种于培养皿中。待细胞密度达90%左右时进行包装;利用Lipofectamine 2000将上述3种质粒以一定比例混合共转染293FT 细胞;16~18 h 后换为新鲜培养基;24和48 h后分别收集上清。感染U937细胞,使用荧光显微镜观察绿色荧光细胞;继续培养至细胞数达到1×107/L,进行流式分选出带GFP的细胞。转染了MSCV-IRES-GFP的细胞简称为U937-GFP细胞,转染了MSCV-IRES-GFP-ARHI的细胞简称为U937-ARHI细胞。
3.5细胞生长曲线测定取生长良好的细胞,用新鲜培养基制成细胞悬液,接种于96孔板,每孔的细胞为500个。24 h 后用MTT法检测活细胞数,设5个复孔,每孔加入5 g/L的MTT 20 μL,细胞培养4 h,加DMSO后,用酶标仪在490 nm波长处检测。以后每隔24 h 检测1次,连续计数 8 d,然后绘制生长曲线。
3.6细胞周期检测采用流式细胞术检测细胞周期,将U937-GFP和U937-ARHI细胞用新鲜培养基重悬后接种于6孔板,每孔细胞数为5×105/L,每种细胞设置3个复孔,培养24 h后收集细胞,用碘化丙啶(propidium iodide,PI)染色法测定细胞周期。
4统计学处理
SPSS 16.0软件进行统计学分析,数据用均数±标准差(mean±SD)表示。两组间的比较用t检验。以P<0.05为差异有统计学意义。
结果
1白血病细胞中ARHI mRNA的表达水平
本研究用RT-PCR法检测人胚肾细胞293FT以及AML细胞株U937、HL-60、NB4中的ARHI mRNA表达情况,琼脂糖电泳结果显示293FT细胞有ARHI mRNA的表达,HL-60、U937以及NB4 3种AML细胞株中未检测到ARHI mRNA表达;此外,3例AML患者的血标本也未检测到ARHI mRNA表达,而在志愿者血细胞中有表达,见图1、表1。结果提示ARHI基因表达可能与白血病发病有关,因此本研究构建了高表达ARHI的U937细胞株,观察此基因对白血病细胞生长的影响。
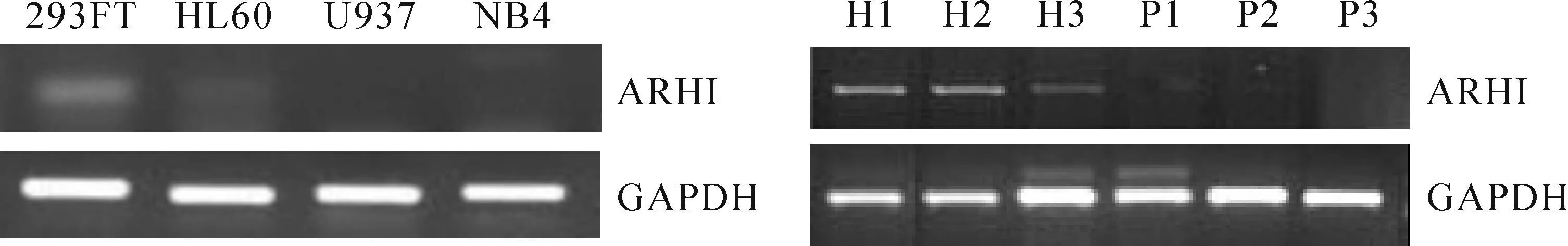
Figure 1.The mRNA level of ARHI in 293FT cells, leukemia cell lines, AML primary cells and healthy volunteer blood cells. H: healthy volunteer blood cells; P: AML primary cells.
图1293FT细胞、白血病细胞株、AML原代白血病细胞以及健康志愿者外周血中ARHI mRNA的表达情况

表1 患者的一般资料
2MSCV-IRES-GFP-ARHI质粒的验证
利用BglⅡ以及SalⅠ双酶切质粒,琼脂糖跑胶可见620 bp的ARHI基因以及MSCV-IRES-GFP载体。同时对目的基因进行完整测序,使用 Blast 软件进行序列比对,验证结果相符,见图2。

Figure 2.ARHIwas linked to MSCV-IRES-GFP plasmid.
图2双酶切验证ARHI连接至MSCV-IRES-GFP载体
3稳定高表达ARHI的U937细胞株的鉴定
经慢病毒感染的U937细胞,进行流式细胞仪分选出带GFP 细胞。在荧光显微镜下可以观察到绿色荧光细胞(图3);提取U937-GFP、U937-ARHI细胞总 RNA,反转录后进行RT-PCR 检测,可见U937-ARHI细胞高表达ARHI基因(图4)。

Figure 3.Images of U937 cells infected with MSCV-IRES-GFP or MSCV-IRES-GFP-ARHI under fluorescence microscope (×200).
图3慢病毒转染的U937细胞中可见绿色荧光

Figure 4.The mRNA level of ARHI in U937-GFP cells and U937-ARHI cells.
图4U937-GFP和U937-ARHI细胞中ARHI mRNA的表达水平
4细胞的生长曲线
将U937-GFP细胞和U937-ARHI细胞培养8 d,每天用MTT法检测细胞活性,结果如图5所示,第1~5天2种细胞活性相似,然而第6~8天,U937-GFP的细胞活性明显高于U937-ARHI细胞(P<0.05)。
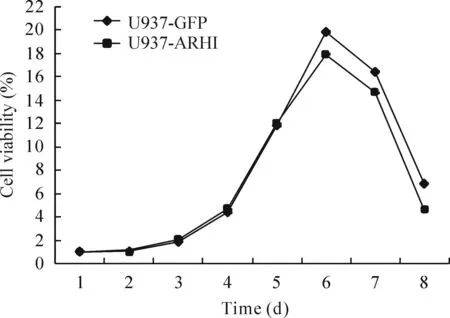
Figure 5.The growth curve of U937-GFP cells and U937-ARHI cells. Mean±SD.n=3.*P<0.05vsU937-GFP.
图5U937-GFP细胞以及U937-ARHI细胞的生长曲线
5细胞周期检测
相同数量的U937-GFP细胞和U937-ARHI细胞经新鲜培养基重悬,在6孔板培养24 h后用流式细胞术测定其细胞周期,结果显示U937-ARHI细胞G2/M期的比例高于U937-GFP,说明ARHI基因可以使细胞阻滞在G2/M期,另外,U937-ARHI细胞的凋亡率高于U937-GFP细胞,见图6、表2。

Figure 6.The cell cycle distribution of U937-GFP cells and U937-ARHI cells. Mean±SD.n=3.
图6U937-GFP和U937-ARHI的细胞周期及凋亡

表2 U937-GFP和U937-ARHI细胞的周期以及凋亡率
*P<0.05vsU937-GFP.
讨论
ARHI又名DIRAS3、NOEY2基因,是1999年发现的母源性印迹抑癌基因。基因印迹是指来自父方和母方的等位基因在通过精子和卵子传递给子代时发生了修饰,使带有亲代印迹的等位基因具有不同的表达特性,表现为仅一方亲本来源的同源基因表达,而来自另一亲本的不表达。在正常细胞中,母源性的ARHI等位基因上发生CpG岛甲基化修饰,使其转录活性受到抑制,而父源性的等位基因不受修饰,从而能够在子代中表达[9]。
自1999年美国德克萨斯大学Andesron癌症中心的科研团队发现ARHI基因后,其生物学功能以及与肿瘤的关系得到广泛研究,研究最多的是其在卵巢癌以及乳腺癌中的作用。ARHI在人体多种组织中均有表达,其中正常卵巢的表达最高[6],在正常卵巢组织中ARHI mRNA 表达率为100%,在卵巢癌组织中表达水平下调,Yu等[6]科研团队利用实时荧光定量PCR的方法对40例卵巢癌患者手术组织标本进行研究发现ARHI基因表达缺失率达88%[10]。此外,研究发现ARHI基因表达缺失还与卵巢癌瘤进展以及不良预后相关[8]。同样,在正常乳腺组织中均存在ARHI mRNA表达,而乳腺癌组织中表达下调或缺失,提示ARHI在乳腺癌发病过程中起重要作用[11]。近年来陆续有研究发现,ARHI在其它实体肿瘤中也存在异常表达,Yang等[12]研究发现在正常胰腺组织中,ARHI表达位于导管上皮,腺泡细胞和胰岛细胞在胰腺癌组织中表达缺失率为50%。另外,在肝癌、胃癌、甲状腺癌等肿瘤中也发现ARHI的作用[13-15]。
ARHI在实体肿瘤中的研究报道显示其对肿瘤的发生发展起着重要作用,那么其在血液系统肿瘤中的作用如何呢,本研究首先用RT-PCR法检测了ARHI mRNA在正常上皮细胞株293FT以及AML细胞株中的表达情况,结果显示在293FT细胞中可检测到ARHI,而在U937、HL-60、NB4中未检测到它的表达。此外,本研究比较了健康志愿者以及AML患者外周血标本中ARHI mRNA的表达情况,3例志愿者的血标本中可检测到ARHI mRNA,而AML原代细胞中并无表达,由于样本量少,本文没法做出准确的统计分析,但是这个结果提示了ARHI基因在白血病原代细胞中表达减少,这和实体肿瘤的结果是一致的[10-11]。
发现ARHI基因在白血病细胞中表达减少后,本研究进一步观察了此基因对白血病发病以及发展的可能影响。目前已经发现的ARHI基因主要有以下生物学功能。(1)抑制细胞增殖:Xu等[16]在2000年建立一个高表达ARHI的转基因鼠模型,发现子代鼠的体重明显低于正常鼠,且子代鼠体重降低程度与ARHI基因表达水平相关,说明该基因在鼠科动物的生长发育过程中是一个负性调控因子。进一步研究发现高表达ARHI的转基因鼠体重降低与泌乳素水平降低有关。除了正常细胞外,研究发现ARHI基因能够抑制多种肿瘤细胞的增殖,包括卵巢癌[5]、乳腺癌[17]、胰腺癌[18]等。(2)参与调控细胞周期:细胞周期是指连续分裂的细胞,从一次完成分裂开始,到下一次完成分裂为止的过程。一般分为分裂间期和分裂期2个阶段。用流式细胞仪检测细胞周期分裂期分为G1、S、G2/M 3个阶段。研究发现ARHI基因可以使不同的肿瘤细胞阻滞在不同的细胞周期。在胰腺癌细胞中的过表达ARHI可诱导G1期细胞周期阻滞,其机制为磷酸化蛋白激酶Akt水平降低导致P53蛋白积聚,从而上调细胞周期蛋白依赖性激酶抑制因子P21WAF1使细胞周期阻滞在G1[17]。另有研究表明高表达ARHI基因可以使卵巢癌细胞SKOV3阻滞在S期,其机制可能与磷酸化信号转导及转录激活因子以及磷酸化细胞外调节蛋白激酶水平降低有关[18]。此外DNA 去甲基化试剂和/或组蛋白去乙酰化酶抑制剂可以在卵巢癌 Hey 和 SKOv3 中诱导ARHI表达而造成G2/M 期阻滞[19]。(3)促进细胞凋亡:有研究发现将高表达ARHI基因腺病毒载体的液体注射到无ARHI表达的裸鼠乳腺癌及卵巢癌模型中,发现部分乳腺癌以及卵巢癌出现明显的细胞凋亡,进一步研究发现其机制可能与calpain蛋白酶和钙蛋白酶介导的凋亡信号转导有关[20]。在胰腺癌细胞系中再表达ARHI基因后,凋亡细胞比例增加,此作用与ARHI基因下调NF-κB通路有关[21]。(4)诱导细胞自噬:有研究发现ARHI是一个新的能调控细胞自噬的基因,其能够诱导细胞自噬[22]。
基于以上ARHI的生物学功能,本研究检测了该基因对AML细胞的生长、细胞周期以及细胞凋亡的影响。实验构建了高表达ARHI基因的U937细胞株(U937-ARHI),连续8 d检测了细胞的生长情况,结果显示,在生长曲线的前期2组细胞的活性相似,然而至生长曲线的后期(6~8 d),U937 -ARHI细胞活性低于U937-GFP细胞,两者差异有统计学意义,说明ARHI基因能够抑制U937的生长,此结果与该基因在实体肿瘤中的作用一致[5, 17]。进一步的实验发现ARHI基因可以使U937细胞阻滞在G2/M期从而影响细胞的有丝分裂。凋亡相关检测也表明转染了ARHI基因的U937细胞的凋亡率大于对照组细胞。从凋亡率的数值分析看,U937-GFP细胞的基础凋亡率非常低,仅为0.02%,在转染了ARHI基因后,虽然凋亡率大大增加到1.19%,但是数量仍然很低,这也解释了为什么生长曲线中前5天2种的细胞活性无差异,直至第6天当凋亡以及周期阻滞的细胞积累到一定数量后,两者才出现活性细胞数量的差异。
本研究观察了ARHI在AML细胞中的表达情况,结果表明,ARHI mRNA在白血病细胞中的表达少于正常细胞,进一步构建高表达ARHI的U937细胞发现,ARHI能够抑制白血病细胞的生长,其作用机制可能与其阻滞细胞周期在G2/M期以及促进细胞凋亡有关。下一步的实验将收集更多的急性白血病原代细胞标本,检测ARHI mRNA和ARHI蛋白的表达情况,做更进一步的统计分析,在此基础上,研究ARHI在白血病细胞中表达减少的可能原因。根据ARHI在实体肿瘤中的研究报道,ARHI基因失活的原因主要为杂合性缺失以及甲基化。ARHI是一种印迹基因,虽然其母源性等位基因不表达,但其父源性等位基因能够转录、翻译出具有正常功能的蛋白质。乳腺癌以及卵巢癌细胞中均存在ARHI父源性等位基因的杂合性缺失[23]。抑癌基因甲基化在肿瘤中多有报道,本课题组既往的研究亦发现RUNX3基因、p53基因在白血病中存在甲基化现象[4,24]。ARHI是新近发现的新的抑癌基因,其启动子区域存在2个CpG岛,CpG岛I和II,第3个CpG岛位于蛋白编码区域[25]。在卵巢癌、乳腺癌以及胰腺癌等肿瘤中均发现有ARHI基因的甲基化[18, 26]。 如果其在白血病细胞中也存在基因甲基化现象,那么ARHI基因将成为去甲基化药物治疗白血病的又一作用靶点。
[参考文献]
[1]Dohner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia[J]. New Eng J Med, 2000, 343(26):1910-1916.
[2]Wenming C, Jiazhi Z, Shuzhen T, et al. Inactivation ofp16 gene in leukemia[J]. Chin Med Sci J, 1999, 14(4):206-210.
[3]Kawano S, Miller CW, Gombart AF, et al. Loss of P73 gene expression in leukemias/lymphomas due to hypermethylation[J]. Blood, 1999, 94(3):1113 -1120.
[4]范蕊芳,方志刚,刘相富,等. 急性白血病患者骨髓细胞中TIMP3、 RUNX3蛋白表达情况检测及其临床意义[J]. 中国病理生理杂志, 2010, 26(2):293-296.
[5]Luo RZ, Fang X, Marquez R, et al. ARHI is a Ras-related small G-protein with a novel N-terminal extension tha inhibits growth of ovarian and breast cancer[J]. Oncogene, 2003, 22(19):2897-2909.
[6]Yu Y, Xu F, Peng H, et al. NOEY2 (ARHI), an imprinted putative tumor suppressor gene in ovarian and breast carcinomas[J]. Proc Natl Acad Sci U S A, 1999, 96(1):214-219.
[7]Rosen DG, Wang L, Jain AN, et al. Expression of the tumor suppressor geneARHIin epithelial ovarian cancer is associated with increased expression of p21WAF1/CIP1and prolonged progression-free survival[J]. Clin Cancer Res, 2004, 10(19):6559-6566.
[8]Lu Z, Luo RZ, Peng H, et al. Transcriptional and posttranscriptional down-regulation of the imprinted tumor suppressor gene ARHI (DRAS3) in ovarian cancer[J]. Clin Cancer Res, 2006, 12(8):2404-2413.
[9]Fujii S, Luo RZ, Yuna J, et al. Reactivation of the silenced and imprinted alleles of ARHI is associated with increased histone H3 acetylation and decreased histone H3 lysine 9 methylation[J]. Hum Mol Genet, 2003, 12(15):1791-1800.
[10]Feng W, Marquez RT, Lu Z, et al. Imprinted tumor suppressor genes ARHI and PEG3 are the most frequently down-regulated in human ovarian cancers by loss of heterozygosity and promoter methylation[J]. Cancer, 2008, 112(7):1489-1502.
[11]Hisatomi H, Nagao K, Wakita K, et al. ARHI/NOEY2 inactivation may be important in breast tumor pathogenesis[J]. Oncology, 2002, 62(2):136-140.
[12]Yang H, Lu X, Qian J, et al. Imprinted tumor suppressor geneARHIinduces apoptosis correlated with changes in DNA methylation in pancreatic cancer cells[J]. Mol Med Rep, 2010, 3(4):581-587.
[13]Huang J, Lin Y, Li L, et al. ARHI, as a novel suppressor of cell growth and downregulated in human hepatocellular carcinoma, could contribute to hepatocarcinogenesis[J]. Mol Carcinog, 2009, 48(2):130-140.
[14]Wang W, Bu XM, Wang J, et al. The expression of ARHI in pT2a and pT2b stage gastric cancer and its clinical significance[J]. Oncol Rep, 2012, 27( 6) : 1953-1959.
[15]Weber F, Aldred MA, Morrison CD, et al. Silencing of the maternally imprinted tumor suppressor ARHI contributes to follicular thyroid carcinogenesis[J]. J Clin Endocrinol Metabolism, 2005, 90(2):1149-1155.
[16]Xu F, Xia W, Luo RZ, et al. The Human ARHI tumor suppressor gene inhibits lactation and growth in transgenic mice[J]. Cancer Res, 2000,60(17):4913-4920.
[17]Lu X, Qian J, Yu Y, et al. Expression of the tumor suppressor ARHI inhibits the growth of pancreatic cancer cells by inducing G1cell cycle arrest[J]. Oncol Rep, 2009, 22( 3):635-640.
[18]Zhu Q, Hu J, Meng H, et al. S-phase cell cycle arrest, apoptosis, and molecular mechanisms of aplasia ras homolog member I induced human ovarian cancer SKOV3 cell lines[J]. Int J Gynecol Cancer, 2014, 24(4):629-634.
[19]Chen MY, Liao WL, Lu Z, et al. Decitabine and suberoylanilide hydroxamic acid ( SAHA) inhibit growth of ovarian cancer cell lines and xenografts while inducing expression of imprinted tumor suppressor genes, apoptosis, G2/M arrest, and autophagy[J]. Cancer, 2011, 117(19):4424-4438.
[20]Bao JJ, Le XF, Wang RY, et al. Reexpression of the tumor suppressor geneARHIinduces apoptosis in ovarian and breast cancer cells through a caspase-independent calpain-dependent pathway[J]. Cancer Res, 2002, 62(24):7264 -7272.
[21]Hu YQ, Si LJ, Ye ZS, et al. Inhibitory effect of ARHI on pancreatic cancer cells and NF-κB activity[J]. Mol Med Rep, 2013, 7(4):1180-1184.
[22]Lu Z, Luo RZ, Lu Y, et al. The tumor suppressor geneARHIregulates autophagy and tumor dormancy in human ovarian cancer cells[J]. J Clin Invest, 2008, 118 (12):3917-3929.
[23]Peng H, Xu F, Pershad R, et al. ARHI is the center of allelic deletion on chromosome 1 p31 in ovarian and breast cancers[J]. Int J Cancer, 2000, 86( 5): 690-694.
[24]林东军,郑永江,方志刚,等. 急性白血病p53基因P1启动子区域DNA甲基化研究[J]. 中国病理生理杂志, 2008, 24(7):1327-1330.
[25]Luo RZ, Peng H, Xu F, et al. Genomic structure and promoter characterization of an imprinted tumor suppressor geneARHI[J]. Biochim Biophys Actas, 2001, 1519(3):216-222.
[26]Yuan J, Luo RZ, Fujii S, et al. Aberrant methylation and silencing of ARHI, an imprinted tumor suppressor gene in which the function is lost in breast cancers[J]. Cancer Res, 2003, 63(14):4174-4180.
(责任编辑: 林白霜, 余小慧)

