抑制白血病K562细胞FoxM1表达可增强细胞对高三尖杉酯碱的敏感性
2016-01-12陈谨,周敏然,孙婷等
抑制白血病K562细胞FoxM1表达可增强细胞对高三尖杉酯碱的敏感性*
陈谨1,周敏然2,孙婷2,秦雪梅2,陈忠敏3,陈春燕2,于媛2△
(1安徽医学高等专科学校,安徽 合肥 230601;2山东大学齐鲁医院血液科,山东 济南 250012;3重庆理工大学药学与生物工程学院, 重庆400054)
[摘要]目的: 探讨抑制白血病K562细胞叉头框蛋白M1(FoxM1)是否增强细胞对高三尖杉酯碱(HHT)的敏感性。方法: HHT以不同浓度(0、0.015、0.030和0.045 μmol/L)和最低起效浓度不同时间(0.015 μmol/L,0、24、48和72 h)作用于K562细胞,real-time PCR和Western blot检测FoxM1 mRNA和蛋白表达;以0.015 μmol/L HHT作用K562细胞后转染FoxM1 siRNA,观察沉默K562细胞FoxM1后细胞对HHT的敏感性、细胞增殖和凋亡效应以及FoxM1相关靶分子c-Myc和Sp1表达状况。结果: 随着HHT浓度增加和时间延长FoxM1表达逐渐降低,说明HHT抑制K562细胞FoxM1表达;HHT处理K562细胞后转染FoxM1 siRNA,细胞生长和克隆形成显著下降,细胞凋亡增加,因此抑制FoxM1可增加K562细胞对HHT的敏感性;FoxM1 siRNA组c-Myc和Sp1表达显著降低,表明FoxM1可正性调控c-Myc和Sp1表达。结论: HHT可以抑制白血病K562细胞FoxM1表达,干扰FoxM1可增强细胞对HHT的敏感性。
[关键词]三尖杉酯碱; 叉头框蛋白M1; K562细胞; 药物敏感性
[中图分类号]R363.2[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.002
[文章编号]1000-4718(2015)11-1933-10
[收稿日期]2014-12-29[修回日期] 2015-08-14
[基金项目]*广州市属高校重点学科建设经费资助项目(穗教高教[2011]34号)
通讯作者△Tel: 020-84271652; E-mail: xuxia503@126.com
Inhibition of FoxM1 sensitizes leukemia K562 cells to homoharringtonineCHEN Jin1, ZHOU Min-ran2, SUN Ting2, QIN Xue-mei2, CHEN Zhong-min3, CHEN Chun-yan2, YU Yuan2
(1AnhuiMedicalCollege,Hefei230601,China;2DepartmentofHematology,QiluHospital,ShandongUniversity,Jinan250012,China;3SchoolofPharmacyandBioengineering,ChongqingUniversityofTechnology,Chongqing400054,China.E-mail:yuyuandoctor@163.com)
ABSTRACT[]AIM: To study whether inhibition of forkhead box protein M1(FoxM1) sensitizes leukemia K562 cells to homoharringtonine (HHT). METHODS: K562 cells were incubated with HHT at different concentrations (0 μmol/L, 0.015 μmol/L, 0.030 μmol/L and 0.045 μmol/L) for different time (0 h, 24 h, 48 h and 72 h). The mRNA and protein levels of FoxM1 were detected by real-time PCR and Western blot. FoxM1 siRNA was transfected into K562 cells with 0.015 μmol/L HHT after 6 h. After 72 h incubation, the cell proliferation was detected by cell counting and soft agar assay, and the proportion of apoptotic K562 cells was determined by flow cytometry. The expression of c-Myc and Sp1 were detected by real-time PCR and Western blot. RESULTS: FoxM1 expression was reduced time-dependently and dose-dependently, suggesting that HHT mediated the downregulation of FoxM1 in K562 cells. In K562 cells, treatment with FoxM1 siRNA and HHT inhibited the cell proliferation and promoted the apoptosis significantly. Therefore, inhibition of FoxM1 sensitized leukemia K562 cells to HHT. The expression of c-Myc and Sp1 was positively regulated by FoxM1. CONCLUSION: HHT inhibits Forkhead box protein M1 expression in K562 cells. Inhibition of FoxM1 sensitizes K562 cells to HHT.
[KEY WORDS]Homoharringtonine; Forkhead box protein M1; K562 cells; Drug sensitivity
慢性粒细胞白血病(chronic myelogenous leukemia,CML)是起源于多能造血干细胞的恶性克隆增殖性疾病,包含恶性程度递增的慢性期、加速期和急变期。CML一旦进入急变期,细胞增殖加快、分化受阻,骨髓和外周血中不成熟细胞大量积聚,对靶向抑制BCR/ABL酪氨酸激酶活性的伊马替尼等治疗反应差,病情恶化,预后不佳。研究表明CML在急变演进过程中分子调控方式发生了改变,其中涉及不依赖BCR/ABL的复杂调控过程[1-2]。
高三尖杉酯碱(homoharringtonine, HHT)是我国从三尖杉属植物中分离出的抗肿瘤生物碱, HHT通过不依赖于BCR/ABL机制,对于CML加速期和急变期,以及对伊马替尼等酪氨酸激酶抑制剂耐药的CML患者也有效[3-6]。然而,HHT有较强的心脏、骨髓抑制、高血糖等毒副作用,临床用药受限,因此发现与HHT具有协同作用的增敏分子可降低HHT的临床有效用药剂量,是提高HHT药物效应的重要策略。HHT属于细胞周期特异性药物,叉头框蛋白M1(forkhead box protein M1, FoxM1)是叉头基因转录因子家族成员,主要通过调控细胞周期相关分子转录介导细胞增殖,参与肿瘤发生[7],抑制FoxM1可提高实体瘤细胞对化疗药物敏感性[8-11]。FoxM1和HHT都可以调控细胞周期,靶向干预FoxM1表达是否可以协同增敏HHT抗白血病效应未见报道,我们以慢性髓系白血病急变期细胞系K562为模型,研究抑制K562细胞FoxM1表达是否可以增强HHT的药物敏感性,为提高HHT治疗CML急变的临床疗效提供初步实验性线索。
材料和方法
1主要试剂
HHT购自山东大学齐鲁医院,生产厂家杭州民生药业有限公司。白血病细胞系K562购自山东省医学科学院。FoxM1 siRNA和对照siRNA购自Sigma。FoxM1 siRNA序列为5’-GACAACUGUCAAGUGUACCACUCUU-3’,对照 siRNA序列为5’-CCUACAUCCCGAUCGAUGAUGUUGA-3’。siRNA转染试剂LipofectamineTM2000 reagent和RNA提取相关试剂TRIzol购自Invitrogen;RT试剂盒购自Fermentas;实时荧光定量PCR试剂盒购自TaKaRa;PCR引物由上海博尚生物技术有限公司合成。Western blot试剂包括30%丙烯酰胺溶液、5×上样缓冲液、SDS、Tris、甘氨酸等购自北京索莱宝科技有限公司。FoxM1抗体购自美国Santa Cruz。ECL化学发光检测试剂盒购自Millipore。凋亡检测试剂盒购自南京百奥生物科技有限公司。
2细胞培养
K562细胞系用10% FBS和RPMI-1640培养基,置于37 ℃、5%CO2细胞培养箱中培养。铺板前用多聚赖氨酸处理培养板24 h,铺板18~24 h后进行实验。
3siRNA转染实验
接种1.0×105cells/well于6孔板中,过夜培养至30%~50%的细胞融合度。取脂质体LipofectimineTM2000 5 μL及siRNA 5 μL分别溶于250 μL Opti-MEM中,混匀后室温静置。5 min后将上述2种混合液均匀混合构成转染复合物,室温静置20 min。将转染复合物加入每孔细胞中孵育72 h,收集细胞,进行检测。
4实时荧光定量PCR检测FoxM1 mRNA水平
4.1引物的设计与合成FoxM1上游引物5’-TGCAGCTAGGATGTGAATCTTC-3’,下游引物5’-GGAGCCCAGTCCATCAGAACT-3’;β-actin上游引物5’-AGTTGCGTTACACCCTTTCTTG-3’,下游引物5’-CACCTTCACCGTTCCAGTTTT-3’。
4.2RNA提取与逆转录反应0.5 mL TRIzol处理K562细胞,提取RNA。将1 μg 总RNA、1 μL随机六聚体引物在离心管中混合,补焦碳酸二乙酯(DEPC)水至12 μL,65 ℃保温5 min,置于冰上;每管中再加入4 μL 5×RT缓冲液,2 μL 10 mmol/L dNTP,1 μL RNA酶抑制剂和1 μL M-MLV逆转录酶,小心混匀,PCR仪中按“25 ℃,5 min;42 ℃,60 min;70 ℃,5 min”的程序处理样品,获得cDNA。
4.3实时荧光定量PCR 将cDNA按照1∶5的比例进行稀释;建立PCR体系后,在实时荧光定量PCR仪上按程序“95 ℃ 10 s;95 ℃ 5 s,60 ℃ 31 s,40个循环”进行PCR。
5Western blot检测FoxM1蛋白水平
提取细胞总蛋白并测定总蛋白浓度;进行聚丙烯酰氨凝胶电泳,溴酚蓝染料在浓缩胶阶段,电压80 V,约40 min后,染料进入分离胶时,电泳增至120 V,约1.5 h后,当溴酚蓝指示剂刚刚移出凝胶底端时结束电泳;转膜、封闭、加入I抗(FoxM1 I抗:1∶500;β-actin I抗:1∶8 000);4 ℃孵育过夜、回收I抗;TBST洗膜,10 min×3次;加入II抗、 TBST洗膜,10 min×3次;PBS洗膜,10 min×1次;化学发光试剂盒显色。
6细胞生长曲线实验
将K562细胞用HHT作用后再转染FoxM1 siRNA,转染0 h、24 h、48 h和72 h时分别进行细胞计数,绘制细胞生长曲线。
7软琼脂克隆形成实验
将0.4%上层琼脂与经过不同处理的K562细胞悬液(1 500 cells/well)按照1∶1的比例配制7 mL,混匀后将含有细胞的上层培养基1 mL/well加入已含1%下层琼脂培养基的6孔板内。不同处理的细胞各做3个复孔。室温静置约10 min,待琼脂凝固后,置于37 ℃、5% CO2细胞培养箱中孵育。约15 d后观察白色致密不透光的细胞团。
8流式细胞术检测细胞凋亡率
收集处理后的K562细胞1×106,冷PBS清洗,将用1×binding buffer重悬的细胞重悬液100 μL放入5 mL流式管中。每管先加入PE标记的5 μL Annexin V,轻轻吹匀后,再加入5 μL 7-AAD,室温避光孵育15 min。每管中再加入400 μL 1×binding buf-fer。用细胞流式仪进行凋亡率检测。
9统计学处理
采用SPSS 13.0统计软件对实验数据进行分析。2组间比较用t检验,多组间的比较采用单因素方差分析,数据用均数±标准差(mean±SD)表示。P<0.05表示差异有统计学意义。
结果
1HHT抑制白血病K562细胞FoxM1表达
以不同浓度(0、0.015、0.030及0.045 μmol/L)HHT作用K562细胞 72 h后, K562细胞中FoxM1表达随着HHT作用浓度增加逐渐降低;以最低起效浓度0.015 μmol/L的HHT作用于K562细胞不同时间(0 h、24 h、48 h和72 h),K562细胞FoxM1表达随着HHT作用时间延长而降低,见图1。以上结果提示HHT可以抑制K562细胞FoxM1表达,且呈浓度与时间依赖性。
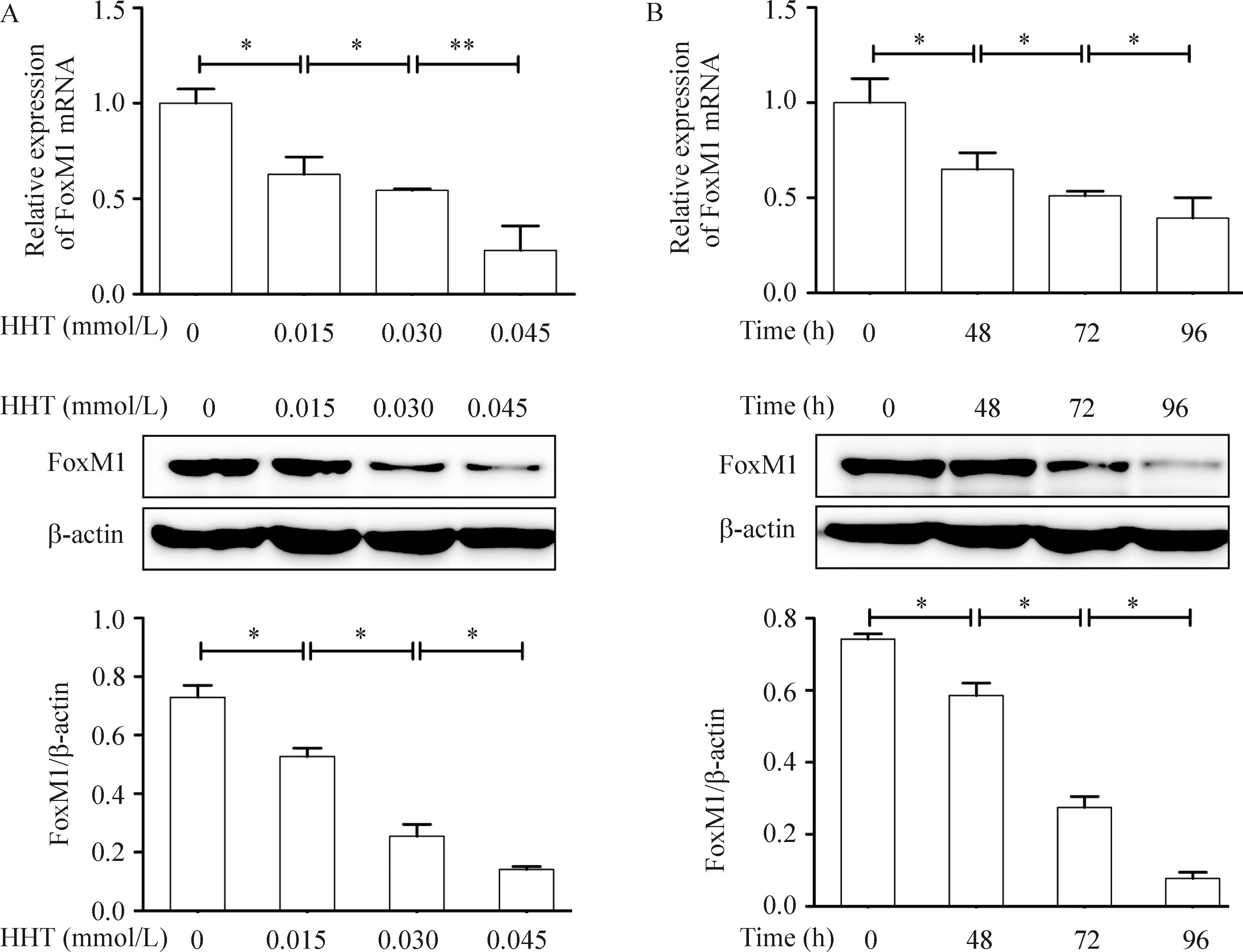
Figure 1.HHT inhibited FoxM1 expression in K562 cells. A: concentration-dependent effect (72 h); B: time-dependent effect (0.15 μmol/L). Mean±SD.n=3.*P<0.05,**P<0.01.
图1HHT抑制K562细胞FoxM1表达
2抑制FoxM1可增强HHT抑制K562细胞的增殖作用
0.015 μmol/L HHT作用K562细胞6 h后再转染FoxM1 siRNA或对照 siRNA, 0 h、24 h、48 h和72 h分别进行细胞计数,绘制细胞生长曲线,结果显示HHT+FoxM1 siRNA组的细胞增殖速率显著降低,见图2A。转染72 h时收集细胞进行软琼脂克隆形成实验,克隆形成能力也显著降低,见图2B。
3抑制FoxM1可增强HHT促K562细胞凋亡作用
将K562细胞用0.015 μmol/L HHT处理6 h后再转染FoxM1 siRNA或对照 siRNA,流式细胞术检测到HHT+FoxM1 siRNA组的细胞凋亡率显著增高,见图2C。
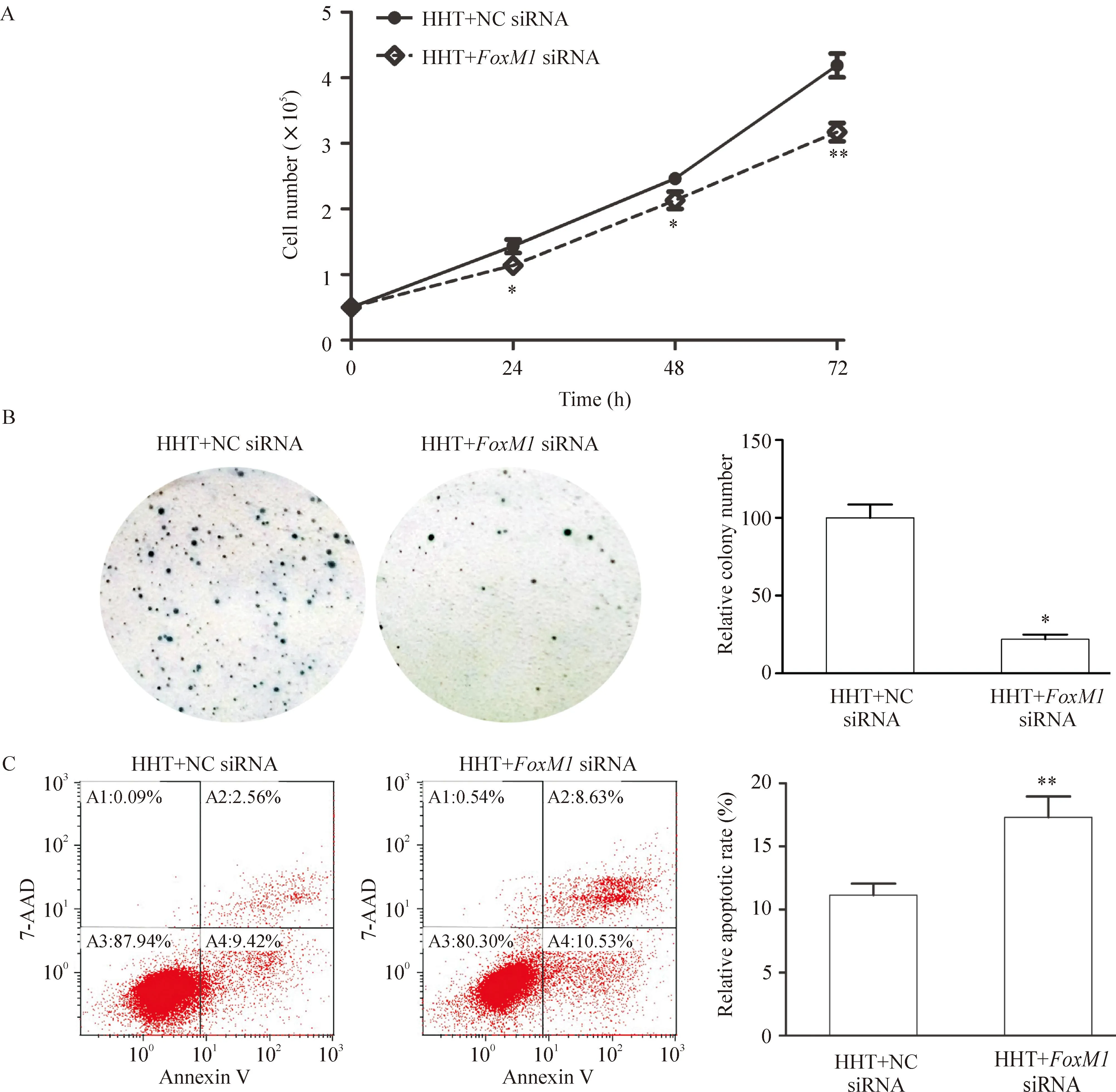
Figure 2.Inhibition of FoxM1 enhanced the proliferation inhibition and apoptosis promotion in K562 cells induced by HHT. A: cell counting; B: soft agar assay; C: flow cytometry. Mean±SD.n=3.*P<0.05,**P< 0.01vsHHT+NC siRNA.
图2抑制FoxM1可增强HHT抑制K562细胞增殖和促K562细胞凋亡的作用
4FoxM1正性调控c-Myc和Sp1表达
当用0.015 μmol/L HHT处理K562细胞6 h后再转染FoxM1 siRNA或对照 siRNA,HHT+FoxM1 siRNA组FoxM1、c-Myc 和Sp1 的mRNA和蛋白表达也显著降低,见图3。

Figure 3.FoxM1 combined with HHT positively regulated the expression of c-Myc and Sp1. Mean±SD.n=3.*P<0.05,**P<0.01vsHHT+NC siRNA.
图3FoxM1联合HHT正性调控K562细胞c-Myc和Sp1表达
讨论
CML的急变发生机制复杂,不依赖BCR/ABL机制参与其中,涉及多种癌基因、抑癌基因和转录因子等网络调控过程,分子间相互作用,共同促进CML急变[2]。
已有文献报道FoxM1与实体瘤细胞对化疗药物敏感性或耐受性相关,FoxM1过表达可增强肝癌细胞对TNF-α诱导的凋亡耐受性[9],抑制FoxM1通过下调DNA修复基因Rad51增加恶性胶质瘤细胞对抗肿瘤药替莫唑胺的敏感性[10],FoxM1敲除可增加肿瘤细胞对蛋白酶体抑制剂的敏感性,促进细胞凋亡[11]。
K562细胞系是从慢性粒细胞白血病(急变期)患者建立的红白血病细胞株,在本研究中,观察到随着HHT作用浓度增加或作用时间延长,K562细胞中FoxM1表达逐渐降低,说明HHT可以抑制K562细胞FoxM1的表达,并且呈浓度和时间依赖性。用低剂量HHT作用K562细胞后,再转染FoxM1 siRNA,观察到FoxM1 siRNA与HHT协同作用导致K562细胞生长抑制、细胞凋亡率增高,说明抑制K562细胞FoxM1表达可协同增敏HHT药理效应。
c-Myc是Myc转录因子家族的一员,FoxM1可以直接作用于c-Myc的启动子区,促进其转录表达,FoxM1也作为c-Myc的直接下游靶基因,部分介导c-Myc对细胞增殖的促进功能[11-12]。研究发现FoxM1可以与转录因子Sp1协同转录激活c-Myc,而Sp1也可转录激活FoxM1和c-Myc,在肿瘤细胞发生发展中发挥作用[12-13]。本研究中在用HHT处理K562细胞后再转染FoxM1 siRNA,观察到FoxM1表达显著降低的同时,c-Myc和Sp1表达也均降低,表明FoxM1正性调控c-Myc和Sp1表达,进而影响细胞增殖与凋亡,在其与HHT的协同增敏中发挥作用。
综上所述,靶向干预K562细胞FoxM1则增强细胞对HHT药物敏感性,提示FoxM1抑制剂或siRNA可以协同HHT药理效应的发挥,此为HHT应用于CML急变治疗提供了可借鉴的实验性初步线索。
[参考文献]
[1]Hehlmann R. How I treat CML blast crisis[J]. Blood, 2012,120(4):737-747.
[2]Perrotti D, Jamieson C, Goldman J, et al. Chronic myeloid leukemia: mechanisms of blastic transformation[J]. J Clin Invest, 2010,120(7):2254-2264.
[3]Wetzler M, Segal D. Omacetaxine as an anticancer therapeutic: what is old is new again[J]. Curr Pharm Des, 2011,17(1):59-64.
[4]Cortes J, Digumarti R, Parikh PM, et al. Phase 2 study of subcutaneous omacetaxine mepesuccinate for chronic-phase chronic myeloid leukemia patients resistant to or intolerant of tyrosine kinase inhibitors[J]. Am J Hematol, 2013,88(5):350-354.
[5]Cortes J, Lipton JH, Rea D, et al. Phase 2 study of subcutaneous omacetaxine mepesuccinate after TKI failure in patients with chronic-phase CML with T315I mutation[J]. Blood, 2012,120(13):2573-2580.
[6]Khoury HJ, Cortes J, Baccarani M, et al. Omacetaxine mepesuccinate in patients with advanced chronic myeloid leukemia with resistance or intolerance to tyrosine kinase inhibitors[J].Leuk Lymphoma,2015,56(1):120-127.
[7]Wierstra I. The transcription factor FOXM1 (Forkhead box M1): proliferation-specific expression, transcription factor function, target genes, mouse models, and normal biological roles[J]. Adv Cancer Res, 2013,118:397-398.
[8]Monteiro LJ, Khongkow P, Kongsema M, et al. The Forkhead Box M1 protein regulates BRIP1 expression and DNA damage repair in epirubicin treatment[J]. Oncogene,2013,32(39):4634-4645.
[9]Xia L, Mo P, Huang W, et al. The TNF-α/ROS/HIF-1-induced upregulation of FoxM1 expression promotes HCC proliferation and resistance to apoptosis[J]. Carcinogenesis, 2012,33(11):2250-2259.
[10]Zhang N,Wu X,Yang L, et al. FoxM1 inhibition sensitizes resistant glioblastoma cells to temozolomide by downregulating the expression of DNA-repair geneRad51[J]. Clin Cancer Res, 2012,18(21): 5961-5971.
[11]Pandit B, Gartel AL. FoxM1 knockdown sensitizes human cancer cells to proteasome inhibitor-induced apoptosis but not to autophagy[J]. Cell Cycle, 2011,10(19):3269-3273.
[12]Li D, Wei P, Peng Z, et al. The critical role of dysregulated FOXM1-PLAUR signaling in human colon cancer progression and metastasis[J]. Clin Cancer Res, 2013, 19 (1):62-72.
[13]Petrovic V, Costa RH, Lau LF, et al. Negative regulation of the oncogenic transcription factor FoxM1 by thiazolidinediones and mithramycin[J]. Cancer Biol Ther, 2010, 9(12):1008-1016.
(责任编辑: 卢萍, 罗森)

