重组人可溶性TRAIL的制备及其联合硼替佐米诱导肿瘤细胞的凋亡作用
2016-01-12李雪燕,徐霞
重组人可溶性TRAIL的制备及其联合硼替佐米诱导肿瘤细胞的凋亡作用*
李雪燕,徐霞△
(广州医科大学金域检验学院,广东 广州 510182)
[摘要]目的: 构建重组人肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)原核表达质粒pET-28a (+)-TRAIL114-281,优化蛋白表达和纯化条件,制备重组人可溶性TRAIL并鉴定其活性。方法: 使用CCK-8初步验证TRAIL是否具有抑制肿瘤细胞生长的生物活性;将制备的TRAIL单独或联合50 nmol/L硼替佐米应用于H460细胞(对TRAIL敏感)和K562细胞(对TRAIL抵抗)24 h,流式细胞术检测细胞凋亡率,比色法检测caspase-8、-9、-3的活化程度,Western blot分析细胞中Bax、Bcl-2和cFLIP蛋白的表达。流式细胞术检测硼替佐米处理H460细胞和K562细胞24 h后DR4和DR5的表达量变化。结果: 制备了具有生物学活性且性质稳定的重组人可溶性TRAIL,且成功诱导H460和K562细胞凋亡。不同浓度TRAIL处理H460细胞后其凋亡率随着TRAIL浓度升高而显著升高(P<0.05),但K562细胞凋亡率并未随着TRAIL浓度明显升高。联合用药组的H460和K562细胞凋亡率均显著高于单独用药组(P<0.05),凋亡过程中caspase-8、-9、-3均被活化,药物处理组的Bcl-2和cFLIP表达量均比对照组下降,尤其联合用药组表达量下降最为显著(P<0.05),而Bax表达量无明显变化。硼替佐米处理H460和K562细胞后DR4和DR5表达量均上调(P<0.05)。结论: 硼替佐米能协同TRAIL启动内源性凋亡途径诱导H460和K562细胞凋亡,其可能机制是通过上调死亡受体DR4和DR5的表达量、下调抗凋亡蛋白Bcl-2和cFLIP的表达量来实现的。
[关键词]肿瘤坏死因子相关的凋亡诱导配体; 硼替佐米; 细胞凋亡
[中图分类号]R730.23[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.003
[文章编号]1000-4718(2015)11-1943-07
[收稿日期]2015-06-02[修回日期] 2015-09-01
[基金项目]*福建省自然科学基金资助项目(No. 2013J01372);福建医科大学科研项目(No. 2013JY030)
通讯作者△Tel: 0591-22862007; E-mail: zhzheng@fjmu.edu.cn
Preparation of recombinant human soluble TRAIL and its inducing effect on apoptosis of tumor cells by TRAIL combined with bortezomibLI Xue-yan, XU Xia
(KingMedCollegeofLaboratoryMedicine,GuangzhouMedicalUniversity,Guangzhou510182,China.E-mail:xuxia503@126.com)
ABSTRACT[]AIM: To construct a prokaryotic expression plasmid to produce recombinant human tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) and to verify the biological activity of TRAIL. METHODS: The prokaryotic expression plasmid pET-28a (+)-TRAIL114-281 was constructed. Human soluble TRAIL was obtained through optimized inducing protein expression and purification conditions. The biological activity of TRAIL was verified by CCK-8 assay. The apoptosis-inducing effect of TRAIL alone and/or in combination with proteasome inhibitor bortezomib (Velcade, PS-341) on the tumor cell lines H460 (TRAIL-sensitive) and K562 (TRAIL-resistance) for 24 h was determined. The apoptotic rates of the cells were analyzed by flow cytometry with Annexin V-FITC/PI staining. The activities of caspase-8, -9 and -3 in the cells were detected by colorimetric method. The protein expression of Bax, Bcl-2 and cFLIP was measured by Western blot. The expression of DR4 and DR5 in the H460 cells and K562 cells after treated with bortezomib for 24 h was detected by flow cytometry. RESULTS: The recombinant human soluble TRAIL protein with stable bioactivity was successfully acquired, which induced apoptosis in H460 cells and K562 cells. After treatment with different concentrations of TRAIL, the apoptotic rate of H460 cells was significantly increased with the increase in the concentration of TRAIL (P<0.05), but the apoptotic rate of K562 cells was not affected by the increasing TRAIL concentration. Apoptotic rate in combination group was obviously higher than that in single group (P<0.05). In the process of apoptosis, the activities of caspase-8, -9 and -3 in H460 cells and K562 cells were both increased. The expression of Bcl-2 and cFLIP in treatment groups (especially the combination group) was decreased compared with control group. No significant change of the Bax expression level was observed. The expression of DR4 and DR5 in the H460 cells and K562 cells was significantly up-regulated after treated with bortezomib (P<0.05). CONCLUSION: Bortezomib combined with recombinant human soluble TRAIL synergistically induces apoptosis in tumor cell lines H460 and K562 through initiating intrinsic apoptotic pathways by up-regulating death receptors DR4 and DR5, and reducing the expression of antiapoptotic proteins Bcl-2 and cFLIP.
[KEY WORDS]Tumor necrosis factor-related apoptosis-inducing ligand; Bortezomib; Apoptosis
肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)又称为凋亡素2配体,是由Wiley等[1]于1995年发现并克隆出来的肿瘤坏死因子超家族新成员,广泛表达于人多种正常组织中。它能选择性诱导肿瘤细胞和转化细胞凋亡而不诱导正常细胞凋亡[2-3],有望成为新一代的抗肿瘤药物。研究发现不同的肿瘤细胞对TRAIL诱导凋亡的敏感性并不相同,例如人非小细胞性肺癌细胞H460对TRAIL敏感[4],而人慢性髓系白血病细胞K562对TRAIL抵抗[5]。硼替佐米(bortezomib,BTZ)是一种新型蛋白酶体抑制剂,已通过美国食品药物管理局认证,临床上用于治疗淋巴瘤和多发性骨髓瘤[6]。硼替佐米能可逆性地抑制哺乳动物细胞中26S蛋白酶体糜蛋白酶样活性,体外实验证明它对多种类型的癌细胞具有细胞毒性。Unterkircher等[7]的研究发现硼替佐米能协同TRAIL通过增强tBid的稳定性来诱导恶性胶质瘤细胞和胶质瘤干细胞的凋亡。
为进一步了解TRAIL及其凋亡机制,本课题组构建重组人TRAIL原核表达质粒,通过蛋白表达和纯化条件的优化获得性质稳定的可溶性TRAIL蛋白,然后将其与硼替佐米联合应用,研究对H460和K562细胞凋亡的影响和Bax、Bcl-2、cFILP蛋白表达的变化、caspase的活化以及DR4、DR5表达量的差异,进一步探讨硼替佐米增强TRAIL抗肿瘤活性及肿瘤细胞对TRAIL抵抗的机制。
材料和方法
1主要材料
TRAIL全长cDNA序列由Invitrogen合成;E.coliDH5α、BL21、pET-28α、非小细胞肺癌细胞H460和人慢性髓系白血病细胞K562均由本实验室保存;T4 DNA 连接酶购自TaKaRa;限制性内切酶BamH Ⅰ和HindⅢ购自NEB;Taq DNA 聚合酶购自天根公司;亲和层析试剂盒购自GE Healthcare;DMEM和RPMI-1640培养基购自Gibco;胎牛血清购自四季青公司;硼替佐米购自Ben Venue Laboratories;CCK-8试剂盒购自Dojindo;Annexin V-FITC/PI凋亡试剂盒购自BD;caspase-8、-9、-3活性检测试剂盒购自BioVision;Bax、Bcl-2、cFLIP、DR4-PE和DR5-PE抗体购自eBioscience;GAPDH 抗体购自Santa Cruz;其余为国产分析纯。
2方法
2.1重组人可溶性TRAIL蛋白的制备
2.1.1TRAIL胞外功能区基因的扩增根据TRAIL基因序列胞外段第114~281位氨基酸序列设计上游引物(5’-CGGGA TCC GTG AGA GAA AGA GGT C-3’)和下游引物(5’-CCCAAGCTTCCA GGT CAG TTA GC-3’),为方便酶切,在上、下游引物中分别引入了BamHⅠ和HindⅢ两个酶切位点(其中下划线部分为保护性碱基,加粗部分为加入的酶切位点)。以TRAIL全长cDNA为模板,用上、下游引物和Taq DNA聚合酶进行PCR扩增。扩增的目的片段记为TRAIL114-281。
2.1.2重组表达载体的构建将回收的目的片段与提取的pET-28a(+)载体质粒分别经限制性内切酶BamHⅠ和HindⅢ酶切。再将重组质粒pET-28a(+)-TRAIL114-281转化入大肠杆菌DH5α,经酶切鉴定挑选出阳性转化子送往上海英俊公司测序。
2.1.3重组表达质粒诱导目的蛋白表达提取经测序验证的质粒转化大肠杆菌BL21,挑取单克隆菌落接种到含卡那霉素的LB液体培养基中,摇床上培养过夜。次日取2 mL菌液接种于200 mL的LB液体培养基中扩大培养,于37 ℃培养至A600值分别为0.2、0.6和1.0时取出54 mL菌液,分装入6支离心管中,每管9 mL,分成2组,分别加入终浓度为0.2 mmol/L、0.6 mmol/L、1.0 mmol/L的IPTG,分别在37 ℃和25 ℃下诱导蛋白表达。然后在4 h、8 h和24 h 3个时点分别从以上6管中取出3 mL菌液,离心后用PBS重悬,用超声波细胞粉碎仪破碎细菌获得裂解产物,离心后获得上清和沉淀,分别进行SDS-PAGE。
2.1.4可溶性TRAIL的表达按上述方法选择最佳菌体密度、诱导温度、IPTG浓度和诱导时间后,确定最佳条件,并在加IPTG诱导的同时加入1 mmol/L ZnSO4,优化条件制备重组人可溶性TRAIL蛋白。
2.1.5可溶性TRAIL的纯化按上述方法将收获的菌液离心获得菌体,重悬于适量缓冲液(含10%甘油、0.5 mmol/L NaCl、20 mmol/L Tris-HCl、5 mmol/L DTT和1 mmol/L PMSF)中,冰浴下超声裂解细菌,4 ℃离心收获上清。使用Ni+亲和层析试剂盒纯化带有六聚His标签的重组TRAIL蛋白,按照试剂盒说明书进行。将最后收集的蛋白液装入预处理过的透析袋内,置于1 L PBS缓冲液中4 ℃透析,每隔4~6 h换 1 次PBS缓冲液,收集透析袋内液体即为纯化后的TRAIL蛋白,-20 ℃保存。
2.2可溶性TRAIL联合硼替佐米的研究
2.2.1细胞培养H460细胞和K562细胞在37 ℃、5% CO2条件下分别培养于含10%灭活胎牛血清、1×105U/L青霉素和0.1 g/L链霉素的DMEM和RPMI-1640培养基中。细胞每2~3 d传代1次。
2.2.2CCK-8法检测细胞活性取对数生长期的H460细胞和K562细胞,将浓度调整为约2×107/L,分别接种于96孔板中,温箱中培养过夜(37 ℃、5% CO2)。次日分别加入不同浓度的TRAIL,使其终浓度为0、50、100、200、400和800 μg/L,温箱中继续培养24 h。向每孔中加入10 μL CCK-8溶液轻轻振荡96孔板,温箱中放置1 h。用酶标仪测定450 nm波长的A值。细胞活性的计算公式为:细胞活性(%)=(A450药物组-A450空白组)/(A450阴性对照组-A450空白组)×100% 。
参考文献2.2.3流式细胞术检测凋亡率[8]检测细胞凋亡率。将H460细胞和K562细胞浓度调整为约2×108/L,分别接种于6孔板中,次日加入不同浓度TRAIL;此外,选择50 nmol/L 硼替佐米、200 μg/L TRAIL联合50 nmol/L 硼替佐米作用于H460和K562细胞,温箱中培养24 h。收集细胞重悬于凋亡试剂盒的1×binding buffer中。吸取100 μL细胞悬液(约1×105细胞)至5 mL的流式管中。分别向各管中加入5 μL Annexin V-FITC和5 μL PI。轻轻涡旋,室温避光放置15 min。每管中加入400 μL 1×binding buffer,1 h内上机检测各组凋亡率。
参考文献2.2.4Caspase-8、-9、-3活性的检测[9]检测凋亡细胞的caspase活性。收集经过处理的细胞分别检测其caspase-8、-9、-3活性,按试剂盒的说明书操作,酶标仪检测450 nm波长的A值。通过计算(A450实验组-A450空白组)/(A450阴性对照组-A450空白组)来确定凋亡诱导剂组caspase-8、-9、-3的活化程度。
参考文献2.2.5Western blot分析[10]检测凋亡相关蛋白的表达。收集药物处理后的细胞用预冷的PBS洗涤 2次,加入裂解液冰上放置45 min,冰浴下超声裂解,与电泳的loading buffer混匀100 ℃下加热3 min。上样,SDS-PAGE,转膜至PVDF膜上,与相应的Ⅰ抗和HRP标记的 II 抗孵育。使用化学发光系统检测抗原抗体复合物。Western blot中使用的抗体有Bax、Bcl-2、cFLIP和GAPDH。Image-Pro Plus 6.0软件分析积分吸光度。
2.2.6DR4和DR5的检测H460和K562细胞接种后,次日加入50 nmol/L硼替佐米于温箱中培养24 h。收集细胞,PBS洗涤2次,重悬于500 μL PBS中。加入5 μL的DR4-PE或DR5-PE抗体,冰上避光放置45 min。PBS洗涤去除未结合抗体,再用500 μL PBS重悬,流式细胞仪检测DR4或DR5的荧光值。
3统计学处理
采用SPSS 13.0软件分析。实验数据以均数±标准差(mean±SD)表示,多组样本之间采用单因素方差分析,两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结果
1TRAIL蛋白的制备
1.1TRAIL基因的扩增和重组表达载体的构建PCR扩增目的基因后行2%琼脂糖凝胶电泳,在DNA marker的500 bp附近有1条清晰的扩增条带,与TRAIL114-281预期目的片段524 bp大小一致。连接酶连接后的重组表达质粒经酶切后,电泳分析可见切下pET-28a(+)载体片段5 344 bp和约500 bp的TRAIL114-281目的基因片段,证实PCR扩增了目的片段TRAIL114-281并正确插入载体中,见图1。
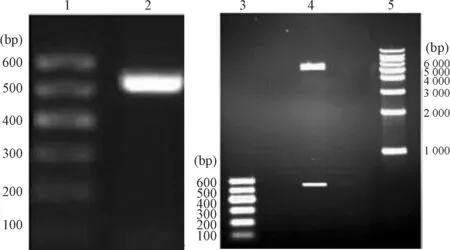
Figure 1.Amplification ofTRAIL114-281gene and restrictive enzyme digestion of recombinant pET-28a(+)-TRAIL114-281analyzed by agarose gel electrophoresis. 1: marker; 2: PCR product ofTRAIL114-281gene; 3: marker; 4: pET-28a(+)-TRAIL114-281/BamHⅠ+HindⅢ; 5: marker.
图1TRAIL114-281基因扩增和重组质粒pET-28a(+)-TRAIL114-281酶切后的琼脂糖凝胶电泳分析
1.2重组表达质粒的优化诱导表达将重组质粒pET-28a(+)-TRAIL114-281转化大肠杆菌BL21后于37 ℃诱导目的蛋白表达,同时以没有插入TRAIL114-281基因的BL21-pET-28a(+)作为阴性对照,SDS-PAGE分析结果如图2所示,图2A中在分子量约为24 kD处有 一清晰的条带而对照组无条带,与预期的TRAIL蛋白分子量相符合,说明37 ℃条件下诱导有目的蛋白的表达且产量非常高。图2B可看出在37 ℃时诱导的目的蛋白均以包涵体的形式出现于沉淀中,而上清中没有可溶性目的蛋白的表达。但在25 ℃诱导蛋白表达时,TRAIL蛋白以包涵体和可溶性2种形式出现(图2C)。由于包涵体不具有生物学活性而蛋白复性过程较复杂且效率非常低,不利于深入研究TRAIL的凋亡诱导功能,故选择25 ℃为适宜温度来诱导可溶性蛋白表达从而进一步研究其生物学功能。用Quantity One软件扫描分析上清中各泳道的蛋白相对表达量。综合各方面因素,选择25 ℃、A600=0.6、IPTG 0.6 mmol/L、ZnSO41 mmol/L诱导24 h为制备重组人可溶性TRAIL的最佳条件,见图3。

Figure 2.The protein expression in theE.coliunder different conditions analyzed by SDS-PAGE. A: the protein expression. M: marker; 1: precipitate of BL21-pET-28a(+)(control); 2: precipitate of BL21-pET-28a(+)-TRAIL114-281. B: SDS-PAGE analysis of expressed protein induced at 37 ℃. M: marker; 1: the supernatant of BL21-pET-28a(+)-TRAIL114-281; 2: the precipitate of BL21-pET-28a(+)-TRAIL114-281; 3: supernatant of BL21-pET-28a(+); 4: the precipitate of BL21-pET-28a(+). C: SDS-PAGE analysis of expressed protein induced at 25℃. M: marker; 1: the precipitate of BL21-pET-28a(+); 2: the supernatant of BL21-pET-28a(+); 3: the precipitate of BL21-pET-28a(+)-TRAIL114-281; 4: the supernatant of BL21-pET-28a(+)-TRAIL114-281.
图2SDS-PAGE分析不同条件下对蛋白表达的影响

Figure 3.Identification of recombinant TRAIL114-281protein. 1~3: recombinant pET-28a(+)-TRAIL114-281induced by 1.0 mmol/L IPTG for 24 h, 8 h and 4 h; 4~6: recombinant pET-28a(+)-TRAIL114-281induced by 0.6 mmol/L IPTG for 24 h, 8 h and 4 h; 7~9: recombinant pET-28a(+)-TRAIL114-281induced by 0.2 mmol/L IPTG for 24 h, 8 h and 4 h.
图325 ℃下A600值分别为0.2、0.6和1.0时,诱导表达包涵体和上清可溶性蛋白的比较
1.3可溶性TRAIL的纯化亲和层析法纯化后结果如图4所示,泳道1为纯化前的重组蛋白样品,泳道2为蛋白样品上柱后滤出的部分,从泳道1和泳道2 的比较中,可发现泳道2在24 kD处无条带,这说明目的蛋白已经成功结合层析柱上,经过一系列漂洗,最后泳道8中只在24 kD处有单一条带,无其它杂条带,说明成功纯化了重组人可溶性TRAIL蛋白。

Figure 4.Ni+affinity chromatography analysis of recombinant TRAIL114-281protein. M: protein marker; 1: sample before added to the column; 2: flow-through fraction after added to the collumn; 3~8: flow-through fraction after eluted by 20, 40, 60, 80, 100 and 500 mmol/L iminazole, respectively.
图4亲和层析法纯化TRAIL蛋白的SDS-PAGE分析
2可溶性TRAIL联合硼替佐米诱导凋亡
2.1细胞活性检测将制备好的重组人可溶性TRAIL以终浓度为0、50、100、200、400和800 μg/L分别作用于H460和K562细胞24 h,CCK-8检测各组细胞活性。从图5中可看出随着TRAIL浓度逐渐上升,H460细胞和K562细胞的活性均逐渐下降,相同TRAIL浓度下K562细胞的活力比H460细胞强。这说明K562细胞对TRAIL的敏感性不如H460细胞高,TRAIL对H460细胞生长的抑制作用比K562细胞强。
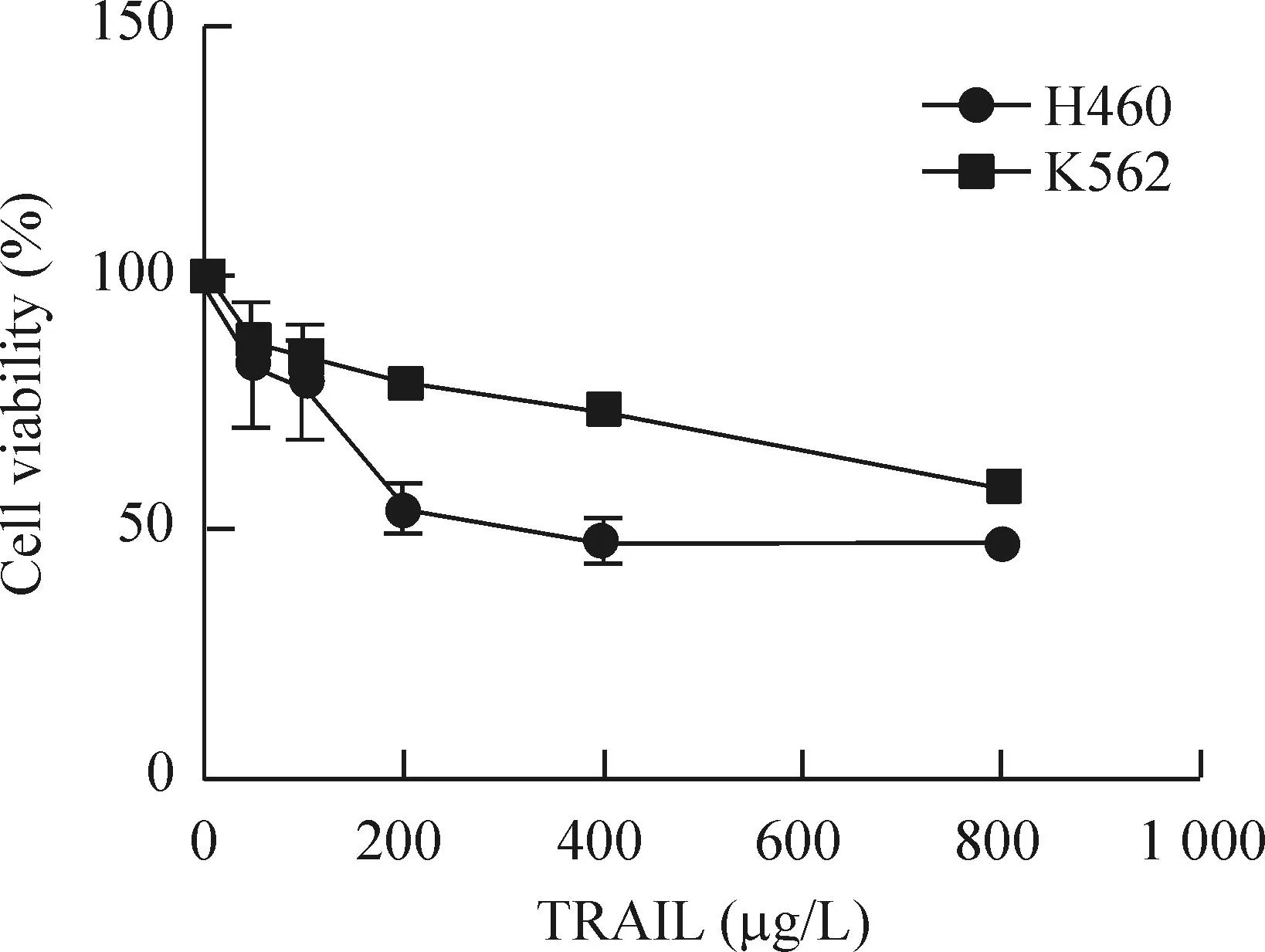
Figure 5.The viability of H460 cells and K562 cells treated with TRAIL for 24 h determined by CCK-8 assay. Mean±SD.n=3.
图5CCK-8实验检测TRAIL处理H460和K562 细胞24 h后的细胞活性
2.2流式细胞术检测凋亡率细胞接种后,分别加入不同浓度TRAIL(0、50、100、200、400和800 μg/L)、50 nmol/L 硼替佐米和200 μg/L TRAIL联合50 nmol/L 硼替佐米作用于细胞24 h。Annexin V-FITC/PI双染流式细胞术检测各组凋亡率结果显示:H460细胞的凋亡率具有TRAIL浓度依赖性,随着TRAIL浓度升高凋亡率也逐渐升高。不同浓度TRAIL处理后K562细胞的凋亡率均比H460细胞低,且凋亡率并未随TRAIL浓度升高而明显升高,这与K562细胞对TRAIL不敏感的报道相符。并且TRAIL联合硼替佐米用药后H460和K562细胞的凋亡率显著升高,见图6。此外,图7显微镜下观察可发现H460细胞和K562各药物处理组的细胞形态均发生改变,细胞皱缩体积变小,与相邻细胞分离,甚至贴壁生长的H460细胞脱离瓶壁悬浮,尤其联合用药组的细胞形态改变最明显,而对照组细胞体积大小均一,紧密生长,状态良好。由细胞凋亡率和镜下形态学观察结果表明制备的重组人可溶性TRAIL确实具有诱导肿瘤细胞凋亡的生物活性,同时,TRAIL联合硼替佐米诱导H460细胞和K562细胞凋亡具有协同作用。
2.3Caspase活化程度的比较H460和K562细胞经不同处理后,比色法检测各组caspase-8、-9、-3的活化倍数(阴性对照组的活性程度为1),结果如图8所示。TRAIL应用于H460和K562细胞后caspase-9的活性分别为1.50±0.25和1.47±0.26,而联合用药后的caspase-9活性分别为2.36±0.20和2.38±0.70。此外联合用药组caspase-8和caspase-3的活性也比单独用药组高。这说明联合用药具有协同作用,同时也进一步证明了制备的重组人可溶性TRAIL具有生物学活性。Caspase-9的活化也说明了TRAIL诱导H460和K562细胞凋亡启动了内源性凋亡途径。
2.4Western blot分析凋亡相关基因Bax、Bcl-2和cFLIP的蛋白表达使用ImageJ 2x 软件分析各蛋白条带的积分吸光度值并做比较。从图9中可看出药物处理组的Bcl-2和cFLIP表达量均比对照组减少,且联合用药组的表达量最少,此过程中Bax的表达量无明显变化,说明TRAIL和硼替佐米引起H460细胞和K562细胞凋亡都可通过减少抗凋亡蛋白Bcl-2和cFLIP表达量来实现,同时硼替佐米能协同TRAIL诱导H460细胞和K562细胞凋亡。
2.5DR4和DR5的检测结果显示硼替佐米处理24 h后,H460和K562细胞膜上的DR4、DR5表达量均上调。由此看出,50 nmol/L硼替佐米处理H460和K562细胞后均可使DR4和DR5表达量上调来增

Figure 6.Apoptotic rates of the cells with different treatments analyzed by flow cytometry. Mean±SD.n=3.*P<0.05vs200 μg/L TRAIL.
图6流式细胞术检测H460 细胞和K562细胞的凋亡率
强TRAIL诱导的凋亡。数据也显示K562细胞的DR4和DR5表达量均比H460细胞低,这表明K562细胞对TRAIL诱导的凋亡不敏感的原因之一可能是DR4和DR5表达量较低。与此同时,从数据中看出无论是H460细胞还是K562细胞在药物处理前后,DR5的表达量均明显高于DR4,这说明在凋亡发生过程中DR5发挥了更重要的作用,见图10、表1。

Figure 7.The morphological changes of the cells treated with TRAIL in the presence or absence of bortezomib (×400).
图7TRAIL联合硼替佐米对细胞形态的影响

Figure 8.The activities of caspase-8, -9 and -3 in the H460 cells and K562 cells. Mean±SD.n=3.*P<0.05vs200 μg/L TRAIL.
图8H460和K562细胞caspase-8、-9、-3的活化程度
讨论
凋亡也称作细胞程序性死亡,是一种不同于坏死的细胞自主性死亡,它与细胞分裂、胚胎发育、免疫反应等密切相关。细胞凋亡作用可以清除体内突变或转化的细胞以保持内环境的稳态。本课题主要研究重组人可溶性TRAIL诱导H460和K562细胞的凋亡现象,以及探讨其联合硼替佐米应用后的凋亡机制。本实验中至关重要的一点就是获得具有生物活性的TRAIL蛋白,预实验中发现在诱导蛋白表达阶段即使不加入ZnSO4,只需在25 ℃下即可有可溶性TRAIL表达,但获得的TRAIL蛋白极其不稳定,在纯化后4 ℃透析时可见大量蛋白变性形成沉淀,使得最终的蛋白获得率极低。有文献表明Zn2+在TRAIL维持其稳定的空间结构和发挥诱导凋亡的功能中具有极其重要的作用[11]。随后在加入IPTG诱导蛋白表达的同时加入1 mmol/L ZnSO4[11-12],促使TRAIL蛋白表达时可边折叠边螯合Zn2+形成稳定的空间结构。这也论证了Zn2+是TRAIL维持其稳定的空间结构和发挥生物学效应所必须的。
获得TRAIL蛋白后首先使用CCK-8法检测细胞活性大致判断制备的TRAIL蛋白是否具有活性、能否进行下游实验。结果显示H460细胞的活性随着TRAIL浓度的升高而逐渐降低,说明TRAIL对H460细胞的生长具有抑制作用。研究发现不同浓度TRAIL作用于H460细胞时,凋亡率随着TRAIL浓度升高而升高,但K562细胞却并不具有这种现象,凋亡率不随着TRAIL浓度的升高而明显升高。在联合硼替佐米应用后,H460细胞和K562细胞的凋亡率均比单独用药时明显升高,这说明硼替佐米能协同TRAIL诱导H460和K562细胞凋亡。

Figure 9.The expression of Bax, Bcl-2 and cFLIP in H460 cells and K562 cells with different treatments. Mean±SD.n=3.*P<0.05vs200 μg/L TRAIL.
图9Western blot分析Bax、Bcl-2 和cFLIP 在H460和K562细胞中的表达

Figure 10.The changes of death receptor expression in H460 cells and K562 cells.
图10H460细胞和K562细胞死亡受体的表达量

表1 硼替佐米处理H460细胞和K562细胞后死亡受体的表达量比较
*P<0.05vscontrol.
Caspase是一类蛋白酶家族,与真核细胞的凋亡密切相关。正常细胞内的caspase都以无活性的酶原形式存在,当上游的起始caspase被外来信号激活后进一步切割激活下游的caspase,从而导致目的蛋白水解,最终引起细胞凋亡。本研究中药物处理H460和K562细胞后各组caspase-8、-9、-3均被活化。活化的caspase-9是内源性凋亡途径的产物,caspase-9的活化说明了TRAIL诱导H460、K562凋亡启动了内源性凋亡途径进行调控。Caspase-3是凋亡执行蛋白,它的活化意味着凋亡效应的发生,这进一步证实了制备的重组人可溶性TRAIL具有诱导凋亡的生物学活性。
经过上述实验证实了TRAIL蛋白具有活性,进一步对其凋亡机制深入研究。Bcl-2家族是研究凋亡分子机制的重要靶分子,其成员包括促凋亡因子Bax、Bak等和抗凋亡因子Bcl-2、Mcl-1、Bcl-xL等,细胞的凋亡或存活效应是受促凋亡因子和抗凋亡因子相互严密调控的。本实验中可见TRAIL诱导凋亡后Bcl-2和cFLIP蛋白表达量比对照组下降,尤以联合用药组最为明显,说明硼替佐米能协同TRAIL减少抗凋亡因子Bcl-2和cFLIP的蛋白表达量来实现凋亡效应。
硼替佐米处理H460和K562细胞后DR4和DR5的含量均上调,且TRAIL联合硼替佐米后细胞凋亡率均升高,说明硼替佐米能上调DR4和DR5含量来协同TRAIL诱导H460和K562细胞凋亡。但实验结果可看出K562细胞的凋亡率没有H460细胞的凋亡率高,K562细胞的DR4和DR5含量也没有H460高。同时H460和K562细胞的DR5含量均明显高于DR4,这说明TRAIL诱导凋亡中DR5发挥着更重要的作用。近来的研究报道TRAIL受体缺乏的小鼠具有自发形成肿瘤和自身免疫性疾病的趋势[13]。这些给我们一个提示,K562细胞对TRAIL不敏感的原因之一就是其细胞膜上的DR4和DR5含量较低,想要逆转K562对TRAIL的抵抗性我们可以着重于提高DR4和DR5尤其是DR5的表达量。
综上所述,通过条件优化成功制备了具有诱导肿瘤细胞凋亡活性,且性质稳定的重组人可溶性TRAIL蛋白。TRAIL诱导H460细胞凋亡具有浓度依赖性,凋亡率随着TRAIL浓度升高而升高,但K562细胞凋亡率却并不随着TRAIL浓度的升高而明显升高。Caspase-9的活化(尤其是联合用药组)说明了TRAIL联合硼替佐米诱导H460细胞和K562细胞凋亡启动了内源性凋亡途径。硼替佐米能协同TRAIL诱导H460和K562细胞凋亡,其可能机制是通过上调死亡受体DR4和DR5的表达量、下调抗凋亡蛋白Bcl-2和cFLIP的表达量来实现的。TRAIL联合硼替佐米应用于各种肿瘤细胞是近几年来研究凋亡现象的热点。有文献报道[14],硼替佐米能增强caspase-8、-9、-3的活性和上调DR5来协同TRAIL诱导HNSCC090(对TRAIL抵抗的头颈部鳞癌细胞)细胞凋亡,此结果与本研究一致。另有报道[15 ]称硼替佐米在增强脑膜瘤细胞对TRAIL诱导凋亡的敏感性研究中发现,上调DR4和DR5表达量能促进凋亡,而cFLIP表达下降并不能促进脑膜瘤细胞凋亡。可见cFLIP在不同肿瘤细胞中发挥不一样的作用,原因可能是肿瘤细胞类型不同其凋亡机制不同造成的。凋亡是一个极其复杂的过程,受众多因子严密调控,因此其具体机制有待进一步研究讨论。
[参考文献]
[1]Wiley SR, Schooley K, Smolak PJ, et al. Identification and characterization of a new member of the TNF family that induces apoptosis[J]. Immunity, 1995, 3(6): 673-682.
[2]Pitti RM, Marsters SA, Ruppert S, et al. Induction of apoptosis by Apo-2 ligand, a newmember of the tumor necrosis factor cytokine family[J]. J Biol Chem, 1996, 271(22):12687-12690.
[3]Trivedi R, Mishra DP. Traning TRAIL resistance: novel targets for TRAIL sensitization in cancer cells[J]. Front Oncol, 2015, 2(5):1-20.
[4]Zhang X, Zhao J, Zhu W, et al. Synergistic effect of subtoxic-dose cisplatin and TRAIL to mediate apoptosis by down-regulating decoy receptor 2 and up-regulating caspase-8, caspase-9 and Bax expression on NCI-H460 and A549 cells[J]. Iran J Basic Med Sci, 2013, 16(5):710-718.
[5]Peng H, Yuan X, Luo S, et al. Reactive oxygen species contribute to TRAIL receptors upregulation; the mechanism for PH II-7 augmenting TRAIL induced apoptosis in leukemia cells[J]. Eur J Pharmacol, 2015, 746:344-352.
[6]Meregalli C, Carozzi VA, Sala B,et al. Bortezomib-induced peripheral neurotoxicity in human multiple myeloma-bearing mice[J]. J Biol Regul Homeost Agents, 2015, 29(1):115-124.
[7]Unterkircher T, Cristofanon S, Vellanki SH, et al. Bortezomib primes glioblastoma, including glioblastoma stem cells, for TRAIL by increasing tBid stability and mitochondrial apoptosis[J]. Clin Cancer Res, 2011, 17(12):4019-4030.
[8]王晓东,陈美苑,曾志,等. 促血小板生成素对化学性缺氧诱导的PC12细胞凋亡的影响[J]. 中国病理生理杂志, 2015, 31(3):37-42.
[9]董珺,曾波航,刘宁宁,等. MicroRNA-378通过抑制CTGF促进人骨髓间充质干细胞凋亡[J]. 中国病理生理杂志, 2014, 30(12):130-134.
[10]赵泓翔,郭可,崔亚迪,等. 半枝莲黄酮对复合Aβ25-35引起线粒体膜Bcl-2、Bax、Bcl-xL及Bak异常的干预作用[J]. 中国病理生理杂志, 2014, 30 (12):154-158.
[11]Hu L, Yang H, Wan L, et al. Effect of zinc ion on polymerization and cytoxicity of sTRAIL in tumor cells[J]. J Biomed Eng, 2013,30(2):415-420, 427.
[12]Sun AY, Shen YL, Yin JC, et al. Improvement of expression level and bioactivity of soluble tumor necrosis factor-related apoptosis-inducing ligand (Apo2L/TRAIL) by a novel zinc ion feeding strategy[J]. Biotechnol Lett, 2006, 28(15):1215-1219.
[13]McGrath EE. The tumor necrosis factor-related apoptosis-inducing ligand and lung cancer: still following the right TRAIL?[J]. J Thorac Oncol, 2011, 6(6):983-987.
[14]Bullenkamp J, Raulf N, Ayaz B, et al. Bortezomib sensitises TRAIL-resistant HPV-positive head and neck cancer cells to TRAIL through a caspase-dependent, E6-independent mechanism[J]. Cell Death Dis, 2014, 23(5):1489-1498.
[15]Koschny R, Boehm C, Sprick MR, et al. Bortezomib sensitizes primary menigioma cells to TRAIL-induced apoptosis by enhancing formation of the death-inducing signaling complex[J]. J Neuropathol Exp Neurol, 2014, 73(11):1034-1046.
(责任编辑: 卢萍, 罗森)

