Notch1对神经胶质瘤U251细胞干性及化疗药物敏感性的调节
2016-01-12张丽柯,咸娜,林玲等
Notch1对神经胶质瘤U251细胞干性及化疗药物敏感性的调节*
张丽柯,咸娜,林玲,龚雨晴,叶志强,郑志竑△
(福建医科大学基础医学院生物化学与分子生物学系,神经生物学研究中心,福建 福州 350108)
[摘要]目的: 探讨Notch1对人胶质瘤U251细胞干性和药物敏感性的影响。方法: 用高表达Notch1胞内段(Notch1 intracellular domain, NICD1)和Notch1-shRNA慢病毒表达载体感染体外培养的人胶质瘤U251细胞,Western blot和免疫荧光染色法鉴定高表达NICD和Notch1沉默细胞。通过流式细胞术检测分析CD133+细胞的比例、免疫荧光染色法检测nestin和GFAP的表达情况、检测肿瘤细胞球的形成率和SCID小鼠体内种植致瘤情况,分析Notch1对细胞干性的调节。并采用MTT法检测各组细胞对化疗药物替尼泊苷(VM-26)和卡莫司汀(BCNU)的敏感性。结果: NICD表达增加的瘤细胞干性表型增强,如CD133+细胞的比例增加、nestin表达增强而GFAP表达减弱、肿瘤细胞球的形成率和SCID小鼠种植致瘤率增加,并伴有对VM-26和BCNU的敏感性降低。而Notch1基因表达下调的瘤细胞干性表型受到明显抑制,而对VM-26和BCNU的敏感性增高。结论: Notch1高表达可增加人胶质瘤U251细胞的干性,减弱U251细胞对化疗药物的敏感性。
[关键词]胶质瘤U251细胞; Notch1; 化疗药物敏感性
[中图分类号]R392.12[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.004
[文章编号]1000-4718(2015)11-1950-06
[收稿日期]2015-07-07[修回日期] 2015-09-10
[基金项目]*广东省医学科研基金资助项目(No.B2013133)
通讯作者△陆 英 Tel: 020-85252526; E-mail: xiaolu1196@163.com; 林东军 Tel:020-85252227; E-mail: lindongjun0168 @ 163.com
Notch1 regulates stemness and chemotherapeutic sensitivity of human glioma U251 cellsZHANG Li-ke, XIAN Na, LIN Ling, GONG Yu-qing, YE Zhi-qiang, ZHENG Zhi-hong
(ResearchCenterofNeurobiology,DepartmentofBiochemistryandMolecularBiology,SchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350108,China.E-mail:zhzheng@fjmu.edu.cn)
ABSTRACT[]AIM: To investigate whether Notch1 changes stemness and chemotherapeutic sensitivity in human glioma U251 cells. METHODS: The lentiviral vectors, which expressed Notch1-shRNA or Notch1 intracellular domain (NICD), were transfected into U251 cells . Western blot and immunofluorescence staining were applied to monitor the validity of the cells, down-regulation of Notch1 expression or over-expression of NICD. The proportion of CD133+ cells was analyzed by flow cytometry. The expression of nestin and GFAP was identified by immunofluorescence staining. The formation rate of tumor cell spheres and the implanted tumor growth in SCID mice were observed. MTT assay was performed to evaluate the chemotherapeutic sensitivity to VM-26 and BCNU of the cells with different treatments. RESULTS: Stemness was significantly enhanced in the cells over-expressing NICD. For example, the proportion of CD133+ cells was increased, the expression of nestin was up-regulated, the expression of GFAP was down-regulated, and the formation rate of tumor cell spheres and implanted tumor growth were increased. The chemotherapeutic sensitivity to VM-26 and BCNU of the cells was decreased. In the cells with Notch1 gene down-regulation by RNAi, the stemness was inhibited and chemotherapeutic sensitivity was increased. CONCLUSION: Notch1, which leads to the change of stemness and chemotherapeutic sensitivity in human glioma U251 cells, is likely to be a potential molecular target for treatment of glioma.
[KEY WORDS]Glioma U251 cells; Notch1; Chemotherapeutic sensitivity
神经胶质瘤是中枢神经系统最常见的恶性肿瘤,手术结合放疗或化疗是胶质瘤治疗的重要手段[1]。目前,该肿瘤的常规治疗预后仍不尽人意,其中化疗效果欠佳的重要因素是化疗后残存的部分肿瘤细胞的继发耐药性逐渐形成,从而导致化疗失效和肿瘤复发。而这一部分的细胞可能就是具有化疗抵抗能力的肿瘤干细胞(cancer stem cells,CSCs),研究发现,胶质瘤内CSCs的比例越高,胶质瘤抵抗化疗的能力就越强[2]。Notch信号通路参与了调节干细胞结构和决定细胞命运,在多种癌症存在Notch信号通路的异常[3],而且在结肠直肠癌、胰腺癌、乳腺癌均参与肿瘤干细胞群的调节。众多研究已提示,Notch1及其配体在脑胶质瘤中呈过度表达,将其敲除可抑制脑胶质瘤细胞的增殖和生存。那么在与Notch1关系极为密切的神经胶质瘤,是否Notch1也是瘤细胞产生干细胞样表型的重要因素?是否影响到细胞对化疗药物的敏感性?本研究利用Notch1基因修饰技术,旨在对上述问题进行探讨,为胶质瘤的治疗提供实验依据。
材料和方法
1实验材料
Notch 1 胞内段(Notch1 intracellular domain,NICD)表达载体pLVX-IRES2-ZsGreen-NICD由本实验室构建和鉴定,简称pLVX-NICD,空对照载体称为pLVX。携带ZsGreen的3质粒慢病毒表达系统以及Notch1基因RNA干扰载体由上海交通大学郭亚博士惠赠,RNA干扰载体为pLKO.1-puro,干扰靶序列5’-CCGGGACATCACGGATCATAT-3’(简称pLKO-Notch1-ND),以无义干扰序列5’-CAACAAGATGAAGAGCACCAA-3’作为对照(简称pLKO-Notch1-NC)。
SCID小鼠购自上海斯莱克实验动物公司,合格证编号为2007000579362、2007000574540。
高糖DMEM培养基、DMEM/F12培养基、胎牛血清、无血清细胞培养添加剂B27(Gibco);表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(PeproTech);脂质体Lipofectamine 2000、MTT(Invitrogen);兔抗人NICD多克隆抗体、兔抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体、Rhodamine标记的抗兔IgG抗体、Rhodamine标记的抗小鼠IgG抗体(Millipore);小鼠抗CD133/1(AC133)-PE 抗体(Miltenyi Biotec);小鼠抗nestin单克隆抗体(R&D);兔抗GAPDH多克隆抗体(Santa Cruz);HRP-偶联抗兔IgG抗体、HRP-偶联抗小鼠IgG抗体(北京中杉金桥公司);质粒抽提纯化试剂盒(QIAGEN);ECL化学发光试剂盒(CST);卡莫司汀[carmustine;即1,3-双(2-氯乙基)-1-亚硝基脲,1,3-bis(2-chloroethyl)-1-nitrosourea,BCNU]和替尼泊苷(VM-26)购自Enzo Life Science;嘌呤霉素(Amresco);其它试剂购于Sigma或碧云天公司。
2方法
2.1高表达NICD 的U251细胞和Notch1敲低U251细胞的获得按本实验室常规方法将pLVX-NICD、pLVX、pLKO-Notch1-ND、pLKO-Notch1-NC质粒,分别加用包装质粒pMD2.G和psPAX2,以及Lipo- fectamine 2000转染293T细胞,进行病毒包装。转染48~72 h收集和浓缩含病毒培养上清。
胶质瘤细胞U251常规培养于含10%胎牛血清的DMEM培养液,每2~3 d用0.25%胰酶+0.03% EDTA消化传代1次,感染前1 d接种细胞于6孔板,每孔约5×104细胞,第2天大约30% 融合时,除去培养液,每孔加入含血清培养液600 μL,慢病毒液10 μL,polybreen(1 g/L)4.8 μL,置于培养箱中培养,12 h后吸去含病毒的培养液,更换新鲜的培养液2 mL,置于37 ℃、5% CO2、饱和湿度下继续培养48 h。高表达NICD 的U251细胞及其相应的对照细胞,病毒感染48 h后荧光显微镜下判定感染成功率。Notch1基因RNA干扰细胞及其相应对照细胞,用嘌呤霉素筛选出感染成功的细胞株。
2.2Notch1表达水平的鉴定Western blot检测按下列步骤进行: 用RIPA细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取40 μg蛋白样品行SDS-PAGE电泳后转膜印迹,经封闭液4 ℃作用过夜后,用兔抗人NICD抗体或GAPDH抗体与膜上抗原结合,用羊抗兔HRP偶联的II抗与其反应后,加ECL化学发光试剂,在凝胶成像系统(Bio-Rad)下获取图像,用ImageJ 2x软件计算蛋白条带的灰度值,以目的条带/内参照条带灰度比值作为Notch1的相对表达量。
免疫荧光染色检测按下列步骤进行: 将细胞培养于置入盖玻片的12孔板,取对数生长期的细胞,调整密度后接种,常规培养48 h。吸除培养液,用预冷的PBS洗涤3次后,4% 多聚甲醛室温固定30 min,PBS洗涤后,0.1% Triton X-100细胞透化处理30 min,按常规方法用相应的抗体进行免疫荧光染色,然后再用DAPI(5 mg/L)复染10 min。抗荧光猝灭液封片,激光共聚焦显微镜(Leica)下观察、拍照。
2.3各组细胞干性的检测和比较
2.3.1各组细胞中CD133+细胞比例的检测胰酶消化并收集各组细胞,计数并调整细胞浓度为1×109/L。设空白对照组及同型对照组。各组细胞吸取100 μL至1.5 mL EP管,300×g离心10 min,用100 μL预冷PBA重悬。实验组加入1 μL PE标记的CD133抗体,同型对照组加入1 μL PE标记的同型对照抗体,空白对照组加入1 μL PBA。混匀,置4 ℃冰箱避光孵育1 h。加入1 mL PBA洗涤细胞,300×g离心10 min,完全吸弃上清。500 μL PBA重悬各组细胞,流式细胞仪检测。
2.3.2各组细胞nestin和GFAP表达的检测分析免疫荧光染色方法同上述,将细胞培养于置入盖玻片的12孔板,培养48 h后。用预冷的PBS洗涤3次后,用4% 多聚甲醛固定,PBS洗涤后,0.1% Triton X-100细胞透化处理,用抗nestin和GFAP抗体及相应的 II抗进行免疫荧光染色,再用DAPI复染。于激光共聚焦显微镜下观察、拍照。
2.3.3各组肿瘤球的形成率实验取对数生长期的各组细胞,胰酶消化,收集细胞,PBS洗涤细胞2次,1 000 r/min离心4 min。用干细胞培养液(DMEM/F12培养液含2% B27、20 μg/L EGF和20 μg/L bFGF)重悬各组细胞,计数并调整细胞密度为107/L。接种于24孔板,每孔1 mL,即每孔细胞数为104个, 每组细胞接种3孔。37 ℃、5% CO2中培养,隔天半量更换干细胞培养液,观察细胞变化及肿瘤球形成。培养10 d后,显微镜下计数直径大于75 μm的肿瘤球个数,肿瘤球球形成率(%)=每孔中直径大于75 μm的肿瘤球的个数/每孔中原始接种细胞的总数×100%。
2.3.4SCID小鼠皮下种植致瘤实验SCID小鼠恒温(25~27 ℃)、恒温和SPF条件下饲养。取对数生长期的NICD高表达组细胞和其对照组细胞,制备成单细胞悬液,每0.2 mL的细胞数为1×103、1×105或5×105。小鼠分为6组,每组5只,以碘伏消毒SCID鼠腋窝皮肤,用无菌注射器(6号针头)抽吸0.2 mL细胞接种于腋窝区皮下,继续饲养。共观察10周,然后采用颈髓离断法处死。完整地剥出瘤体、去除表面脂肪组织、称重,取游标卡尺分别测量肿瘤长径和短径(mm),按公式计算肿瘤体积,体积(mm3)=4/3×π×(长径/2)×(短径/2)2。
2.4MTT法检测各组细胞的多药耐药性选用2种化疗药物VM-26和BCNU,参考其它文献及本实验室经验,分别用1.5 μmol/L VM-26和150 μmol/L BCNU处理细胞。取对数生长期的细胞,以每孔7 000个细胞接种于96孔板。37 ℃、5%CO2中培养12 h后,按确定浓度加入药物,每组细胞做6个复孔。细胞加入药物培养48 h后,每孔加入20 μL 5 g/L的MTT溶液,培养4 h后小心吸弃孔内培养上清液,每孔加入150 μL DMSO,摇床上振荡10 min,使结晶充分溶解。490 nm波长测吸光度(A)值,计算4组细胞的生存率。细胞生存率(%)=(给药组-空白对照组)/(阴性对照组-空白对照组)×100%。
3统计学处理
采用SPSS 17.0统计分析软件,计量数据检验正态性和方差齐性后,以均数±标准差(mean±SD)表示,各组间均数采用多样本单因素方差分析,两两组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1获得NICD高表达和Notch1基因敲低的U251细胞
按照前述转染和筛选方法,共获得4组细胞:NICD高表达U251细胞(pLVX-NICD)、高表达对照空载细胞(pLVX)、Notch1基因敲低的U251细胞(pLKO-Notch1-ND)和RNA干扰对照细胞(pLKO-Notch1-NC)。采用Western blot和免疫荧光染色法检测结果均显示,NICD高表达和Notch1基因敲低的U251细胞中Notch1的表达出现明显变化,见图1、2。
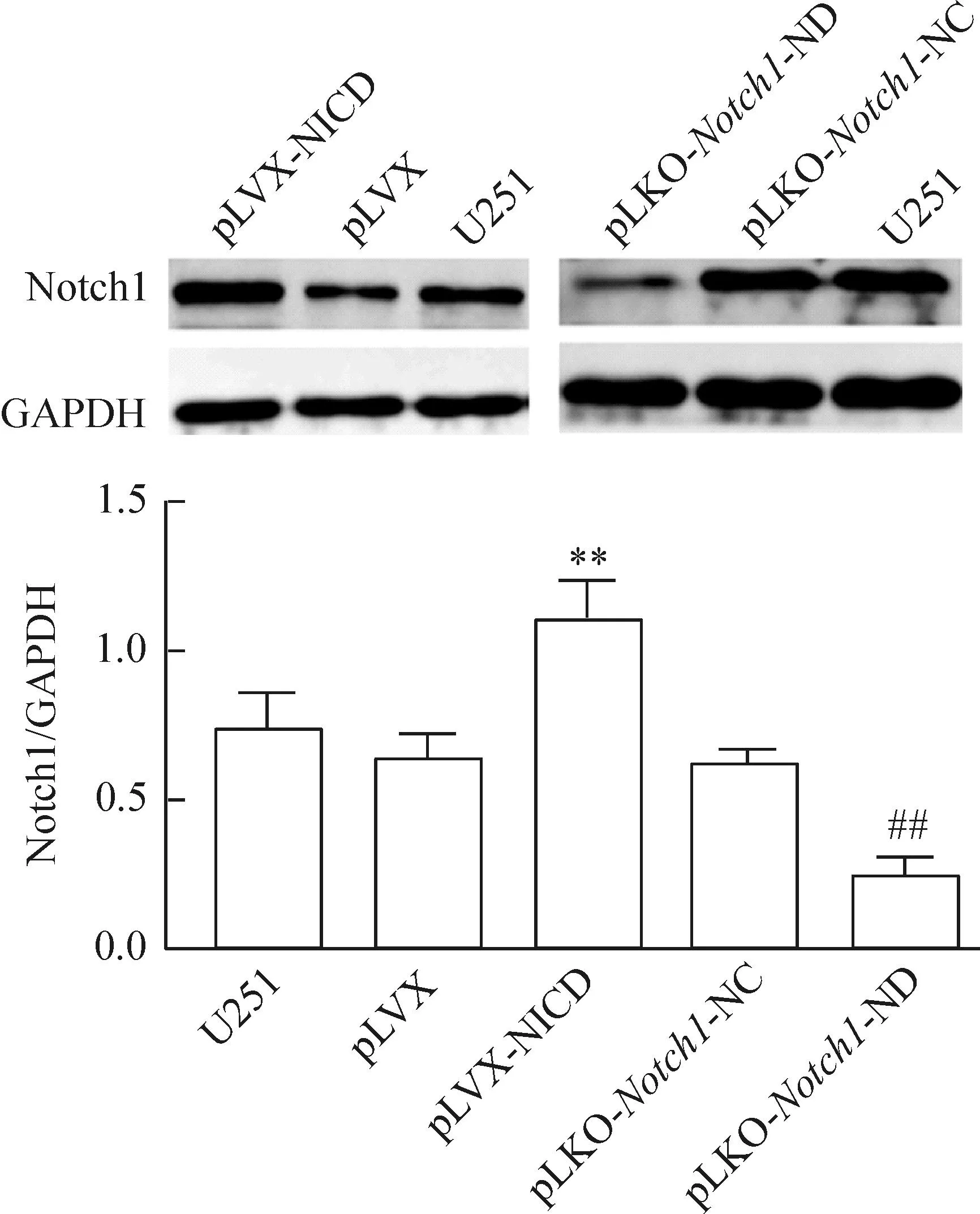
Figure 1.The protein expression of Notch1 in each group detected by Western blot. Mean±SD.n=3.**P<0.01vspLVX;##P<0.01vspLKO-Notch1-NC.
图1Western blot检测各组细胞Notch1蛋白的表达水平
2Notch1表达对U251细胞干性表型的调节
2.1Notch1表达影响U251细胞CD133+表型流式细胞术检测结果显示NICD高表达的U251细胞中CD133+细胞百分率明显高于对照组;而Notch1基因RNA干扰的U251细胞CD133+细胞百分率与对照组相比则降低,见图3。
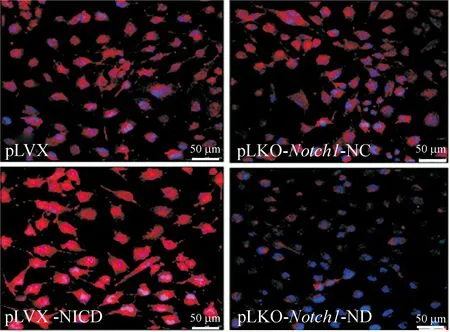
Figure 2.The expression of NICD (red) in each group detected by immunofluorescence staining.
图2免疫荧光染色法鉴定各组细胞NICD的表达
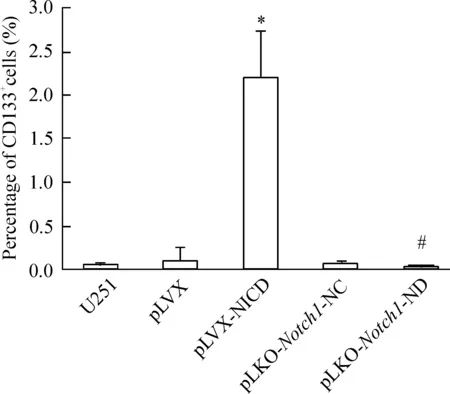
Figure 3.The percentage of CD133+cells in each group. Mean±SD.n=3.**P<0.01vspLVX;##P<0.01vspLKO-Notch1-NC.
图3各组细胞中CD133+细胞的百分率
2.2Notch1表达影响U251细胞中nestin和GFAP的表达免疫荧光强度检测结果显示,NICD高表达细胞的nestin蛋白表达明显强于其对照组,而GFAP表达则明显减弱;Notch1基因RNA干扰组细胞的nestin表达明显减弱,而GFAP表达则明显增强,见图4、5及表1。
2.3Notch1表达影响U251细胞肿瘤球的形成率NICD高表达组的肿瘤球形成率,明显高于其对照组,为对照组2.05倍。而Notch1基因RNA干扰组的肿瘤球形成率则明显低于对照组,见图6。
2.4NICD高表达的U251细胞在SCID小鼠中的成瘤能力增加观察移植的SCID小鼠10周,发现接种1×103和1×105个细胞的NICD高表达组和对照组均未长瘤;接种5×105个细胞的NICD高表达组5只SCID小鼠全部长瘤,瘤大小为(120.64±42.51)mm3,瘤重(0.21±0.11) g,而对照组5只SCID小鼠中只有1只长瘤,瘤大小为78 mm3,瘤重0.10 g,见图7。

Figure 4.The expression of nestin (red) in each group detected by immunofluorescence staining.
图4各组细胞nestin的表达情况
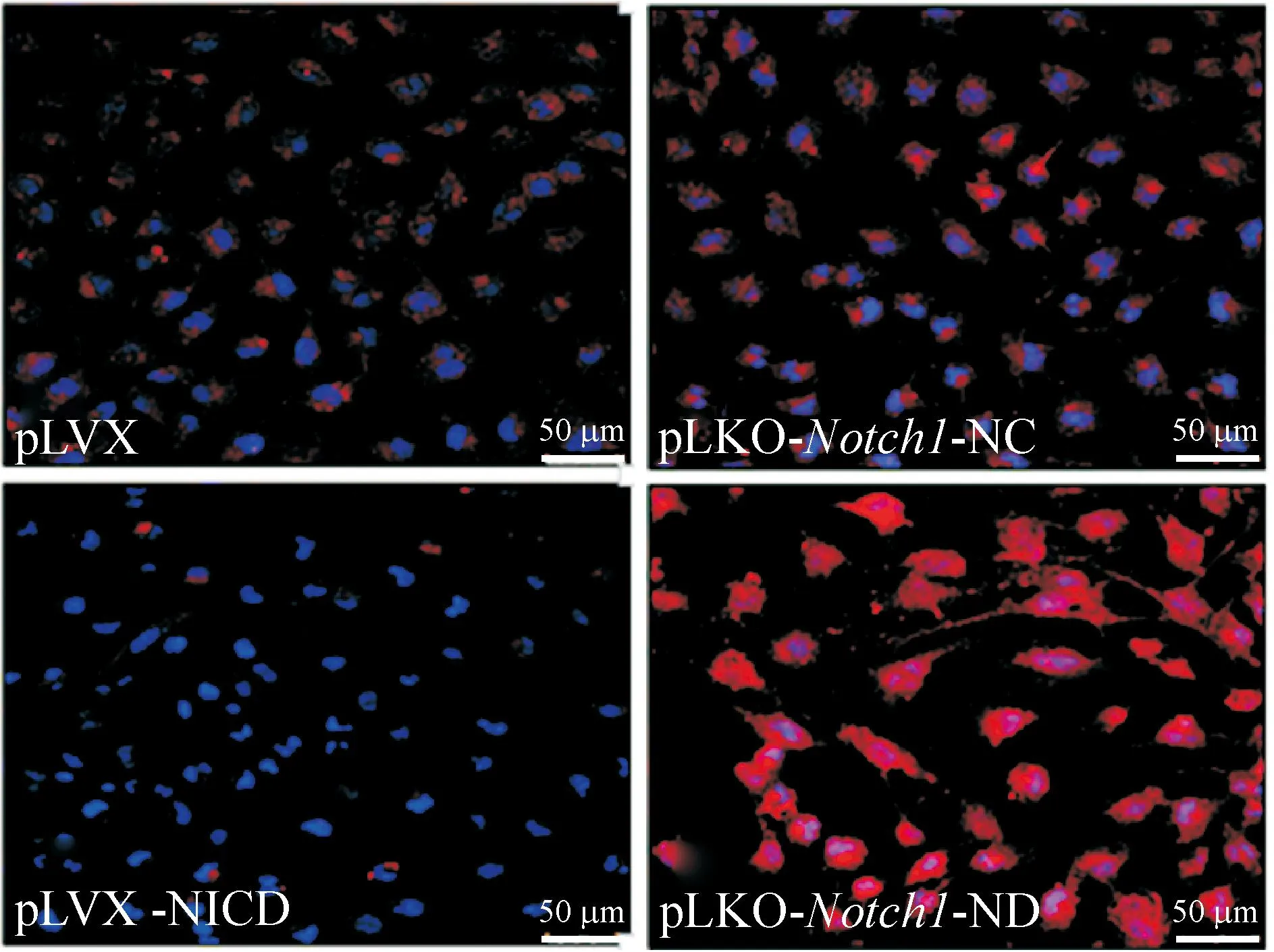
Figure 5.The expression of GFAP (red) in each group detected by immunofluorescence staining.
图5各组细胞GFAP的表达情况
表1各组细胞中Nestin及GFAP的表达情况
Table 1.The expression of Nestin and GFAP in each group (Mean±SD.n=3)

GroupValueofimmunofluorescenceNestinGFAPpLVX36.23±7.8425.55±3.73pLVX-NICD60.75±11.98**12.06±1.79**pLKO-Notch1-NC34.40±6.5631.36±5.64pLKO-Notch1-ND22.40±6.48##89.00±15.28##
**P<0.01vspLVX;##P<0.01vspLKO-Notch1-NC
3Notch1表达影响U251细胞对化疗药物的敏感性
MTT法实验结果显示,在相同浓度VM-26或BCNU作用下NICD高表达组细胞生存率明显高于其对照组;而Notch1基因RNA干扰组细胞生存率则明显低于干扰对照组,见图8。

Figure 6.The formation rate of tumor spheres in each goup cultured with stem cell medium. Mean±SD.n=3.*P<0.05vspLVX;#P<0.05vspLKO-Notch1-NC.
图6各组细胞在干细胞培养液培养后肿瘤球形成率的比较
讨论
已有研究表明,Notch信号通路与胶质瘤发生和发展有关,在胶质瘤中发现Notch信号呈过表达,它在胶质瘤细胞增殖分化及凋亡等中起着重要作用。本研究通过转基因调节Notch1信号的方式,探讨了Notch1表达对胶质瘤U251细胞的干细胞样特性和对化疗药物VM-26、BCNU的敏感性的调节,结果显示:当Notch1信号增强时,U251细胞表现较强的肿瘤干细胞的特征,如CD133+瘤细胞增多、细胞中nestin表达增加而GFAP表达减弱、肿瘤球形成率增加、SCID小鼠皮下移植成瘤性增强,而且对VM-26和BCNU的抗性也都明显增强。这表明在胶质瘤研究和治疗中应重视Notch1表达水平的检测,它可望作为调节胶质瘤化疗敏感性的潜在靶点。
克服肿瘤细胞对化疗药物的耐药性是提高肿瘤疗效的重要内容,CSCs概念的提出为肿瘤细胞耐药研究拓展出一片新的空间,CSCs被认为在药物抵抗及肿瘤的转移过程中发挥了重要的作用,因为CSCs能表达药物转运蛋白及增强DNA修复系统从而使CSCs产生耐药性[4]。有证据表明Notch信号通路与CSCs相关,例如,该通路参与调节结直肠癌的干细胞群[5],也在维持胰腺癌CSCs样表型中发挥重要作用[6]。Farnie等[7]证明了Notch表达上调与乳腺癌干细胞相关的证据,说明Notch和乳腺癌干细胞样特征有关。Zhang等[8]的研究发现,Notch1的激活形式NICD在SHG-44和U87细胞系中可被检测到,并且这2种脑胶质瘤细胞株的增殖快于未检测到NICD的胶质瘤细胞株;SHG-44细胞中NICD的过度表达促进了SHG-44细胞的生长和集落形成;这些集落表达巢蛋白,为具有神经干细胞表型的细胞。Hulleman等[9]发现转录因子HEY1作为Notch信号通路的一个下游靶分子,在胶质瘤中显著上调,且多形性胶质母细胞瘤中HEY1的表达与肿瘤分级和生存相关,而通过RNA干扰技术沉默HEY1,将使组织培养中的胶质母细胞瘤增殖减弱。在胶质瘤干细胞中,干扰素调节因子7可抑制白细胞介素6-Janus激酶信号转导与Jagged-Notch信号通路活化,导致胶质瘤干细胞标志物表达下降,肿瘤细胞球形成能力及致瘤性降低[10]。本实验通过转基因过表达NICD进一步证实了Notch1信号高表达能够使胶质瘤细胞呈干细胞样的表型。

Figure 7.Over-expression of NICD enhanced the formation of xenograft tumor in SCID mice.
图7高表达NICD增加U251细胞在SCID小鼠移植成瘤
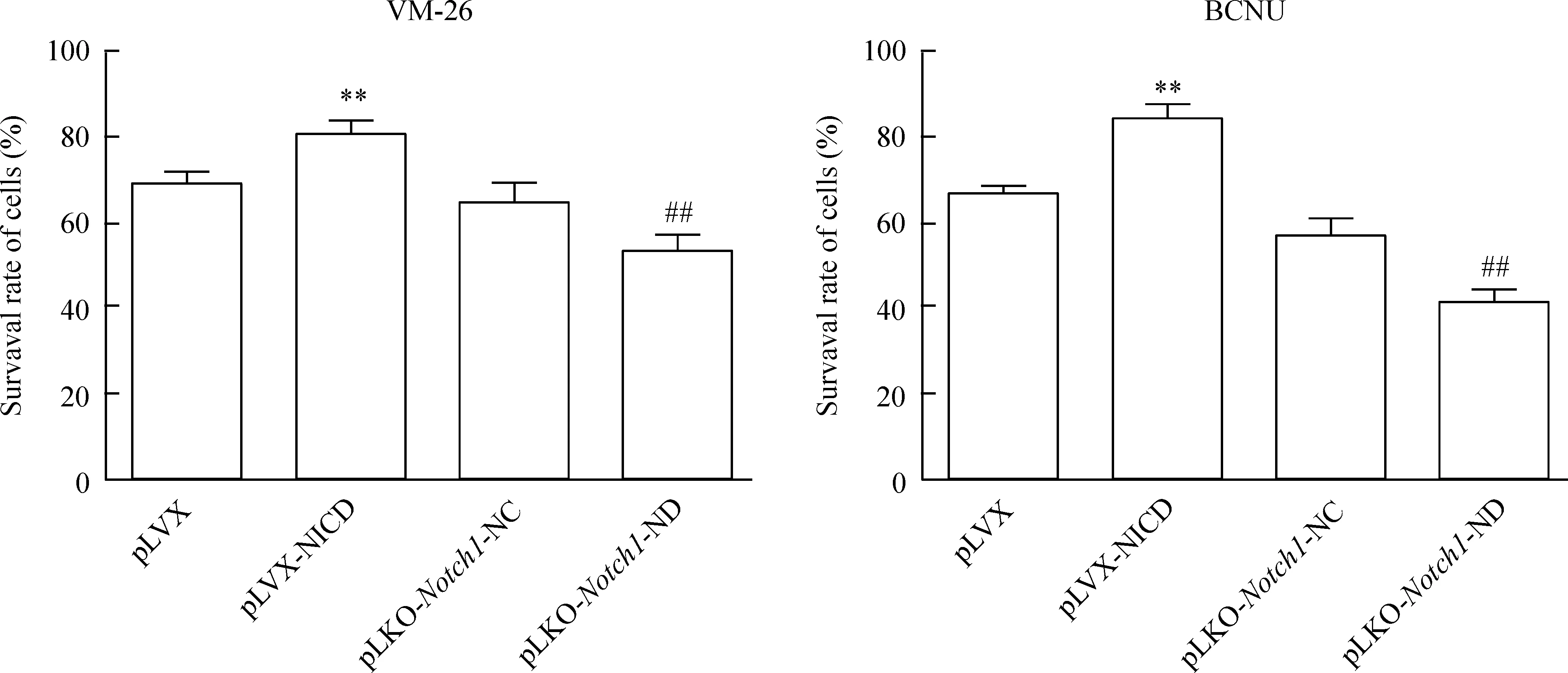
Figure 8.The effects of chemotherapeutics on the survival rate of the cells with different treatments. Mean±SD.n=3.**P<0.01vsplvx;##P<0.01vspLKO-Notch1-NC.
图8各组瘤细胞在化疗药物作用下的生存率
化疗是癌症治疗中重要的治疗手段。然而,因为药物抗性的作用,化疗不能消灭所有的肿瘤细胞,这也是肿瘤复发最主要的原因。最近,有研究报道Notch信号通路与药物抗性有关。更重要的是,Notch调节肿瘤干细胞的形成,促进细胞获得上皮-间质转变表型,它和药物抗性显著相关[11-12]。许多研究发现,在乳腺癌、胰腺癌、结肠癌等许多肿瘤中,抑制Notch1的表达,会提高肿瘤细胞对化疗药物的敏感性[13-15]。沉默Notch1基因可通过激活JNK1信号通路活化p53,促进PUMA和NOXA蛋白表达,进而通过线粒体途径导致人乳腺癌MCF-7细胞凋亡[16]。在胶质瘤中,抑制Notch信号通路可增强CD133+胶质瘤细胞对化疗药物替莫唑胺的敏感性[17]。本实验结果也提示,当Notch1信号增强时,U251细胞表现较强的肿瘤干细胞的特征,而且对VM-26和BCNU的抗性也明显增强。据研究报道肿瘤耐药最常见的原因是表达一种或更多种能量依赖的转运蛋白(它可以发现细胞中的化疗药物并将它排出)、药物诱导的凋亡及药物诱导的解毒功能失常[18]。例如,ABC药物转运蛋白可以保护肿瘤细胞免受化疗药物的伤害。ABC转运蛋白将毒性药物排出癌细胞,使药物杀死肿瘤细胞的作用下降。ABCC1(多药耐药相关蛋白1,multidrug resistance-associated protein 1.MRP1)、ABCB1(P-糖蛋白)和ABCG2(乳腺癌耐药蛋白)3种ABC转运蛋白已被鉴定[19]。已有研究发现,MRP1与神经胶质瘤的耐药性有关。在神经胶质瘤组织和胶质瘤细胞株中均检测到MRP1的表达[20]。Calatozzolo等[21]发现在人脑胶质瘤组织切片中,MRP1的阳性率达70%,且胶质瘤Ⅱ、Ⅲ、Ⅳ级没有明显的等级差异性,在原发性和复发性胶质瘤中也没有显著区别。Spiegl-Kreinecker等[22]的研究表明随着胶质瘤恶性级别的增加,MRP1表现出阳性率逐渐增加的趋势。
本实验研究表明Notch1信号的增强可以促进肿瘤干细胞样细胞的形成与增殖,而且也影响神经胶质瘤细胞对化疗药物的敏感性。因此,Notch1表达水平可作为研判胶质瘤的干细胞性和预测化疗敏感性的指标,干预Notch1信号可望成为胶质瘤治疗的干预靶点,以克服其药物抗性作用和杀死胶质瘤干细胞样细胞,提高对胶质瘤的化疗效果。
[参考文献]
[1]Haar CP, Hebbar P, Wallace GC 4th, et al. Drug resistance in glioblastoma: a mini review[J]. Neurochem Res, 2012, 37(6):1192-1200.
[2]Lamszus K, Günther HS. Glioma stem cells as a target for treatment[J]. Target Oncol, 2010, 5(3):211-215.
[3]Nickoloff BJ, Osborne BA, Miele L. Notch signaling as a therapeutic target in cancer: a new approach to the development of cell fate modifying agents[J]. Oncogene, 2003, 22(42): 6598-6608.
[4]Styczynski J, Drewa T. Leukemic stem cells: from metabolic pathways and signaling to a new concept of drug resistance targeting[J]. Acta Biochim Pol, 2007, 54(4):717-726.
[5]Neradugomma NK, Subramaniam D, Tawfik OW, et al. Prolactin signaling enhances colon cancer stemness by modulating Notch signaling in a Jak2-STAT3/ERK manner[J]. Carcinogenesis, 2014, 35(4):795-806.
[6]Phillips TM, Kim K, Vlashi E, et al. Effects of recombinant erythropoietin on breast cancer-initiating cells[J]. Neoplasia, 2007, 9(12):1122-1129.
[7]Farnie G, Clarke RB. Mammary stem cells and breast cancer: role of Notch signalling[J]. Stem Cell Rev, 2007, 3(2):169-175.
[8]Zhang XP, Zheng G, Zou L, et al. Notch activation promotes cell proliferation and the formation of neural stem cell-like colonies in human glioma cells[J]. Mol Cell Biochem, 2008, 307(1-2):101-108.
[9]Hulleman E,Quarto M,Vernell R, et al. A role for the transcription factor HEY1 in glioblastoma[J]. J Cell Mol Med, 2009, 13(1):136-146.
[10]Jin X, Kim SH, Jeon HM, et al. Interferon regulatory factor 7 regulates glioma stem cells via interleukin-6 and Notch signalling[J]. Brain, 2012, 135((Pt 4):1055-1069.
[11]Wang Z, Li Y, Kong D, et al. Cross-talk between miRNA and Notch signaling pathways in tumor development and progression[J]. Cancer Lett, 2010, 292(2):141-148.
[12]Wang Z, Li Y, Banerjee S, et al. Emerging role of Notch in stem cells and cancer[J]. Cancer Lett, 2009, 279(1):8-12.
[13]Zang S, Chen F, Dai J, et al. RNAi-mediated knockdown of Notch-1 leads to cell growth inhibition and enhanced chemosensitivity in human breast cancer[J]. Oncol Rep, 2010, 23(4):893-899.
[14]Yeh TS, Hsieh RH, Shen SC, et al. Nuclear βII-tubulin associates with the activated Notch receptor to modulate notch signaling[J]. Cancer Res, 2004, 64(22):8334-8340.
[15]Akiyoshi T, Nakamura M, Yanai K, et al. Gamma-secretase inhibitors enhance taxane-induced mitotic arrest and apoptosis in colon cancer cells[J]. Gastroenterology, 2008, 134(1):131-144.
[16]袁磊,陈旭东,范文娟,等. 沉默Notch1基因促进人乳腺癌MCF-7细胞JNK1和p53磷酸化[J]. 中国病理生理杂志,2013, 29(6):1014-1020.
[17]Ulasov IV, Nandi S, Dey M, et al. Inhibition of Sonic hedgehog and Notch pathways enhances sensitivity of CD133+glioma stem cells to temozolomide therapy[J]. Mol Med, 2011, 17(1-2):103-112.
[18]Gottesman MM. Mechanisms of cancer drug resistance[J]. Annu Rev Med, 2002, 53:615-627.
[19]Szakács G, Paterson JK, Ludwig JA, et al. Targeting multidrug resistance in cancer[J]. Nat Rev Drug Discov, 2006, 5(3):219-234.
[20]Jones PM, George AM. The ABC transporter structure and mechanism: perspectives on recent research[J]. Cell Mol Life Sci, 2004, 61(6):682-699.
[21]Calatozzolo C, Gelati M, Ciusani E, et al. Expression of drug resistance proteins Pgp, MRP1, MRP3, MRP5 and GST-π in human glioma[J]. J Neurooncol, 2005, 74(2):113-121.
[22]Spiegl-Kreinecker S, Buchroithner J, Elbling L, et al. Expression and functional activity of the ABC-transporter proteins P-glycoprotein and multidrug-resistance protein 1 in human brain tumor cells and astrocytes[J]. J Neurooncol, 2002, 57(1):27-36.
(责任编辑: 卢萍, 罗森)

