HPLC-Q-TOF-MS-MS测定桑椹中多酚类物质
2015-12-10李辰辰陆小腾驾童华荣
李辰辰,陆小腾驾,童华荣*
(西南大学食品科学学院,重庆 400716)
HPLC-Q-TOF-MS-MS测定桑椹中多酚类物质
李辰辰,陆小腾驾,童华荣*
(西南大学食品科学学院,重庆 400716)
采用高效液相色谱与四极杆飞行时间串联质谱(high performance liquid chromatography of quadrupole time of fl ight-tandem mass spectrometry,HPLC-Q-TOF-MS-MS)联用技术定性检测桑椹中多酚类物质,新鲜桑椹样品经体积分数80%丙酮溶液超声辅助提取15 min后,采用C18固相萃取小柱分离纯化,纯化后的样品进行质谱鉴定。采用HPLC-Q-TOF-MS-MS对多酚进行分析:初步鉴定了桑椹中存在14 种多酚类物质,主要以酚酸、花色苷和黄酮的形式存在。其中6 种酚酸:3-O-咖啡酰奎宁酸、4-O-咖啡酰奎宁酸、二聚绿原酸、二聚4-O-咖啡酰奎宁酸、绿原酸顺式异构体、3,5-O-二咖啡酰基奎宁酸。4 种花色苷:飞燕草-3-半乳糖苷、飞燕草-3-葡萄糖苷、矢车菊-3-葡萄糖苷、矢车菊-3-芸香糖苷;3 种黄酮:芦丁、鞣花酸己糖苷和槲皮素3-O-(6’-O-丙二酰)葡萄糖苷,1 种白藜芦醇衍生物。HPLC-Q-TOF-MS-MS可以鉴定出桑椹的多酚类物质。
桑葚;多酚;高效液相色谱;四极杆飞行时间质谱
桑椹又名桑果、桑葚、桑枣、桑实、葚子、乌葚等,为桑科落叶乔木桑树(Morus alba Linn.)的果实[1],其含有大量游离酸和18 种氨基酸,此外还含有人体缺少的锌、铁、钙、锰等矿物质和微量元素,以及胡萝卜素、果糖、葡萄糖、丁二酸果胶、纤维素等,并含有果胶、无机盐类和紫红色色素等,各营养成分含量显著高于常见水果[2]。研究表明,桑椹中含有较多的多酚类物质,多酚类物质是植物的次生代谢产物[3],其不仅具有抗氧化、抗自由基、抑制低密度脂蛋白的氧化以及预防心血管疾病的作用,还具有抗癌、抗炎症和抗血小板凝聚等功能[4-6]。邓义书[7]研究桑椹果渣中含有的多酚类化合物的功能活性,发现其具有很强的抗氧化活性及抑菌功能。
近年来,国内对桑椹多酚的研究主要集中在对桑椹总多酚的提取及含量测定,其中紫外分光光度法[8]最为广泛,桑椹多酚类物质的定性鉴定则多采用高效液相色谱技术[9],高效液相色谱-四极杆飞行时间质谱(high performance liquid chromatography of quadrupole time offlight-tandem mass spectrometry,HPLC-Q-TOF-MSMS)联用技术是近年来发展起来的一项新的天然产物有效成分定性定量分析技术,可以在缺少对照品的情况下对粗提物中微量成分进行结构分析,具有高效快速,灵敏度高的优点[10-14],本研究利用HPLC-Q-TOFMS-MS联用技术对桑椹的多酚类化合物进行定性分析,得到精确的相对分子质量和分子的碎片信息,结合文献资料推断出桑椹多酚的结构,实现了对桑椹多酚类化合物的定性分析,为开发利用这一丰富的自然资源提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
桑椹鲜果,采摘于重庆市桑蚕科技园,重庆蚕科院黄传书老师鉴定为桑科落叶乔木桑树的果实。样品采集时间为2012年4月。样品分装后在—40 ℃冷冻贮藏。
丙酮、甲醇、乙醇、乙酸乙酯(均为分析纯)成都市科龙化工试剂厂;氮气、甲酸、乙腈(均为色谱纯) 德国Merck公司。
1.2 仪器与设备
KQ3200DB型数控超声波清洗仪 昆山市超声仪器有限公司;ETC-H6超低温冰箱 青岛海尔特种电器有限公司;HWS-26恒温水浴锅、DHG-9140恒温鼓风干燥箱 上海齐欣科学仪器有限公司;RE-5296旋转蒸发器上海亚荣生化仪器厂;E1001固相萃取装置 美国Waters公司;1200高效液相色谱仪(连接有二元泵、微型真空脱气机、自动进样器、柱温箱、二极管阵列检测器、G6540A MS Q-TOF质谱检测器) 美国安捷伦公司。
1.3 方法
1.3.1 样品提取
在放置桑椹鲜果的—40 ℃冰箱中取约60 g桑椹,放入打浆机中,打浆1~2 min成匀浆,备用。取5 g桑椹匀浆于100 mL烧杯中,加入体积分数80%丙酮溶液50 mL置于超声波清洗器中,设定超声功率150 W、提取温度25 ℃、提取时间15min,于45 ℃条件下旋转浓缩至近干后,用水定容于25 mL棕色容量瓶中,待纯化。
1.3.2 样品纯化
参照Sun等[15]方法处理Supelco C18小柱(3 mL、500 mg),先用6 mL甲醇,6 mL水活化,再用乙酸乙酯-丙酮(4∶1,V/V)混合溶液洗脱。用0.45 μm滤膜过滤,得滤液。上样2 mL,用6 mL水淋洗,6 mL乙酸乙酯-丙酮溶液洗脱,收集洗脱液。将洗脱液于氮吹仪中40 ℃吹干,而后用甲醇定容于10 mL棕色容量瓶中,过0.45 μm有机滤膜,备用。
1.3.3 仪器分析条件
1.3.3.1 色谱分析条件
色谱柱:ZORBAX SB C18(250 mm×4.6 mm,5 μm);流动相:A为2%甲酸,B为100%乙腈;梯度洗脱:0~5 min,9% B;5~25 min,9~11.5% B;25~30 min,11.5%~25% B;30~45 min,25%~31% B;45~46 min,31%~9% B;46~50 min,9% B;流速0.7 mL/min;进样量5 μL;柱温35 ℃;色谱数据在220~600 nm波长范围内扫描,检测波长214、280、320、524 nm。
1.3.3.2 质谱分析条件
一级质谱条件:将1200高效液相色谱仪中色谱柱流出液,用T-型分流器(分流比1∶3)引入G6540A MS Q-TOF质谱检测器。
电喷雾离子源;MS电喷雾离子化负离子模式;扫描范围100~1 200 u;扫描速率1.00 mL/min;干燥气(N2)流速8.0 L/min;干燥气温度360 ℃;喷雾气压力35 psi;毛细管电压3000 V;碎裂器电压100 V。
二级质谱条件:质量扫描范围50~800 u;碰撞能量根据一级质谱所得化合物相对分子质量设定8~30 eV。
2 结果与分析
2.1 主要色谱峰的鉴定
按1.3节方法得到桑椹多酚主要色谱图(图1),桑椹中多酚类物质能够得到分离。通过一级质谱信息、二级质谱信息及光谱信息与文献报道比较进行鉴定,结果见表1。
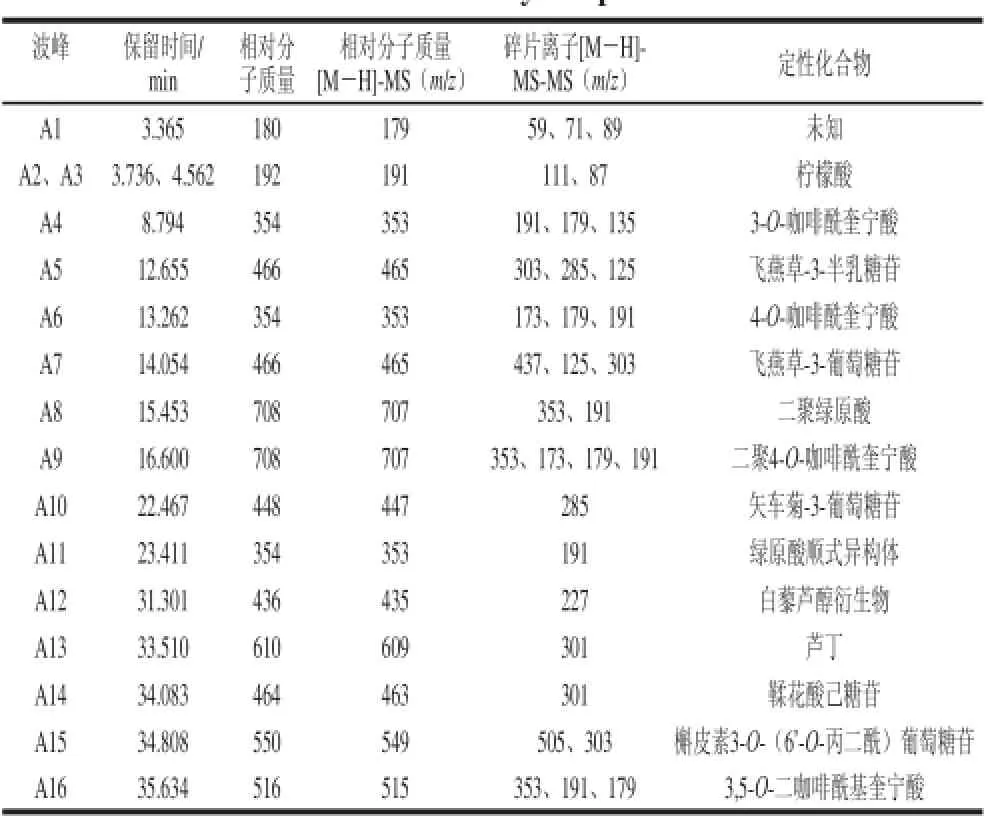
表 1 桑椹分离纯化样中鉴定的多酚化合物的质谱数据Table 1 Identifi cation of phenolic compounds isolated and purified from mulberry samples
2.2 桑椹多酚的鉴定
A2和A3保留时间分别为3.736 min和4.562 min,相对分子质量为191.1的柠檬酸标品准分子离子保留时间分别为3.821 min和4.543 min,再将子离子碎片进行比对,发现柠檬酸标品进行子离子扫描也得到m/z为111的子离子碎片,与柠檬酸标准品一致,因此可以判断A2和A3为柠檬酸。但是出现2 个柠檬酸峰A2和A3的原因还不清楚。
A4碎片离子m/z为191.1是奎宁酸192.1在质谱负模式条件下失去了一个质量数为1的氢离子碎片而得,碎片离子m/z为179是由咖啡酸在质谱负模式条件下失去了一个质量数为1的氢离子碎片而得,准分子离子m/z 353.1=192.1+180—18—1。3 个子离子碎片与Clifford等[16]报道的一致,因此判断A4为3-O-咖啡酰奎宁酸。
A5碎片离子m/z为303为花青素苷元飞燕草花色苷产生的离子碎片飞燕草色素,准分子离子m/z 465.10—303=162.10,是由分子离子失去了一个质量数为162.1的中性碎片(脱水葡萄糖)而得。子离子碎片与Kammerer等[17]报道的一致,因此判断A5是飞燕草-3-半乳糖苷。
A6中碎片离子m/z为173是奎宁酸在质谱负模式条件下失去了一个质量数为18的水和质量数为1的氢离子碎片而得,碎片离子m/z为179是咖啡酸在质谱负模式条件下失去了一个质量数为1的氢离子碎片而得,准分子离子m/z 353.1=192.1—18—1+180。3 个子离子碎片与Clifford等[16]报道的一致,因此判断A6为4-O-咖啡酰奎宁酸(4-CQA)。
A7中碎片离子m/z为303为花青素苷元飞燕草花色苷产生的离子碎片飞燕草色素,m/z=465.10—303=162.10,是分子离子失去了一个质量数为162的中性碎片(脱水葡萄糖)而得。子离子碎片与Wu等[18]报道的一致,因此判断A7为飞燕草-3-葡萄糖苷。
A8碎片离子m/z为353是咖啡酰奎宁酸354在质谱负模式条件下失去了一个质量数为1的氢离子碎片,碎片离子m/z为191是奎宁酸192在质谱负模式条件下失去了一个质量数为1的氢离子碎片。m/z为707.2的母离子可能是2 个咖啡酰奎宁酸通过加聚反应得到。因此判断A8可能为二聚咖啡酰奎宁酸。
A9碎片离子m/z为353是咖啡酰奎宁酸354在质谱负模式条件下失去了一个质量数为1的氢离子碎片,碎片离子m/z为191是奎宁酸192在质谱负模式条件下失去了一个质量数为1的氢离子碎片,碎片离子m/z为179是咖啡酸180在质谱负模式条件下失去了一个质量数为1的氢离子碎片,碎片离子m/z=173是奎宁酸192在质谱负模式条件下失去了一个质量数为18的水和质量数为1的氢离子碎片。m/z为707.2的母离子可能由2个4-O-咖啡酰奎宁酸通过加聚反应得到。因此判断A9可能为二聚4-O-咖啡酰奎宁酸。
A10中碎片离子m/z为285为花青素苷元矢车菊花色苷产生的离子碎片矢车菊色素,m/z=447.10—285=162.10,是分子离子失去了一个质量数为162的中性碎片(脱水葡萄糖)而得。子离子碎片与王卫东等[19]报道的一致,因此判断A10为矢车菊-3-葡萄糖苷。
A11中碎片离子m/z为191是奎宁酸192在质谱负模式条件下失去了一个量数为1的氢离子碎片。根据Iranjan等[20]的报道这个物质可能为5-O-咖啡酰奎宁酸即绿原酸,但是根据Weisz等[21]的报道5-O-咖啡酰奎宁酸出峰顺序介于3-O-咖啡酰奎宁酸和4-O-咖啡酰奎宁酸之间,并且绿原酸标准品的保留时间在16.442min,所以不能判断为绿原酸。根据Kammerer等[22]的报道,准分子离子以及碎片离子也完全符合,可以判断A11为绿原酸顺式异构体。
A12中碎片离子m/z为227是白藜芦醇228在质谱负模式条件下失去了一个质量数为1的氢离子碎片,因此A12可能为白藜芦醇的某种衍生物[23]。
A13中碎片离子m/z为308(芦丁苷元)=609.1—301.1,HPLC检测标准品芦丁相对分子质量为609.1,准分子离子保留时间为33.541 min,再将子离子碎片进行比对,发现芦丁标准品进行子离子扫描也得到m/z为301的子离子碎片,因此可以判断A13是芦丁。
A14中碎片离子m/z为301是鞣花酸在质谱负模式条件下失去了一个质量数为1的氢离子碎片而得,m/z=463.10—301=162.10,是分子离子失去了一个质量数为162的中性碎片(脱水葡萄糖)而得。3 个子离子碎片与Mousavinejad等[24]的报道一致,因此判断A14为鞣花酸己糖苷。
A15中碎片离子m/z为301的子离子碎片为槲皮素302在质谱负模式条件下失去了一个质量数为1的氢离子碎片而得。2 个子离子碎片与Arapitsas[25]的报道一致,因此判断A15为槲皮素3-O-(6’-O-丙二酰)葡萄糖苷。
A16中碎片离子m/z为353是咖啡酰奎宁酸354在质谱负模式条件下失去一个质量数为1的氢离子碎片,碎片离子m/z为191是奎宁酸192在质谱负模式条件下失去了一个质量数为1的氢离子碎片,碎片离子m/z为180是咖啡酸180在质谱负模式条件下失去了一个质量数为1的氢离子碎片,3 个子离子碎片与Weisz等[19]的报道一致,因此判断A16为3,5-O-二咖啡酰基奎宁酸。
3 结 论
对桑椹中的多酚进行定性分析,将进行分离纯化后的样品进行Q-TOF负模式质谱分析,结果发现:桑椹中存在13 种多酚类物质,主要以酚酸、花色苷和黄酮的形式存在。其中6 种酚酸都是由咖啡酸和奎宁酸2 种基本基团以一定的方式结合而成,并且发现桑椹中的绿原酸是以顺式异构体的形式存在的,3 种花色苷是由2 种花色素飞燕草素和矢车菊素与六碳糖以糖苷键结合产生,3 种黄酮类多酚芦丁、鞣花酸己糖苷和槲皮素3-O-(6’-O-丙二酰)葡萄糖苷,还有一个白藜芦醇衍生物。本实验对桑椹中多酚类物质进行质谱定性分析,可为桑椹的进一步深入研究和开发提供参考。
[1] 陈小全, 周鲁, 左之利, 等. 超声波作用下桑葚红色素的提取及其稳定性实验[J]. 西南民族大学学报: 自然科学版, 2004, 30(4): 458-459.
[2] 张志强, 杨清香, 孙来华. 桑葚的开发及利用现状[J]. 中国食品添加剂, 2009(4): 65-68.
[3] BOUDET A M. Evolution and current status of research in phenolic compounds[J]. Phytochemistry, 2007, 68(22): 2722-2735.
[4] RODRIGUEZ-MEDINA I C, SEGURA-CARRETERO A, FEMANDEZ G A. Use of high-performance liquid chromatography with diode array detection coupled to electrospray-Qq-time-of-fl ight mass spectrometry for the direct characterization of the phenolic fraction in organic commercial juices[J]. Journal of Chromatography A, 2009, 1216(23): 4736-4744.
[5] LIAZID A, PALMA M, BRIGUI J, et al. Investigation on phenolic compounds stability during microwave-assisted extraction[J]. Journal of Chromatography A, 2007, 1140(1): 29-34.
[6] MAGALHAES A S, SILVA B M, PEREIRA J A, et al. Protective effect of quince Cydonia oblonga Miller fruit against oxidative hemolysis of human erythrocytes[J]. Food and Chemical Toxicology, 2009, 47(6): 1372-1377.
[7] 邓义书. 桑椹果渣多酚化合物提取纯化及功能活性研究[D]. 上海:上海海洋大学, 2011.
[8] 李巨秀, 王柏玉. 福林-酚比色法测定桑椹中总多酚[J]. 食品科学, 2009, 30(18): 292-295.
[9] 孙伟. 桑椹多酚HPLC指纹图谱的研究[D]. 杨凌: 西北农林科技大学, 2007.
[10] 郑振佳, 初玉圣, 迟炳海, 等. 快速分离液相-四极杆飞行时间串联质谱分析大豆中的异黄酮成分[J]. 食品科学, 2011, 32(6): 233-236.
[11] 李文龙, 陈军辉, 殷月芬, 等. 加速溶剂提取-高效液相色谱-电喷雾飞行时间质谱联用分析莲子心中生物碱[J]. 分析化学, 2008, 36(1): 79-82.
[12] 叶茂, 谢国祥, 赵爱华, 等. 超高效液相色谱-飞行时间质谱法测定苦参素注射液中苦参碱和氧化苦参[J]. 中国中药杂志, 2008, 32(12): 1390-1401.
[13] 陈军辉, 李文龙, 杨佰娟, 等. 高效液相色谱-电喷雾飞行时间质谱分析娑罗子中皂苷类成分[J]. 分析化学, 2008, 36(3): 285-291.
[14] 刘劼, 杨黄浩, 黎先春, 等. 高效液相色谱-电喷雾飞行时间质谱分析丹参中的丹参酮类化合物[J]. 质谱学报, 2008, 29(5): 261-267.
[15] SUN B, LEANDRO M C, de FREITAS V, et al. Fractionation of red wine polyphenolsby solid-phase extraction and liquid chromatography[J]. Journal of Chromatography A, 2006, 1128(1): 27-38.
[16] CLIFFORD M N, JOHNSTON K L, KNIGHT S, et al. Hierarchical scheme for LC-MS identifi cation of chlorogenic acids[J]. Journal of Agricultural and Food Chemistry, 2003, 51(10): 2900-2911.
[17] KAMMERER D, CLAUS A, CARLE R, et al. Polyphenol screening of pomace from red and white grape varieties (Vitis vinifera L.) by HPLC-DAD-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2004, 52(14): 4360-4367.
[18] WU X, PRIOR R L. Systematic identification and characterization of anthocyanins by HPLC-ESI-MS/MS in common foods in the United States: fruits and berries[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2589-2599.
[19] 王卫东, 李超, 许时婴. 高效液相色谱-串联质谱法分离鉴定黑莓花色苷[J]. 食品科学, 2009, 30(14): 230-234.
[20] IRANJAN A, BARTHWAL J, LEHRI A, et al. Development and validation of an HPLC-UV-MS-MS method for identification and quantification of polyphenols in Artemisia pallens L.[J]. Acta Chromatographica, 2009, 21(1): 105-116.
[21] WEISZ G M, KAMMERER D R, CARLE R. Identification and quantification of phenolic compounds from sunflower Helianthus annuus kernels and shells by HPLC-DAD/ESI-MS[J]. Food Chemistry, 2009, 115(2): 758-765.
[22] KAMMERER D, CARLE R, SCHIEBER A. Characterization of phenolic acids in black carrots (Daucus carota ssp. sativus var. atroru bens Alef.) by high performance liquid chromatography/ electrospray ionization mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2004, 18(12): 1331-1340.
[23] MAATTA-RIIHINEN K R, KAMAL-ELDIN A, TORRONEN A R. Identification and quantification of phenolic compounds in berries of Fragaria and Rubus species family Rosaceae[J]. Journal of Agricultural and Food Chemistry, 2004, 52(20): 6178-6187.
[24] MOUSAVINEJAD G, EMAM-DJOMEH Z, REZAEI K, et al. Identification and quantification of phenolic compounds and their effects on antioxidant activity in pomegranate juices of eight Iranian cultivars[J]. Food Chemistry, 2009, 115(4): 1274-1278.
[25] ARAPITSAS P. Identification and quantification of polyphenolic compounds from okra seeds and skins[J]. Food Chemistry, 2008, 110(4): 1041-1045.
Analysis of Phenolic Compounds in Mulberry by High Performance Liquid Chromatography-Time of Flight Mass Spectrometry
LI Chenchen, LU Xiaotengjia, TONG Huarong*
(College of Food Science, Southwest University, Chongqing 400716, China)
High performance liquid chromatography (HPLC)-time of flight mass spectrometry (TOF) was used to qualitatively determine the phenolic compounds of mulberry. It was found that using acetone-distilled water (4:1, V/V) as the extraction solvent, ultrasonic extraction for 15 min was the optimal extraction method. Solid-phase extraction using a C18cartridge was effective for isolating polyphenols from sugars and amino acids, which facilitated the subsequent identification by mass spectrometry. A total of 14 polyphenols in mulberry were found mainly in the forms of phenolic acids, anthocyanin and fl avonoids, including six phenolic acids, 3-O-caffeoylquinic acid, 4-O-caffeoylquinic acid, chlorogenic acid dimer, 4-O-caffeoylquinic acid dimer, cis-iso-isomers chlorogenic acid, and 3,5-di-O-caffeoyl quinic acid; four anthocyanins, prodelphinidin-3-galactosidase, prodelphinidin-3-glucoside, cyaniding-3-glucoside, and cyaniding-3-rutinoside; three fl avonoids, rutin, ellagic acid hexyl glycoside, and quercetin 3-O-(6’-O-malonyl) glycoside; as well as one resveratrol derivative.
mulberry; phenolic compounds; high performance liquid chromatography; quadrupole time of flight-mass spectrometry (Q-TOF-MS)
TS207.3
A
1002-6630(2015)02-0101-04
10.7506/spkx1002-6630-201502019
2014-06-25
“十二五”国家科技支撑计划项目(2012BAD33B00)
李辰辰(1990—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:1052416235@qq.com
*通信作者:童华荣(1964—),男,教授,博士,研究方向为食品质量与安全、茶叶化学与生物化学。E-mail:huart@swu.edu.cn
