聚甘油脂肪酸酯的结构鉴定
2022-08-17林晓珊罗辉泰梁梓洋梁梓豪朱志鑫吴惠勤
林晓珊,罗辉泰,黄 芳,梁梓洋,周 熙,梁梓豪,朱志鑫,邓 欣,吴惠勤
(广东省科学院测试分析研究所(中国广州分析测试中心) 广东省化学测量与应急检测技术重点实验室,广东省中药质量安全工程技术研究中心,广东 广州 510070)
聚甘油脂肪酸酯(Polyglycerol fatty acid esters),又称聚甘油酯,是一类新型、高效和性能优良的多羟基酯类非离子型表面活性剂,由于聚甘油酯有更多亲水性羟基,使得其乳化性能显著优于单甘油酯;且其亲水性随甘油聚合度的增加而增强,亲油性随脂肪酸烷基的不同而不同。故可通过改变聚合度、脂肪酸种类及酯化度,得到一系列不同亲水亲油平衡值(HLB 值)的从亲油到亲水的不同性能的聚甘油酯产品,以适于各种特殊用途。聚甘油酯为淡黄色油状液体或蜡状固体,兼有亲水、亲油双重特性,具有良好乳化、分散、湿润、稳定、起泡等多重性能。在人体代谢过程中可分解,从而可参与代谢,被人体利用,具有高度安全性,是一类高效安全添加剂,被联合国粮农组织(FAO)和世界卫生组织(WHO)推荐使用[1-3]。同时聚甘油酯在酸性、碱性和中性环境中稳定,不易发生水解,在含盐量较高时也有很好的乳化性,可与其它乳化剂复配,具有良好协同增效作用,因而广泛应用于食品[4-8]、日化[9-14]、石油、纺织、涂料、塑料、农药、橡胶、医药等领域。
聚甘油脂肪酸酯中聚甘油的聚合度、脂肪酸的种类对其性能影响较大,因此对聚甘油脂肪酸酯的结构进行鉴别十分重要,但目前未见相关文献报道。
本文采用傅里叶变换离子回旋共振质谱(FT-ICR-MS)、核磁共振氢谱(1H NMR)以及气相色谱-质谱(GC-MS)技术[15-16],对聚甘油脂肪酸酯的结构进行鉴定。样品溶解后进行FT-ICR-MS测定,根据精确分子离子数据,推测出聚甘油脂肪酸酯的基本结构以及甘油的聚合度,随后采用1H NMR 进行验证。水解后对脂肪酸部分进行甲酯化,以正庚烷萃取,经GC-MS 测定,分析脂肪酸的组成。综合上述结果即可确定聚甘油脂肪酸酯的结构。该研究为聚合物的结构鉴定提供了一种新的思路和方法。
1 实验部分
1.1 仪器、试剂与样品
Bruker solariX XR 7.0T傅里叶变换离子回旋共振串联质谱仪、Bruker Avance DPX-300超导脉冲傅里叶变换核磁共振谱仪(美国布鲁克公司);Agilent 6890GC/5973iMS 气相色谱-质谱仪(美国安捷伦公司);赛多利斯TP-114电子天平(美国Sartorious公司);氮吹仪(上海安谱科学仪器有限公司)。
甲醇(色谱纯,德国Merck 公司);氘代氯仿(CDCl3,99.80%D,上海迈瑞尔化学技术有限公司);氢氧化钠、三氟化硼、正庚烷、氯化钠、无水硫酸钠(分析纯,广州化学试剂厂);实验用水为二次蒸馏水。
样品为白色颗粒,由某公司生产,主要可作为乳化剂、稳定剂、分散剂、增稠剂、消泡剂、品质改良剂、油脂结晶调整剂、巧克力稠度调整剂、杀菌剂。
1.2 样品前处理
FT-ICR-MS:称取粉碎后的样品约0.1 g,精密称定,置于100 mL 容量瓶中,加入甲醇,超声溶解,定容至刻度,过0.45µm滤膜,待FT-ICR-MS测定。
1H NMR:称取粉碎后的样品约0.1 g,加入0.5 mL CDCl3溶解后,待1H NMR测定。
GC-MS:称取粉碎后的样品约0.1 g,精密称定,置50 mL 锥形瓶中,加2%氢氧化钠的甲醇溶液2 mL,置65 ℃水浴中加热回流30 min,放冷,然后加14%三氟化硼的甲醇溶液2 mL,于水浴中加热回流30 min,放冷,再加正庚烷4 mL,继续在水浴中加热回流5 min,放冷后加饱和氯化钠溶液10 mL,振摇,静置使其分层。取上层液,用水洗涤3 次,每次4 mL,经无水硫酸钠干燥后作为供试品溶液,待GC-MS测定。
1.3 实验条件
1.3.1 FT-ICR-MS测试条件离子源为双喷Jet Stream源(Dual Jet Stream ESI),以正、负离子模式分别采集样品;进样流速:2.0µL/min;毛细管入口电压:4500 V;毛细管出口电压:-500 V;喷雾器压力:40 kPa;干燥气温度:200 ℃;干燥气流速:4 L/min;质荷比扫描范围m/z100~2000。
1.3.2 1H NMR 测试条件以CDCl3为溶剂,采用zg30 脉冲序列,测定温度为24 ℃,谱宽(SWH)6173 Hz,弛豫延迟时间(D1)为1 s,采集时间(AQ)为5.31 s,脉冲宽度(P1)为14µs,样品空扫次数(DS)为2次,样品扫描次数(NS)为8次。
1.3.3 GC-MS 测试条件GC 条件:色谱柱:AB-INOWAX(30 m×0.25 mm×0.25µm)弹性石英毛细管柱;载气:He(99.999%);恒流,柱流速:1.0 mL/min;分流进样,分流比:10∶1;进样量:1.0µL;进样口温度:220 ℃;程序升温:柱始温100 ℃,以30 ℃/min升至220 ℃,保持10 min。
MS 条件:离子源:EI 源;离子源温度:230 ℃;四极杆温度:150 ℃;色谱-质谱连接口温度:280 ℃;电子能量:70 eV;电子倍增器电压:1500 V;溶剂延迟时间:4 min;扫描方式:全扫描(SCAN);扫描范围:m/z29~550。
1.3.4 测定方法取上层供试品溶液1.0µL 注入GC-MS 进行分析,样品经气相色谱石英毛细管柱分离,质谱仪记录,得到GC-MS 总离子流图。将各色谱峰相应的质谱图经计算机谱库检索及人工解析确定脂肪酸的组成及化学结构,并用面积归一化法测定其相对含量。
2 结果与讨论
2.1 FT-ICR-MS分析
2.1.1 正离子模式样品溶解后经FT-ICR-MS 进样测试,正离子模式采集,得到的主要峰的质谱图见图1,质荷比计算值与实测值的相对误差如表1所示。

图1 FT-ICR-MS测试得到的样品正离子质谱图Fig.1 The positive ion mass spectrum of the sample obtained by FT-ICR-MS

表1 正离子模式下质荷比计算值与实测值的相对误差Table 1 Relative error between calculated mass-to-charge ratio and measured mass-to-charge ratio in positive ion mode
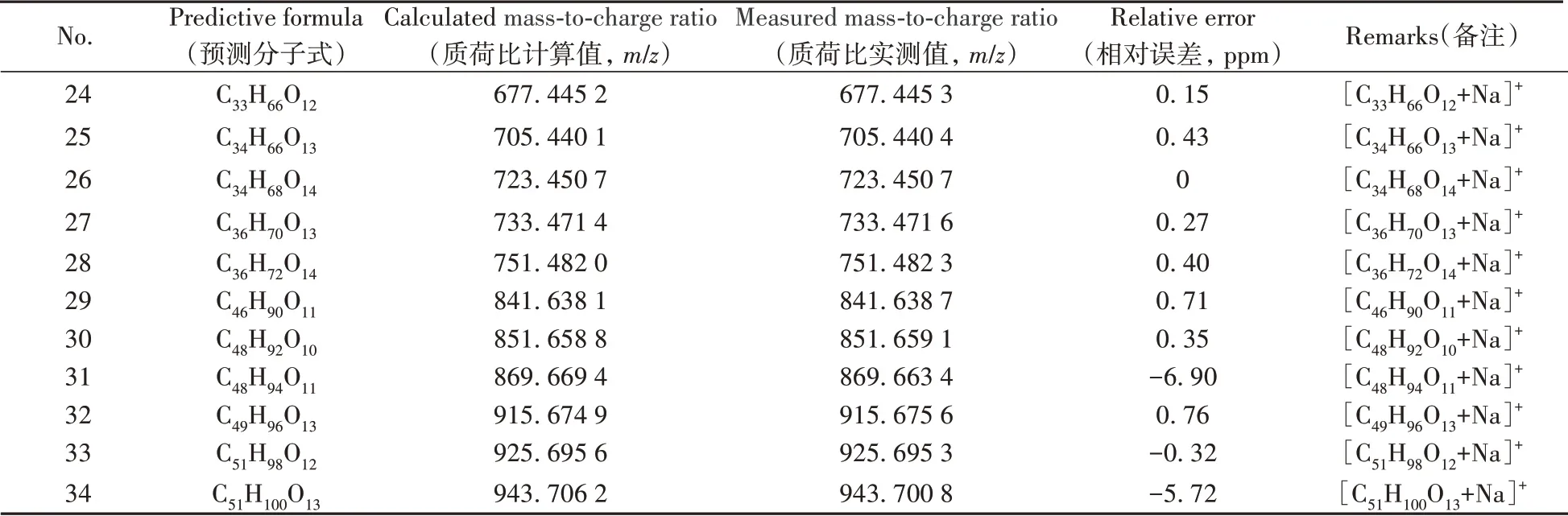
(续表1)
离子峰的归属:
①序号1~10归属为聚甘油峰,归属如下:
质量数为m/z171.0629 的离子,可归属为二聚甘油脱水形成的环状物的加钠峰[C6H12O4+Na]+;质量数为m/z189.0734 的离子,可归属为二聚甘油的加钠峰[C6H14O5+Na]+;质量数为m/z245.0997 的离子,可归属为三聚甘油脱水形成的环状物的加钠峰[C9H18O6+Na]+;质量数为m/z263.1103 的离子,可归属为三聚甘油的加钠峰[C9H20O7+Na]+;质量数为m/z319.1365 的离子,可归属为四聚甘油脱水形成的环状物的加钠峰[C12H24O8+Na]+;质量数为m/z377.1471 的离子,可归属为四聚甘油的加钠峰[C12H26O9+Na]+;质量数为m/z393.1733 的离子,可归属为五聚甘油脱水形成的环状物的加钠峰[C15H30O10+Na]+;质量数为m/z411.1839 的离子,可归属为五聚甘油的加钠峰[C15H32O11+Na]+;质量数为m/z467.2102 的离子,可归属为六聚甘油脱水形成的环状物的加钠峰[C18H36O12+Na]+;质量数为m/z485.2208 的离子,可归属为六聚甘油的加钠峰[C18H38O13+Na]+。
②序号11~28归属为聚甘油单脂肪酸酯峰,归属如下:
质量数m/z437.3241 的离子,可归属为二聚甘油单硬脂酸酯脱水形成的环状物的加钠峰[C24H46O5+Na]+;质量数m/z455.3347的离子,可归属为二聚甘油单硬脂酸酯的加钠峰[C24H48O6+Na]+;质量数m/z483.3296 的离子,可归属为三聚甘油单棕榈酸酯脱水形成的环状物的加钠峰[C25H48O7+Na]+;质量数m/z501.3402 的离子,可归属为三聚甘油单棕榈酸酯的加钠峰[C25H50O8+Na]+;质量数m/z511.3609的离子,可归属为三聚甘油单硬脂酸酯脱水形成的环状物的加钠峰[C27H52O7+Na]+;质量数m/z529.3715的离子,可归属为三聚甘油单硬脂酸酯的加钠峰[C27H54O8+Na]+;质量数m/z557.3665的离子,可归属为四聚甘油单棕榈酸酯脱水形成的环状物的加钠峰[C28H54O9+Na]+;质量数m/z575.3771 的离子,可归属为四聚甘油单棕榈酸酯的加钠峰[C28H56O10+Na]+;质量数m/z585.3978 的离子,可归属为四聚甘油单硬脂酸酯脱水形成的环状物的加钠峰[C30H58O9+Na]+;质量数m/z603.4084的离子,可归属为四聚甘油单硬脂酸酯的加钠峰[C30H60O10+Na]+;质量数m/z631.4033的离子,可归属为五聚甘油单棕榈酸酯脱水形成的环状物的加钠峰[C31H60O11+Na]+;质量数m/z649.4139的离子,可归属为五聚甘油单棕榈酸酯的加钠峰[C31H62O12+Na]+;质量数m/z659.4348的离子,可归属为五聚甘油单硬脂酸酯脱水形成的环状物的加钠峰[C33H64O11+Na]+;质量数m/z677.4453的离子,可归属为五聚甘油单硬脂酸酯的加钠峰[C33H66O12+Na]+;质量数m/z705.4404的离子,可归属为六聚甘油单棕榈酸酯脱水形成的环状物的加钠峰[C34H66O13+Na]+;质量数m/z723.4507的离子,可归属为六聚甘油单棕榈酸酯的加钠峰[C34H68O14+Na]+;质量数m/z733.4716的离子,可归属为六聚甘油单硬脂酸酯脱水形成的环状物的加钠峰[C36H70O13+Na]+;质量数m/z751.4823 的离子,可归属为六聚甘油单硬脂酸酯的加钠峰[C36H72O14+Na]+。
③序号29~34归属为聚甘油二脂肪酸酯峰,归属如下:
质量数m/z841.6387的离子,可归属为四聚甘油棕榈酸硬脂酸酯的加钠峰[C46H90O11+Na]+;质量数m/z851.6591的离子,可归属为四聚甘油二硬脂酸酯脱水形成的环状物的加钠峰[C48H92O10+Na]+;质量数m/z869.6634的离子,可归属为四聚甘油二硬脂酸酯的加钠峰[C48H94O11+Na]+;质量数m/z915.6756的离子,可归属为五聚甘油棕榈酸硬脂酸酯的加钠峰[C49H96O13+Na]+;质量数m/z925.6953的离子,可归属为五聚甘油二硬脂酸酯脱水形成的环状物的加钠峰[C51H98O12+Na]+;质量数m/z943.7008 的离子,可归属为五聚甘油二硬脂酸酯的加钠峰[C51H100O13+Na]+。
2.1.2 负离子模式样品溶解后经FT-ICR-MS 进样测试,负离子模式采集,得到的主要峰的质谱图见图2,质荷比计算值与实测值的相对误差如表2所示。

图2 FT-ICR-MS 测试得到的样品负离子质谱图Fig.2 The negative ion mass spectrum of the sample obtained by FT-ICR-MS

表2 负离子模式下质荷比计算值与实测值的相对误差Table 2 Relative error between calculated mass-to-charge ratio and measured mass-to-charge ratio in negative ion mode
离子峰的归属:
①序号1~2归属为游离脂肪酸峰,归属如下:
质量数为m/z255.2330 的离子,可归属为棕榈酸酯的减氢峰[C16H32O2-H]-;质量数为m/z283.2643的离子,可归属为硬脂酸的减氢峰[C18H36O2-H]-。
②序号3~12归属为聚甘油单脂肪酸酯峰,归属如下:
质量数m/z403.3066 的离子,可归属为二聚甘油单棕榈酸酯的减氢峰[C22H44O6-H]-;质量数m/z431.3379 的离子,可归属为二聚甘油单硬脂酸酯的减氢峰[C24H48O6-H]-;质量数m/z477.3434 的离子,可归属为三聚甘油单棕榈酸酯的减氢峰[C25H50O8-H]-;质量数m/z505.3746的离子,可归属为三聚甘油单硬脂酸酯的减氢峰[C27H54O8-H]-;质量数m/z551.3801的离子,可归属为四聚甘油单棕榈酸酯的减氢峰[C28H56O10-H]-;质量数m/z579.4115 的离子,可归属为四聚甘油单硬脂酸酯的减氢峰[C30H60O10-H]-;质量数m/z625.4166 的离子,可归属为五聚甘油单棕榈酸酯的减氢峰[C31H62O12-H]-;质量数m/z653.4482 的离子,可归属为五聚甘油单硬脂酸酯的减氢峰[C33H66O12-H]-;质量数m/z699.4534的离子,可归属为六聚甘油单棕榈酸酯的减氢峰[C34H68O14-H]-;质量数m/z727.4849的离子,可归属为六聚甘油单硬脂酸酯的减氢峰[C36H72O14-H]-。
③序号13~25归属为聚甘油二脂肪酸酯峰,归属如下:
质量数m/z687.5782的离子,可归属为二聚甘油棕榈酸硬脂酸酯的加OH-峰[C40H78O7+OH]-;质量数m/z715.6093 的离子,可归属为二聚甘油二硬脂酸酯的加OH-峰[C42H82O7+OH]-;质量数m/z761.6141 的离子,可归属为三聚甘油棕榈酸硬脂酸酯的加OH-峰[C43H84O9+OH]-;质量数m/z789.6459 的离子,可归属为三聚甘油二硬脂酸酯的加OH-峰[C45H88O9+OH]-;质量数m/z835.6505 的离子,可归属为四聚甘油棕榈酸硬脂酸酯的加OH-峰[C46H90O11+OH]-;质量数m/z863.6776 的离子,可归属为四聚甘油二硬脂酸酯的加OH-峰[C48H94O11+OH]-;质量数m/z909.6868 的离子,可归属为五聚甘油棕榈酸硬脂酸酯的加OH-峰[C49H96O13+OH]-;质量数m/z937.7119 的离子,可归属为五聚甘油二硬脂酸酯的加OH-峰[C51H100O13+OH]-;质量数m/z743.6044 的离子,可归属为三聚甘油棕榈酸硬脂酸酯的减氢峰[C43H84O9-H]-;质量数m/z771.6355 的离子,可归属为三聚甘油二硬脂酸酯的减氢峰[C45H88O9-H]-;质量数m/z817.6414的离子,可归属为四聚甘油棕榈酸硬脂酸酯的减氢峰[C46H90O11-H]-;质量数m/z845.6719的离子,可归属为四聚甘油二硬脂酸酯的减氢峰[C48H94O11-H]-;质量数m/z919.7055的离子,可归属为五聚甘油二硬脂酸酯的减氢峰[C51H100O13-H]-。
2.2 聚甘油脂肪酸酯的1H NMR分析
取适量样品,以氘代氯仿溶解后,经1H NMR 测定,结果如图3 所示。聚甘油脂肪酸酯的1H NMR谱图具有特征性,按n=A2/(a×5)(a=A1/3,A1 为化学位移δ0.884 处的积分面积,代表脂肪酸甲基的3 个氢;A2 为化学位移δ3.553~4.172 处的积分面积,代表聚甘油的2 个—CH2和1 个—CH,共5 个氢)计算,得到甘油的聚合度n约为4~5,与FT-ICR-MS结果相符。

图3 聚甘油脂肪酸酯的1H NMRFig.3 1H NMR spectrum of polyglycerol fatty acid esters
2.3 聚甘油脂肪酸酯中脂肪酸组成的分析
取适量样品,水解后对脂肪酸部分进行甲酯化,用正庚烷萃取后,经GC-MS 测定,总离子流图如图4 所示。经人工解析并与计算机标准图谱对照,鉴定脂肪酸的结构,采用面积归一化法计算脂肪酸的相对含量(见表3)。

表3 聚甘油脂肪酸酯中的脂肪酸组成及其相对含量Table 3 Composition and relative content of fatty acids in polyglycerol fatty acid esters
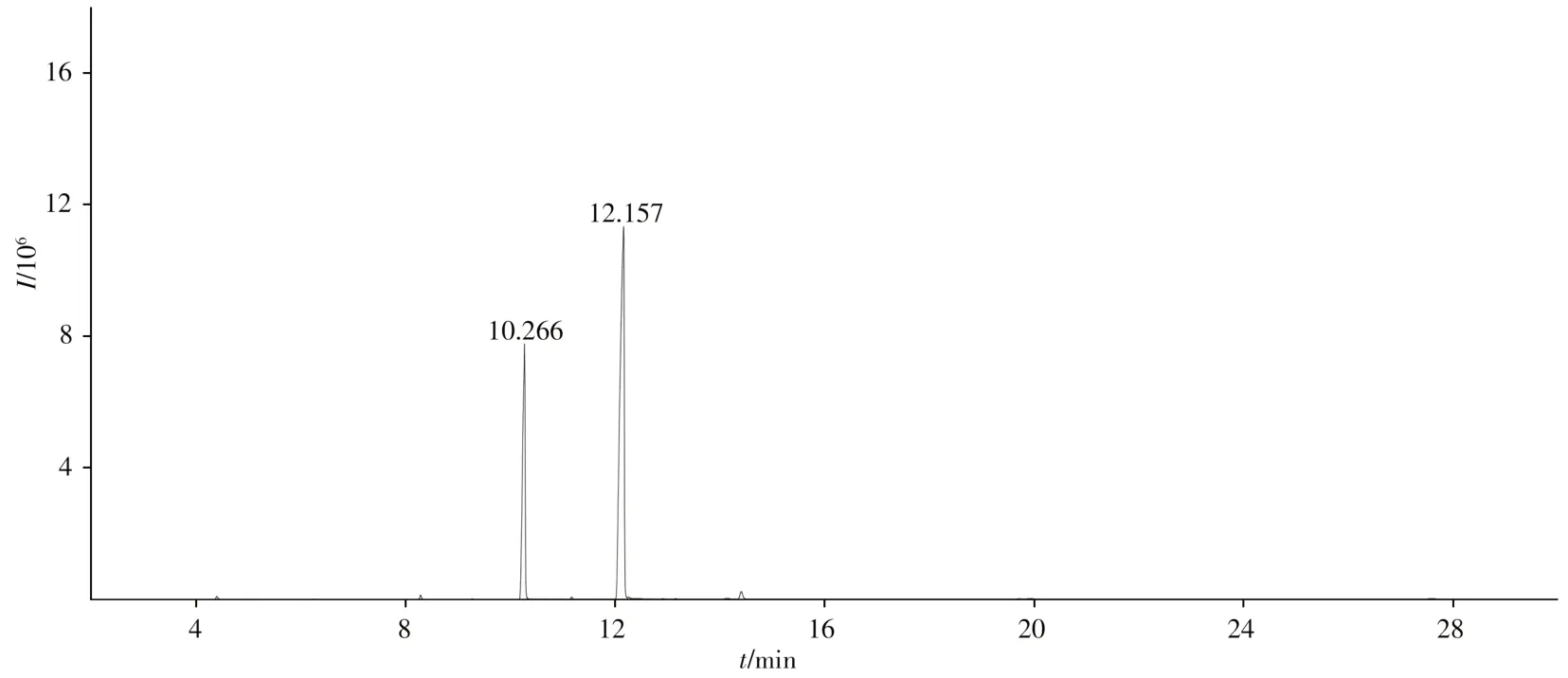
图4 聚甘油脂肪酸酯中脂肪酸组成的GC-MS总离子流图Fig.4 Total ion chromatogram(TIC)of fatty acids composition in polyglycerol fatty acid esters
2.4 鉴定结果
综合上述3 种测试技术对聚甘油脂肪酸酯的结构进行鉴定,结果显示该聚甘油脂肪酸酯中甘油的聚合度为2~6,以三聚、四聚为主,有单酯、双酯,以单酯为主,脂肪酸为棕榈酸和硬脂酸。
3 结论
本文采用FT-ICR-MS、1H NMR及GC-MS技术,对聚甘油脂肪酸酯的结构进行鉴定,确定了甘油的聚合度、脂肪酸的组成以及酯的类型,为聚合物的结构鉴定提供了一种新的思路和方法。
猜你喜欢
杂志排行
分析测试学报的其它文章
- Contents
- 新型类过氧化物纳米酶NC@MIL-100(Fe)的制备及其对生物硫醇的测定
- 典型石化区大气颗粒物中邻苯二甲酸酯的污染特征和暴露风险评估及影响因素分析
- Rapid Quantification of Evodiamine and Rutaecarpine in Evodia Rutaecarpa(Juss.)Benth.Using Supercritical Fluid Chromatography
- Determination of Brilliant Blue FCF and Erythrosine B in Beverage and Candy Samples Using In-situ Effervescence Assisted Microextraction Method Based on Acidic Ionic Liquid
- 超快速液相色谱-三重四极杆-线性离子阱质谱法同时测定桑寄生中多元活性成分
