树脂对普洱茶多糖的纯化与分离
2015-12-10杨新河黄建安刘仲华毛清黎
杨新河,黄建安,刘仲华,*,毛清黎
(1.湖北工程学院生命科学技术学院,湖北 孝感 432000;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
树脂对普洱茶多糖的纯化与分离
杨新河1,2,黄建安2,刘仲华1,2,*,毛清黎1,2
(1.湖北工程学院生命科学技术学院,湖北 孝感 432000;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
研究10 种树脂对普洱茶多糖脱色和蛋白质去除的效果及DEAE-52纤维素离子交换树脂对普洱茶多糖的分离效果。结果表明,D101树脂适合于对普洱茶多糖同时脱色和蛋白质去除,当普洱茶多糖溶液体积为50 mL时,在pH 4、温度50 ℃、料液质量浓度3.8 mg/mL、树脂用量11 mL的条件下,普洱茶 多糖的脱色率为82.33%、蛋白质去除率为70.89%。DEAE-52纤维素离子交换树脂分离经D101树脂处理的普 洱茶多糖能得到6 个不同多糖级分。
树脂;普洱茶;多糖;纯化;分离
普洱茶是以云南省一定区域内的云南大叶种晒青毛茶为原料,经过后发酵加工成的散茶和紧压茶。研究表明,普洱茶具有抗氧化、降血脂、降血糖、抗突变、防癌等功能[1-7],而茶多糖是其药理作用的主要成分之一[8-13]。目前,普洱茶多糖的研究仅停留在粗茶多糖层面,几乎不能确定其结构特征和评价其确切功效,因而开展普洱茶多糖的分离对深入进行普洱茶多糖化学结构和生物活性研究具有极其重要的意义。
目前,茶多糖的分离研究涉及到脱色、蛋白质去除和分级等方面。常用的多糖脱色方法有活性炭法、过氧化氢法和十六烷基三甲基溴化铵-正己醇-异辛烷法;蛋白质去除技术有盐析法、等电点沉淀法、有机溶剂沉淀法和酶解法[14];常见的分级方法有沉淀法、超滤法和柱层析法[15-18]。其中脱色和蛋白质去除的上述方法均存在一些不足,如引起多糖的降解与结构破坏、有机溶剂残留及效率低等,并且脱色和蛋白质去除分为两步进行时工序繁锁、多糖损失严重。而大孔吸附树脂是一类有机高聚物吸附剂,具有良好的大孔网状结构和较大的比表面积,主要应用于环保、医药工业、化学工业、食品工业等多个领域。其中,大孔树脂已用于多种植物多糖脱色[19-23],但大孔树脂同时脱除粗多糖中的色素和蛋白质的研究很少报道。本研 究探讨大孔树脂对普洱茶多糖脱色和蛋白质去除的效果,并采用兼有脱色功能的DEAE-52纤维素离子交换树脂对普洱茶多糖进行分级,旨在为研究普洱茶多糖的结构与生物活性奠定基础,也为研究其他富含多酚类化合物的植物原料经微生物发酵后提取的多糖脱色及蛋白质去除提供参考。
1 材料与方法
1.1 材料与试剂
龙润普洱茶(2007年) 云南龙润茶业集团;AB-8、S-8、NKA-9、D201×4及001×7树脂 南开大学化工厂;聚酰胺 中国医药集团上海化学试剂公司;LSA-7树脂 西安蓝晓科技有限公司;D101树脂 天津农药厂;XAD-7HP和HP-20树脂 日本三菱树脂株式会社;纤维素DEAE-52阴离子交换树脂 英国Whatman公司;D32透析袋 美国Bromma公司。其他试剂均为分析纯。
1.2 仪器与设备
PHS-3TC型酸度计 上海天达仪器有限公司;SKY-200B型恒温培养震荡器 上海苏坤实业有限公司;Rotavapor R-200型旋转蒸发器 瑞士Büchi公司;SHB-Ⅲ型循环水真空泵 郑州长城科工贸有限公司;SHIMADZU UV-2550型紫外-可见光分光光度计 日本岛津公司;SMY-2000ST测色色差计 北京盛名扬科技开发有限责任公司;LD4-2A型低速离心机 北京医用离心机厂;DHL-A电脑恒流泵、SZ-100自动收集器 上海沪西仪器厂;玻璃层析柱 长沙汇虹玻璃仪器有限公司。
1.3 方法
1.3.1 树脂的预处理
工艺流程:阴(阳)离子交换树脂→95%乙醇浸泡12 h→蒸馏水洗至流出液在试管中用水稀释不浑浊→4% NaOH溶液(5% HCl溶液)浸泡4 h→蒸馏水洗至中性→5% HCl溶液(4% NaOH溶液)浸泡4 h→蒸馏水洗至中性。
吸附树脂的预处理与阳离子交换树脂相同。
1.3.2 样品制备
称取一定质量经石油醚脱脂的普洱茶干燥粉碎样,放置浸提瓶中,加入25倍质量的蒸馏水,在90 ℃水浴锅中浸提70 min,过滤,滤液浓缩至一定体积,加入95%乙醇使最终醇体积分数为80%,4 ℃冰箱中静置12 h后以4 000 r/min离心10 min,取沉淀加适当水溶解,真空浓缩至无醇味,备用。
1.3.3 静态吸附操作方法
量取5 mL经预处理的离子交换树脂或吸附树脂于250 mL三角瓶中,分别加入50 mL相同的普洱茶多糖溶液,30℃恒温振摇24 h,振摇频率120 r/min。振摇结束后,用滤纸过滤的方法将树脂和茶多糖溶液分离,滤液定容至100 mL并调至与原多糖溶液相同的pH值,然后测定溶液与蒸馏水的总色差ΔE与蛋白质质量浓度,计算脱色率与蛋白质去除率。
1.3.4 动态吸附操作方法
取3 根玻璃层析柱,分别装入经预处理的D101、HP-20及AB-8树脂70 mL,按照2 BV/h流速各加入与静态吸附相同的茶多糖溶液280 mL,按照0.5 BV/管收集并测定每管溶液与蒸馏水的总色差ΔE*,按照式(1)计算动态吸附率。上样完毕,关闭柱子下端活塞0.5 h,接着用2 BV蒸馏水以2 BV/h的流速洗脱,合并水洗脱液与上样收集的流出液,测定溶液与蒸馏水的总色差ΔE与蛋白质质量浓度,计算脱色率与蛋白质去除率。

1.3.5 D101树脂静态吸附色素的曲线
量取5 mL经预处理的D101树脂于250 mL三角瓶中,加入50 mL普洱茶多糖溶液,恒温振摇,振摇转速120 r/min。每小时取1 mL溶液用于测定与蒸馏水的总色差ΔE,同时补充1 mL原液于三角瓶中,计算树脂吸附不同时间的脱色率。
1.3.6 D101树脂静态吸附单因素试验
1.3.6.1 温度对D101树脂脱色和蛋白质去除的影响量取5 份经预处理的树脂5 mL,各加入相同质量浓度的茶多糖溶液50 mL,温度分别设为20、30、40、50、60 ℃,恒温振摇5 h,转速120 r/min。振摇结束后,依照
1.3.3 节方法操作。
1.3.6.2 树脂用量对D101树脂脱色和蛋白质去除的影响
分别量取经预处理的树脂3、5、7、9、11 mL,加入相同质量浓度的多糖溶液50 mL,50℃振摇5 h,转速120 r/min。振摇结束后,依照1.3.3节方法操作。
1.3.6.3 pH值对D101树脂脱色和蛋白质去除的影响
量取5 份经预处理的树脂7 mL,分别加入预先调节好pH值为4.0、4.6、5.2、5.8、6.4的相同质量浓度的多糖溶液50 mL,50 ℃振摇5 h,转速120 r/min。振摇结束后,依照1.3.3节方法操作。
1.3.6.4 料液质量浓度对D101树脂脱色和蛋白质去除的影响
量取5 份经预处理的树脂7 mL,分别加入质量浓度为0.24、0.48、0.95、1.90、3.80 mg/mL多糖及pH 5.2的溶液50 mL,50℃振摇5 h,转速120 r/min。振摇结束后,依照1.3.3节方法操作。
1.3.7 D101树脂静态吸附正交试验
根据单因素试验结果,确定温度、树脂用量、pH值及料液质量浓度四因素的水平见表1,进行正交试验全面考察4 个因素对D101树脂脱除普洱茶多糖溶液中色素和蛋白质的影响,优化参数。

表 1 D101树脂静态吸附因素水平表Table 1 Variables and levels used in orthogonal array design for static adsorption of D101 resin
1.3.8 分析及计算方法
1.3.8.1 蛋白质测定及蛋白质去除率计算
蛋白质测定采用考马斯亮蓝G-250法[24],以牛血清白蛋白为标准品,线性回归方程为ρ=231.35A—11.396,相关系数r=0.996 4,其中,ρ为以牛血清白蛋白计的蛋白质质量浓度/(μg/mL);A为吸光度。

式中:ρ前、ρ后分别为脱色前和脱色后蛋白质质量浓度/(μg/mL)。
1.3.8.2 色差值测定及脱色率计算[25]
调整待测茶多糖溶液pH值,用蒸馏水稀释4倍,测定与蒸馏水的总色差ΔE。
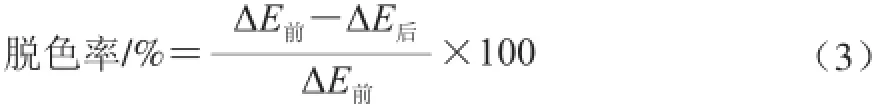
式中:ΔE前、ΔE后分别为脱色前、后溶液与蒸馏水的总色差值。
1.3.9 DEAE-52柱层析分离普洱茶茶多糖
准确称取经D101树脂脱色和脱蛋白质的多糖样品2g,溶于20mL蒸馏水中,上DEAE-52柱(有效柱体积为120 mL),依次用1BV蒸馏水及0.1、0.2、0.3、0.5、1.0 mol/L NaCl溶液洗脱,控制流速为0.1 BV/h,按照5 mL/管收集并测定每管在280 nm波长处的吸光度,然后将样品溶液按1∶5稀释后用硫酸-苯酚法测定多糖的含量。以苯酚-硫酸法检测280 nm波长处多糖的吸光度为纵坐标,以试管数目为横坐标作DEAE-52色谱柱洗脱曲线图。分别合并各主峰溶液,减压浓缩至一定体积后用流水透析48 h,然后减压浓缩透析袋内的多糖溶液,冷冻干燥得到多糖级分。
2 结果与分析
2.1 树脂的初步筛选
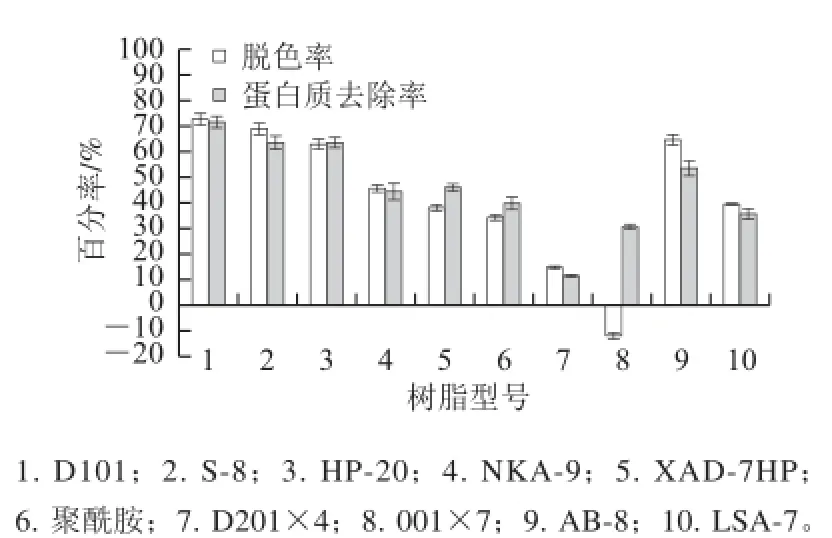
图 1 树脂静态吸附对茶多糖脱色和蛋白质去除的效果Fig.1 Effect of static adsorption by different types of resins on decolorization and deproteinization
由图1可知,10 种树脂对普洱茶多糖中色素和蛋白质的吸附各不相同,其中D101、S-8、HP-20及AB-8树脂对普洱茶多糖中色素和蛋白质的吸附能力较强,均能去除普洱茶多糖中60%以上的色素和50%以上的蛋白质,而其余6种树脂的色素脱除率和蛋白质去除率均低于50%。这10种树脂对普洱茶多糖中色素和蛋白质去除能力的差异受到树脂的极性、比表面积、孔体积和平均孔径、以及普洱茶多糖、蛋白质和色素的相对分子质量与极性等多重因素的综合影响。图1还表明,001×7阳离子交换树脂不但没有脱色效果,反而使普洱茶多糖的颜色加深,可能的原因是001×7阳离子交换树脂与普洱茶多糖溶液中的物质交换基团后引起pH值的变化,促使更多的多酚氧化聚合成颜色较深的物质。
吸附后的树脂用80%酒精解吸4 h,经测定树脂解吸前、后吸附固形物质量后计算发现S-8吸附固形物的解吸率远低于D101、HP-20和AB-8树脂的解吸率,仅为 11.50%。由于S-8为极性树脂,比表面积仅为100~200 m2/g, D101和HP-20树脂均为非极性树脂,比表面积分别为500~600 m2/g和600 m2/g,AB-8为弱极性树脂,比表面积为480~520 m2/g,因而初步推测普洱茶多糖中色素和蛋白质的极性很强,能牢固地吸附在S-8树脂上而不易被洗脱释放出来,进而表明S-8树脂再生十分困难,不宜用于普洱茶多糖的脱色和蛋白质去除。因此,选择D101、AB-8及HP-20作进一步筛选。
2.2 3 种树脂对茶多糖溶液中色素的动态吸附率

图 2 3 种树脂动态吸附茶多糖溶液中色素的效果Fig.2 Dynamic adsorption of pigments present in tea polysaccharide by three types of resins
由图2可知,D101、AB-8及HP-20树脂动态吸附普洱茶多糖溶液中的色素均随上样液体积的增加而呈现吸附能力下降的趋势。其中第2管与第1管相比,吸附色素的能力下降十分明显,D101、AB-8和HP-20分别下降了23.98%、28.38%和 24.24%,并且第2管的流出液中就含有较高的色素;从第3管开始,3种树脂对色素的吸附率都低于70%;第6管时树脂对色素的吸附率均不到60%。由此表明,树脂动态吸附普洱茶多糖溶液中色素的效果欠佳。
由图3与图1可知,D101、AB-8和HP-20处理4 倍树脂体积的普洱茶多糖溶液时脱色率和蛋白质去除率低且效果均不及静态吸附法处理10 倍树脂体积的普洱茶多糖溶液。依据实验数据推理,3 种树脂采用动态吸附法分别处理10 倍树脂体积料液,则对多糖溶液脱色和蛋白质去除效果将远不及静态吸附法。综合考虑,选择D101树脂采用静态吸附法来脱除普洱茶多糖溶液中的色素与蛋白质。

图 3 3 种树脂对茶多糖溶液动态脱色和蛋白质去除的效果Fig.3 Effects of three types of resins on dynamic decolorization and deproteinization of tea polysaccharides
2.3 D101树脂静态吸附色素的曲线
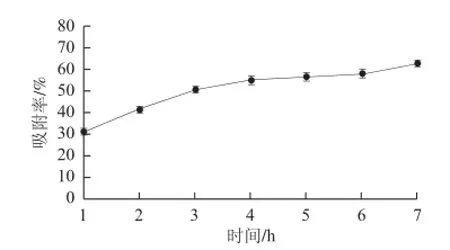
图 4 D101树脂静态吸附色素的曲线Fig.4 Static adsorption curve of D101 resin for pigments
由图4可知,D101树脂对普洱茶多糖中色素的脱除率随时间延长而增加。当脱色时间在1~3 h内,脱色效果随时间的延长而明显增加,但从4 h延长至7 h,脱色率略有增加,意味着树脂吸附色素在4~7 h接近饱和。这可能与吸附过程中色素的浓度降低和树脂的有效吸附面积减少有关。考虑到脱色的时间效率及吸附时间过长会使多糖的保留率偏低,因此,静态吸附色素的时间以5 h为宜。
2.4 D101树脂静态吸附单因素试验结果
2.4.1 温度对D101树脂脱色与蛋白质去除的影响
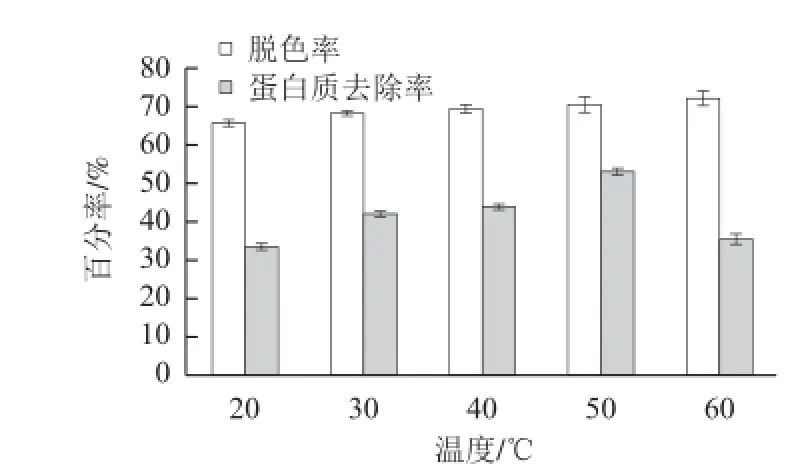
图 5 温度对D101树脂脱色和蛋白质去除的影响Fig.5 Effect of temperature on decolorization and deproteinization by D101 resin
据图5,温度对普洱茶多糖溶液的脱色和蛋白质去除有一定程度的影响。温度在20~50 ℃范围内,D101树脂对茶多糖溶液的脱色率随温度的升高而增加,蛋白质去除率增加明显;温度为50 ℃与60 ℃相比,后者脱色率略高于前者,但蛋白质去除率明显下降。可能是当温度低于50 ℃时随温度升高树脂功能基团活性增强,溶液的黏度下降,色素和蛋白质分子的扩散速率加快,从而树脂吸附3 种分子的速率加快;当温度超过50 ℃时,蛋白质同色素的结合力减弱,色素竞争性被树脂吸附的能力强于蛋白质。综合考虑脱色率、蛋白质去除率和操作温度的控制,D101树脂宜在30~50 ℃范围使用。
2.4.2 树脂用量对D101树脂脱色与蛋白质去除的影响
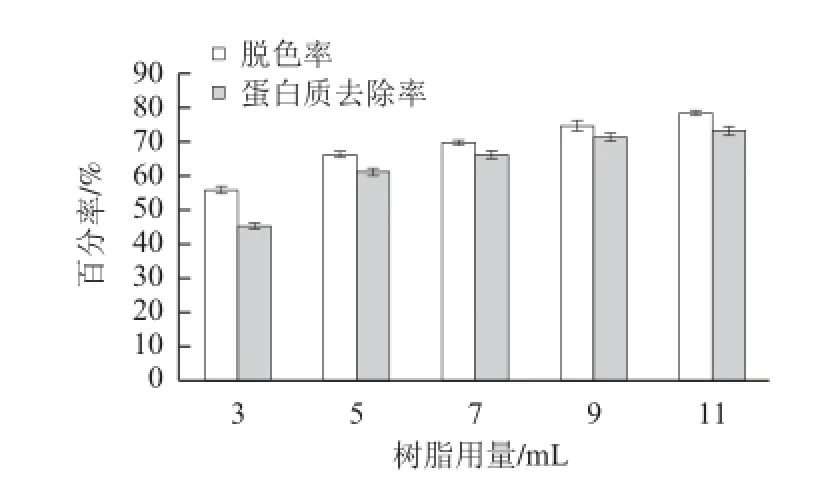
图 6 树脂用量对D101树脂脱色和蛋白质去除的影响Fig.6 Effects of resin volume on decolorization and deproteinization by D101 resin
据图6,树脂用量在3~11 mL范围内时,D101树脂对茶多糖溶液的脱色率及蛋白质去除率随树脂用量的增加而提高,因为树脂用量增加相当于单位体积溶液中用于吸附物质的树脂总表面积增大,树脂功能基团增多,提高了对色素和蛋白质的吸附量。当树脂用量超过11 mL时,随树脂用量的继续增加,脱色率和蛋白质去除率进一步增加的力度小,但会使多糖的保留率降低。因此,树脂用量以不超过11 mL为宜。
2.4.3 pH值对D101树脂脱色与蛋白质去除的影响

图 7 pH值对D101树脂脱色和蛋白质去除的影响Fig.7 Effect of pH on decolorization and deproteinization by D101 resin
据图7,pH值在4.0~6.4范围内时,D101树脂对普洱茶多糖溶液的脱色率与蛋白质去除率随pH值的降低而明显升高,因为pH值的降低可能有更多的蛋白质处于等电点而沉淀析出,同时会使离子形式的色素更多地转变为以分子形式存在而有利于树脂的吸附。从脱色率及蛋白质去除率的综合效果来看,pH值适宜在4.0~5.2范围内。
2.4.4 料液质量浓度对D101树脂脱色与蛋白质去除的影响

图 8 料液质量浓度对D101树脂脱色和蛋白质去除的影响Fig.8 Effect of sample concentration on decolorization and deproteinization by D101 resin
据图8,多糖质量浓度在0.24~1.90 mg/mL范围内,D101树脂对普洱茶多糖溶液的脱色率和蛋白质去除率随着质量浓度的增加而提高。而料液质量浓度1.90 mg/mL与3.80 mg/mL 相比较,前者脱色率略有降低,但蛋白质去除率增加了6.55%。从脱色率、蛋白质去除率、后续浓缩工序的能耗及效率等方面综合评价,料液质量浓度宜控制在0.95~3.80 mg/mL范围内。
2.5 正交试验设计优化脱色与蛋白质去除的工艺条件
在单因素试验基础上,采用四因素三水平正交试验法优化普洱茶多糖提取液的最佳脱色和蛋白质去除条件,试验结果见表2。
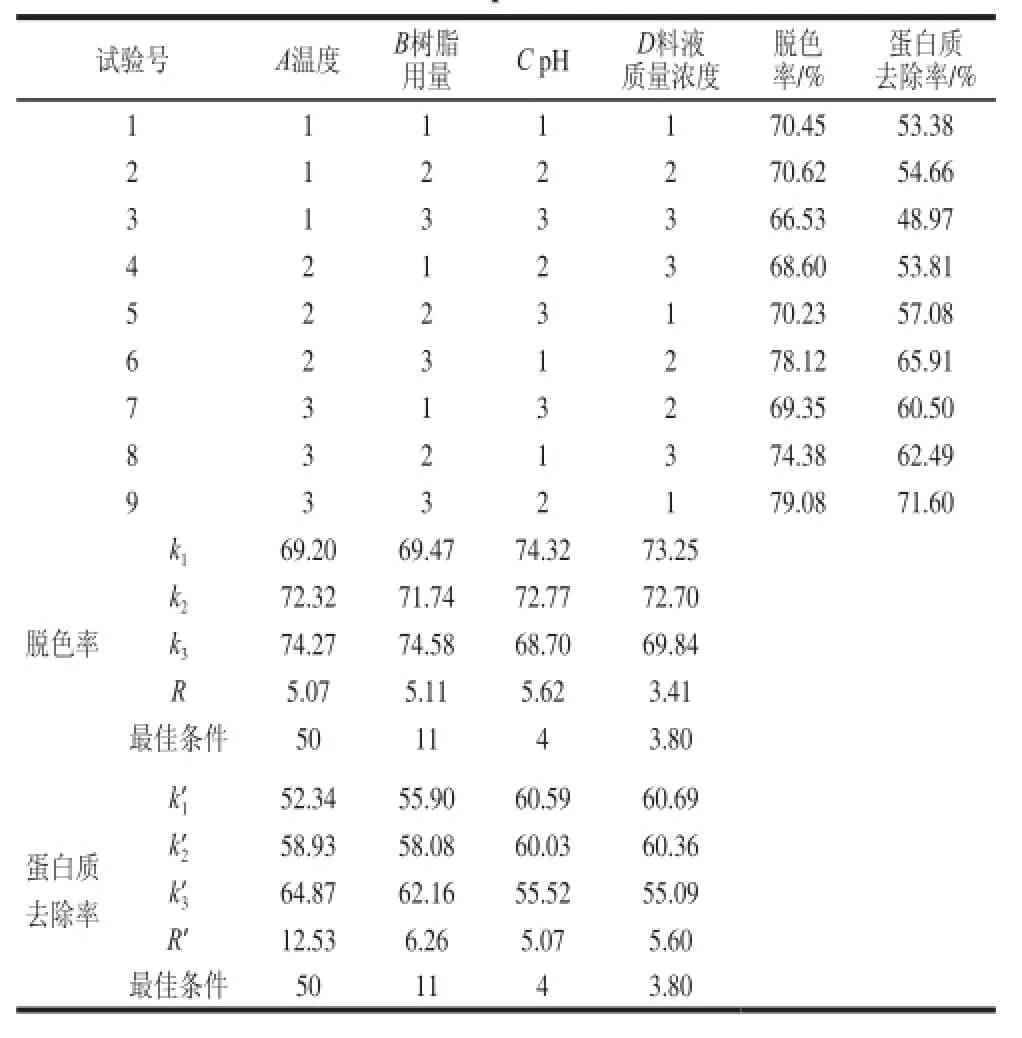
表 2 普洱茶多糖溶液脱色与脱蛋白质的正交试验设计与结果Table 2 Results of orthogonal array experiments for the optimization of resin adsorption conditions
由表2极差分析可看出,pH值对于脱色率的影响较大,树脂用量次之,料液质量浓度对脱色率影响最小。温度对于蛋白质去除率的影响较大,树脂用量次之,pH值对蛋白质去除率影响最小。从数据分析确定的脱色和蛋白质去除条件相同,即温度50 ℃、树脂用量11 mL、pH 4.0、料液质量浓度3.8 mg/mL。
在此条件下进行进一步实验的结果表明,普洱茶多糖溶液的脱色率可达到82.33%,蛋白质去除率为70.89%,优于正交组合表中各处理的结果,证明优化的条件是合理的。
2.6 纤维素DEAE-52阴离子交换树脂分离普洱茶茶多糖

图 9 普洱茶茶多糖在DEAE-52色谱柱上的洗脱曲线Fig.9 Elution curve of Pu-Erh tea polysaccharide on DEAE-52 column
采用DEAE-52柱层析对经D101树脂脱色和脱蛋白质的茶多糖进行分离,依次经H2O和0.1、0.2、0.3、0.5、1.0 mol/L NaCl溶液梯度洗脱。从图9可知,检测多糖时,除了0.1 mol/L NaCl溶液洗脱收集的溶液呈现一个大峰和一个小峰有交叉之外(二峰视为单峰收集),其他浓度的洗脱剂均可获得一单峰。第1个多糖峰对应的溶液在280 nm波长处有明显的吸收峰,意味着该溶液可能含有糖与蛋白质的结合物,第2、3个多糖峰对应的溶液在280 nm波长处有一个很小的吸收峰,余下各多糖峰对应的溶液在280 nm波长处未见吸收峰。合并各主峰对应的收集液,减压浓缩,透析48 h后袋内溶液减压浓缩,冷冻干燥得到多糖级分,按照收集的先后顺序依次命名为TPSⅠ、TPSⅡ、TPSⅢ、TPSⅣ、TPSⅤ和TPSⅥ。
3 讨 论
普洱茶属于后发酵茶,多酚氧化程度高,产生的氧化产物茶黄素、茶红素、茶褐素为普洱茶色素。普洱茶中茶色素具有含量高,极性很大且存在部分与多糖及蛋白质结合的特点,完全不同于绝大多数植物多糖提取液中的色素,色素的脱除十分困难。通过预实验发现活性炭对普洱茶多糖溶液几乎没有脱色效果;过氧化氢的脱色率约为45.2%,但考虑到过氧化氢有可能破坏多糖结构及引起普洱茶中简单多酚氧化聚合成有颜色的物质而未作深入研究;传统的Sevag法5 次蛋白质去除率仅为36.83%;溶液中终质量分数1%胰蛋白酶与Sevag法5 次相结合时蛋白质去除率为49%。因此,常用的多糖脱色和蛋白质去除方法均不适合于普洱茶多糖溶液的直接脱色与蛋白质去除。
本研究采用树脂进行普洱茶多糖同步脱色和蛋白质去除,与常规的多糖脱蛋白、脱色方法相比,具有工序少、操作简单、溶剂安全、处理量大、周期短等优点。夏玮等[23]用高效凝胶过滤色谱测定了树脂对多糖脱色前后的色谱图,结果色谱图形状大致相同,只是不同部分峰高有一定程度的降低,树脂对不同分子质量范围的多糖都有一定吸附作用,不会专一性吸附凝胶过滤色谱峰中单峰对应的多糖,也不会破坏多糖的结构。因此,采用树脂进行普洱茶多糖同步脱色和蛋白质去除不仅为后续研究普洱茶多糖的分离纯化、结构与生物活性奠定了坚实的基础,也为研究其他植物原料经微生物发酵后提取的多糖脱色和蛋白质去除提供了重要的技术参考。
此外,用纤维素DEAE-52树脂分离经D101树脂脱色和蛋白质去除的普洱茶多糖,得到6 个多糖级分,经透析、浓缩和冷冻干燥后根据颜色深浅和多糖含量高低,可优先选择TPSⅠ和TPSⅡ用于进一步分离纯化、结构表征与功效研究。本研究还表明D101树脂对普洱茶多糖溶液中色素的吸附率高达82.33%,故可以对吸附的色素进行洗脱收集及进一步的分离纯化、结构与药理活性研究,也许将有助于深化茶叶科学的相关理论和深度开发普洱茶色素。
4 结 论
本实验筛选出D101树脂适合于对普洱茶多糖同时脱色和蛋白质去除,并优化了其对普洱茶多糖溶液脱色和蛋白质去除的条件:当普洱茶多糖溶液体积为50mL时,温度50 ℃、树脂用量11 mL、pH 4.0、料液质量浓度3.8 mg/mL。在此条件下普洱茶多糖溶液的脱色率高达82.33%,蛋白质去除率为70.89%。用纤维素DEAE-52阴离子树脂分离经D101树脂脱色和蛋白质去除的普洱茶多糖能得到6 个多糖级分。
[1] QIAN Z M, GUAN J, YANG F Q, et al. Identification and quantifi cation of free radical scavengers in Pu-erh tea by HPLC-DADMS coupled online with 2,2′-azinobis(3-ethylbenzthiazolinesulfonic acid) diammonium salt assay[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11187-11191.
[2] LU C H, HWANG L S. Polyphenol contents of Pu-Erh teas and their abilities to inhibit cholesterol biosynthesis in HepG2 cell line[J]. Food Chemistry, 2008, 111(1): 67-71.
[3] WU S C, YEN G C, WANG B S, et al. Antimutagenic and antimicrobial activities of Pu-Erh tea[J]. LWT-Food Science and Technology, 2007, 40(3): 506-502.
[4] 刘通讯, 谭梦珠. 不同储存时间对普洱茶有机溶剂萃取物清除自由基活性的影响[J]. 现代食品科技, 2013, 29(10): 2372-2377.
[5] 揭国良, 何普明, 张龙泽, 等. 普洱茶提取物对高糖作用下人胚肺成纤维细胞的保护作用[J]. 食品科学, 2008, 29(4): 366-369.
[6] 郭刚军, 彭春秀, 何享, 等. 云南普洱茶不同溶剂提取物抗氧化活性研究[J]. 热带作物学报, 2013, 34(1): 151-156.
[7] 周斌星, 孔令波, 李发志. 普洱茶(熟茶)不同发酵阶段在制品降血脂效果的比较研究[J]. 中国农学通报, 2010, 26(18): 231-236.
[8] 方祥, 李斌, 陈栋, 等. 普洱茶功效成分及其品质形成机理研究进展[J].食品工业科技, 2008, 29(6): 313-316.
[9] 蒋成砚, 谢昆, 薛春丽. 普洱茶多糖增强免疫功能研究[J]. 江苏农业科学, 2012, 40(1): 257-258.
[10] 周斌星, 孔令波, 陈军贤. 普洱茶多糖的提取及降血糖的研究[J]. 中国农学通报, 2009, 25(15): 55-59.
[11] 陈朝银, 叶燕, 熊向峰, 等. 普洱茶多糖的提取工艺及抗氧化活性研究[J]. 食品研究与开发, 2008, 29(4): 13-15.
[12] 龚加顺, 陈文品, 周红杰, 等. 云南普洱茶特征成分的功能与毒理学评价[J]. 茶叶科学, 2007, 27(3): 201-210.
[13] 吴文华, 吴文俊. 普洱茶多糖降血脂功能的量效关系[J]. 福建茶叶, 2006(2): 42-43.
[14] 李凤玲, 何金环. 植物多糖的结构与分离纯化技术研究进展[J]. 中国农学通报, 2008, 24(10): 276-279.
[15] 陈萍, 朱丽云, 金晖, 等. 茶多糖的分离制备及其对ALX模型小鼠的降糖作用研究[J]. 食品科技, 2013, 38(5): 194-196.
[16] 寇小红, 江和源, 崔宏春, 等. 膜过滤绿茶多糖的系统分级纯化及免疫活性分析[J]. 茶叶科学, 2008, 28(3): 172-180.
[17] 谢亮亮, 蔡为荣, 张虹, 等. 茶多糖的分离纯化及其抗凝血活性[J].食品与发酵工业, 2012, 38(9): 191-195.
[18] 江和源, 陈小强, 寇小红, 等. 茶多糖的分级纯化及组成分析[J]. 茶叶科学, 2007, 27(3): 248-252.
[19] 肖丽霞, 于洪涛, 胡晓松. 香菇多糖的树脂脱色工艺研究[J]. 食品与机械, 2011, 27(6): 241-244.
[20] 蓝闽波, 郭晶, 赵红莉, 等. 大孔吸附树脂对厚朴多糖的脱色工艺研究[J]. 时珍国医国药, 2012, 23(5): 1219-1220.
[21] 杨强, 李新华, 王琳, 等. 银杏果多糖的物化性质及抗氧化活性研究[J].现代食品科技, 2013, 29(10): 2395-2400.
[22] 廖春燕, 黄敏, 黄瑶, 等. 车前草多糖的脱色工艺研究[J]. 现代食品科技, 2012, 28(8): 1028-1030.
[23] 夏玮, 吕庆, 张文清, 等. 大孔吸附树脂脱色桑叶多糖的研究[J]. 食品与发酵工业, 2007, 33(2): 141-144.
[24] 刘小华, 张美霞, 于春梅, 等. 考马斯亮蓝法测定壳聚糖中蛋白的含量[J]. 中国交通医学杂志, 2006, 20(2): 159-160.
[25] 侯双菊. 黄精多糖的提取工艺及提取液树脂法脱色的研究[D]. 合肥: 合肥工业大学, 2006.
Purifi cation and Separation of Pu-Erh Tea Polysaccharide by Resin
YANG Xinhe1,2, HUANG Jian’an2, LIU Zhonghua1,2,*, MAO Qingli1,2
(1. School of Life Science and Technology, Hubei Engineering University, Xiaogan 432000, China; 2. National Research Center of Engineering & Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China)
Among ten types of macroporous resins, D101 resin was selected as the best for the decolorization and deproteinization of Pu-Erh tea polysaccharides. When 50 mL of the sample at a concentration of 3.8 mg/mL, pH 4 was adsorbed by 11 mL of D101 resin 50 ℃, the decolorization rate was 82.33% and the removal rate of protein was 70.89%. Six polysaccharide fractions were obtained after subsequent DEAE-52 cellulose column chromatography.
resin; Pu-Erh tea; polysaccharide; purifi cation; separation
S571.1
A
1002-6630(2015)02-0019-06
10.7506/spkx1002-6630-201502004
2014-06-20
国家自然科学基金面上项目(31370692;31370691);湖北省自然科学基金面上项目(2014CFB573)
杨新河(1974—),男,副教授,博士,主要从事茶及功能食品研究。E-mail:hbxhyang@163.com
*通信作者:刘仲华(1965—),男,教授,博士,主要从事茶及功能食品研究。E-mail:lark-liu@163.com
