光学纯(R)-3-奎宁醇制备技术研究进展
2018-07-06,,,,,
,,,,,
(浙江工业大学 药学院,浙江 杭州 310014)
(R)-3-奎宁醇,化学名(3R)-1-氮杂双环[2.2.2]辛-3-醇,是合成新型抗胆碱能药的关键手性中间体,如治疗帕金森病的他沙立定(talsaclidine)[1]、治疗慢性阻塞性肺疾病的阿地溴铵(aclidinium bromide)[2-3]和瑞伐托酯(revatropate)[4]以及治疗尿失禁的索利那辛(solifenacin)[5-6]等.该类药物的应用十分广泛,既可应用于日常的疾病治疗,也可用于军事上对抗化学武器.因此,(R)-3-奎宁醇的合成研究备受关注,其制备方法主要有化学拆分法、化学不对称合成、动力学拆分以及生物不对称还原法等,其中生物不对称还原法由于其立体选择性高、反应条件温和、环境友好等优势而备受关注[7-8].
1 化学合成法
1.1 化学拆分法
化学拆分法是获得手性化合物的经典方法之一.李书彬等[9]在甲醇溶液中利用硼氢化钾还原法将3-奎宁酮盐酸盐还原为外消旋3-奎宁醇,再以V(丙醇)∶V(丙酮)=3∶1的混合溶剂为反应介质,以D-(+)-二苯甲酰酒石酸为拆分剂对外消旋体进行拆分,所得固体经重结晶后得到(R)-3-奎宁醇,e.e.值98%,产率为20.4%.类似的,Ji等[10]利用(L)-酒石酸在乙醇溶液中拆分17.9 g的(+/-)-1-氮杂双环[2.2.2]辛基-3-苯甲酸酯,拆分产物经15%氢氧化钠水解得到1.35 g(R)-3-奎宁醇.利用化学拆分法制备单一构型(R)-3-奎宁醇产物需使用手性化学拆分剂,步骤较多,产率偏低.
1.2 化学不对称催化
Tsutsumi等[11]合成了可用于催化3-奎宁酮不对称加氢制备(R)-3-奎宁醇的化学催化剂XylSkewphos/PICA-Ruthenium,反应过程中底物和催化剂摩尔比为100 000,4.3 kg底物反应4 h后,(R)-3-奎宁醇的e.e.值为88%.为提高产物e.e.值,该课题组[12]在异丙醇中采用RuCl2[(S)-binap][(R)-iphan]和t-C4H9OK复合催化剂体系,将3-奎宁酮不对称还原为(R)-3-奎宁醇,e.e.值大于97%,合成路线为
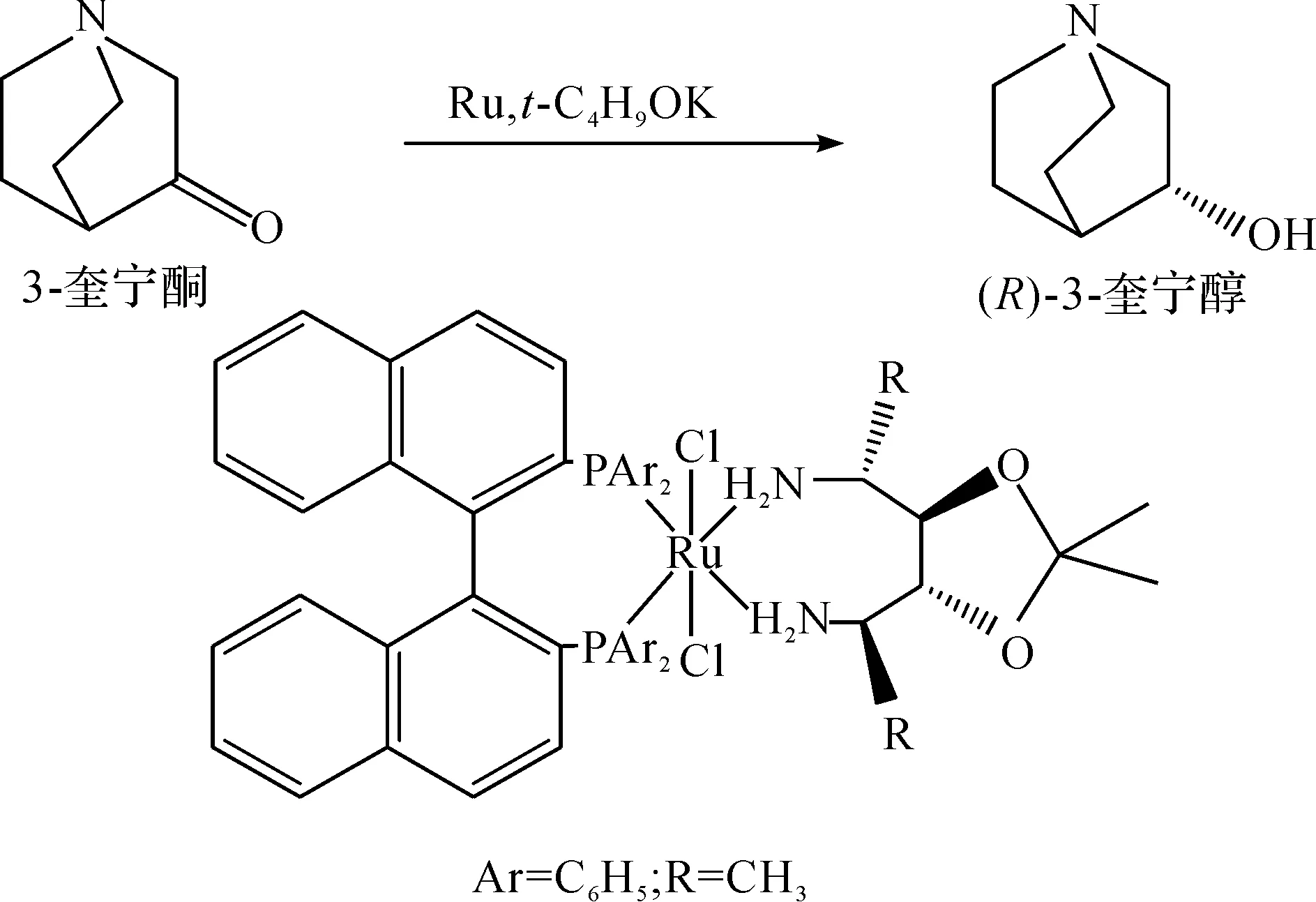
徐亮等[13]以(S,S)xylskewphosRuBr2QUIMA为手性催化剂,在碱性条件下经不对称还原氢化制得(R)-3-奎宁醇,产物e.e.值大于95%,转化率大于99.5%.化学不对称催化制备(R)-3-奎宁醇的反应过程中使用少量的金属手性催化剂即可获得较高收率,但金属手性催化剂价格较高,制备过程复杂,增加了反应成本,且部分催化剂不易回收重复利用,对环境造成一定的污染.
2 生物合成法
2.1 酶法拆分
Nomoto等[14]利用酶法拆分制备(R)-3-奎宁醇.首先将丁酸酐与外消旋奎宁醇进行反应制得奎宁酯,利用质量浓度为10 g/L的蜂蜜曲霉蛋白酶水解2 mol质量浓度为571 g/L的奎宁酯,反应24 h后,萃取得到R型奎宁丁酸酯,然后使用甲醇和碳酸钠将该酯分解,获得e.e.值为96%的(R)-3-奎宁醇,收率为42%,合成路线为
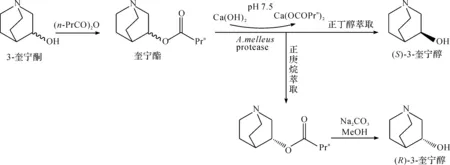
Muchmore等[15]将低脂肪酸酐与外消旋奎宁酯反应制得一系列奎宁酯,然后利用枯草杆菌蛋白酶催化酯水解,由于该蛋白酶对S构型酯的选择性更强,故优先水解S构型酯获得(S)-3-奎宁醇,分离R构型酯并进一步水解后得到所需的(R)-3-奎宁醇产物.Primozic等[16]合成了一系列具有保护基团的奎宁酯,以马血清丁酰胆碱酯酶为生物催化剂,37 ℃下进行酯水解反应,当酯被水解至50%左右时终止反应,加入适量甲酸铵和10% Pd-C进行相转移催化加氢反应制得光学纯(R)-3-奎宁醇,产率低于50%.
利用酶法拆分制备(R)-3-奎宁醇多以外消旋奎宁醇为原料,与适当的酸酐反应制得相应的奎宁酯,再以具有对映选择性的水解酶为生物催化剂,对奎宁酯进行酶选择性拆分制得(R)-3-奎宁醇.此方法可获得高光学纯度的(R)-3-奎宁醇,但拆分产率不超过50%,并且需要先合成得到奎宁酯,反应结束后还需除去剩余酯,步骤多且繁琐,因此不适合大规模生产.
2.2 生物不对称还原法
生物不对称还原法包括酶催化和全细胞催化,具有反应条件温和、立体选择性高、环境友好等优点,可用于制备多种手性化合物[17].酶催化的反应专一性高、副产物少,但酶的分离纯化过程复杂,反应过程中酶的稳定性不高、易失活,且需要添加昂贵的辅酶.全细胞催化是利用微生物细胞催化潜手性酮不对称还原得到所需构型的手性醇.由于微生物细胞内具有完善的代谢体系和酶系,不需额外添加辅因子,也可省去胞内酶的分离纯化过程,因而逐渐受到关注[18-20].
邱健等[21]以3-奎宁酮盐酸盐为唯一碳源,从100多份土样中筛选得到可高选择性不对称还原3-奎宁酮盐酸盐制备(R)-3-奎宁醇的微生物菌株,命名为RhodotorulamucilaginosaX 15,经工艺优化后,质量浓度为300 g/L的湿菌体催化5 mmol底物转化为(R)-3-奎宁醇的产率为90%,e.e.值为88%,当底物浓度大于5 mmol/L时,出现明显的底物抑制现象.Kolet等[22]利用梨形毛霉催化相同底物的不对称还原,底物质量浓度为2.0 g/L,转化12 d后(R)-3-奎宁醇产率为73%,e.e.值为96%.反应结束后以强阳离子交换树脂-Amberlite IR-120对产物进行分离纯化,避免了萃取过程中二氯甲烷等有机试剂的使用,是一种绿色环保的分离方法.Wang等[23]从土壤中筛选得到Nocardiasp. WY1202和RhodococcuserythropolisWY1406菌株,可将底物3-奎宁酮盐酸盐分别转化为(R)-3-奎宁醇和(S)-3-奎宁醇,e.e.值大于99%,合成途径为
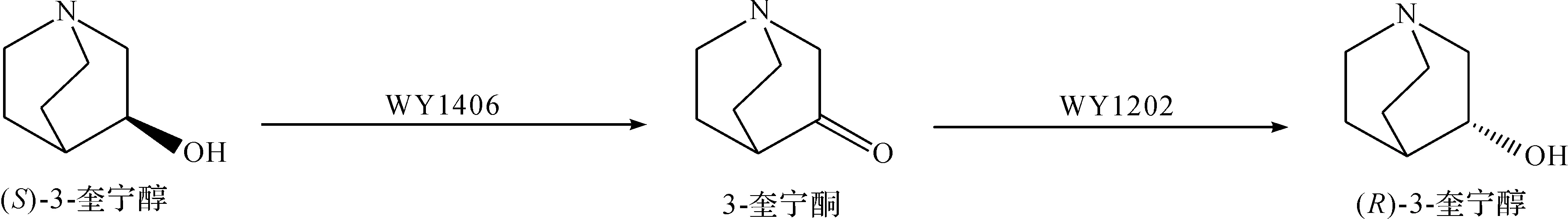
优化后Nocardiasp. WY1202在pH 7.0的磷酸缓冲液中将99 mmol/L的3-奎宁酮盐酸盐底物还原为(R)-3-奎宁醇,转化率达95.3%.利用筛选的野生菌催化3-奎宁酮盐酸盐不对称还原制备(R)-3-奎宁醇只需一步反应即可获得产物,反应条件温和且产物易分离获取,但催化转化的底物量偏低.
Uzura等[24]从RhodotorularubraJCM3782中分离出一种NADPH依赖型羰基还原酶RrQR,可将3-奎宁酮不对称还原为(R)-3-奎宁醇,并在大肠杆菌中共表达RrQR和葡萄糖脱氢酶,反应21 h后,该重组工程菌可将618 mmol(100 g/L)3-奎宁酮盐酸盐还原为(R)-3-奎宁醇,产率达98.6%,e.e.值>99.9%.Isotani等[25-26]从MicrobacteriumluteolumJCM 9174中分离出2 种可将3-奎宁酮不对称还原为(R)-3-奎宁醇的羰基还原酶QNR和bacC,以大肠杆菌为表达载体共表达羰基还原酶和来源于雷弗松氏菌的醇脱氢酶.转化体系中加入异丙醇作为辅助底物用于辅酶再生,并采用连续补料方式以解除高浓度底物和异丙醇对生物催化剂活性的抑制作用.为进一步提高生物催化剂的重复使用批次,采用聚乙烯亚胺和戊二醛对重组大肠杆菌细胞进行固定化.研究发现:采用E.coil/pET28-QNR和E.coil/pKELA质量比为1∶1的固定化细胞作为生物催化剂,在含10%异丙醇、pH 7.0的磷酸钾缓冲溶液中加入适量固定化细胞,反应48 h可将939 mmol/L(150 g/L)的3-奎宁酮完全转化为(R)-3-奎宁醇产物,制备路线为
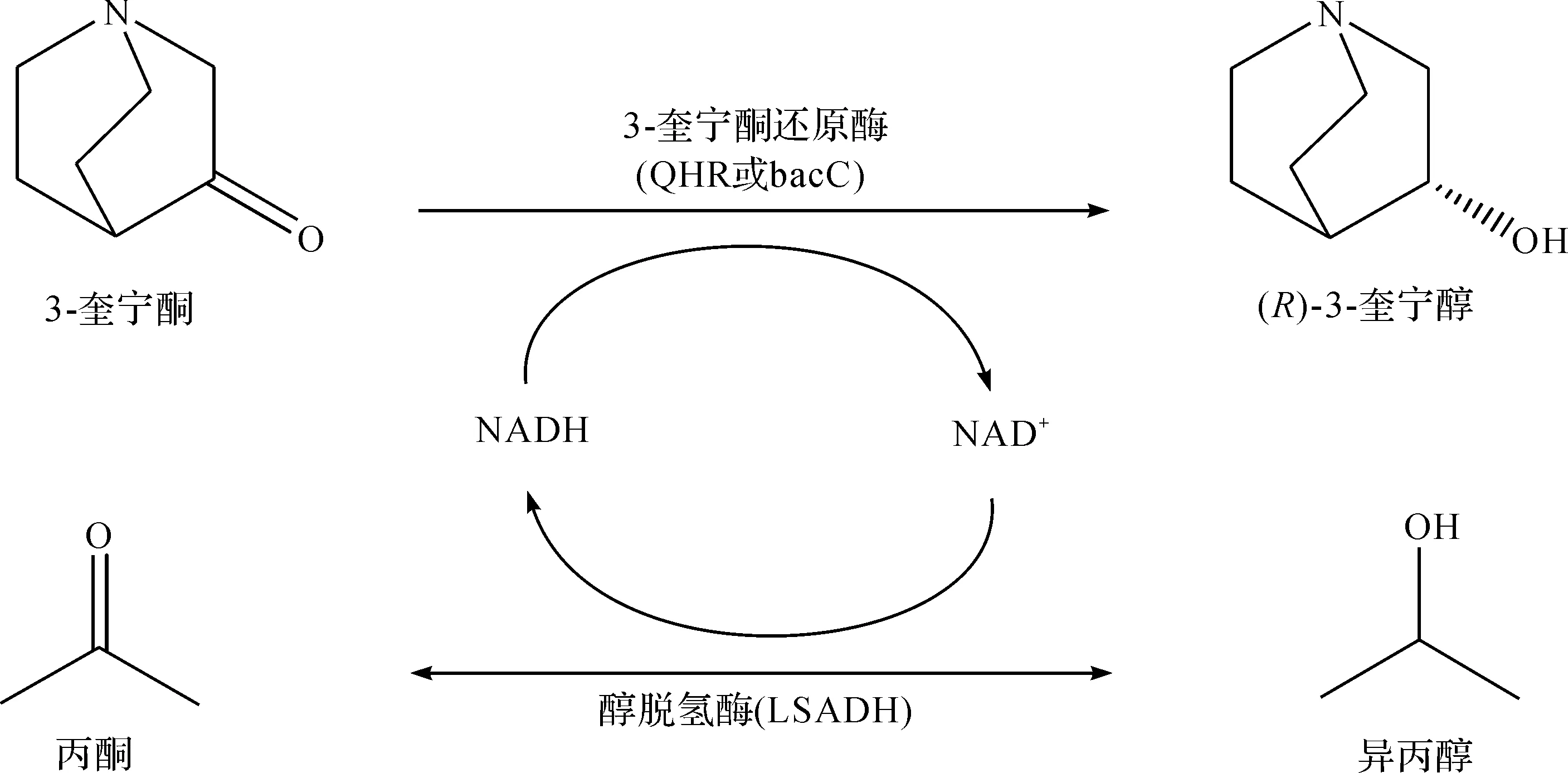
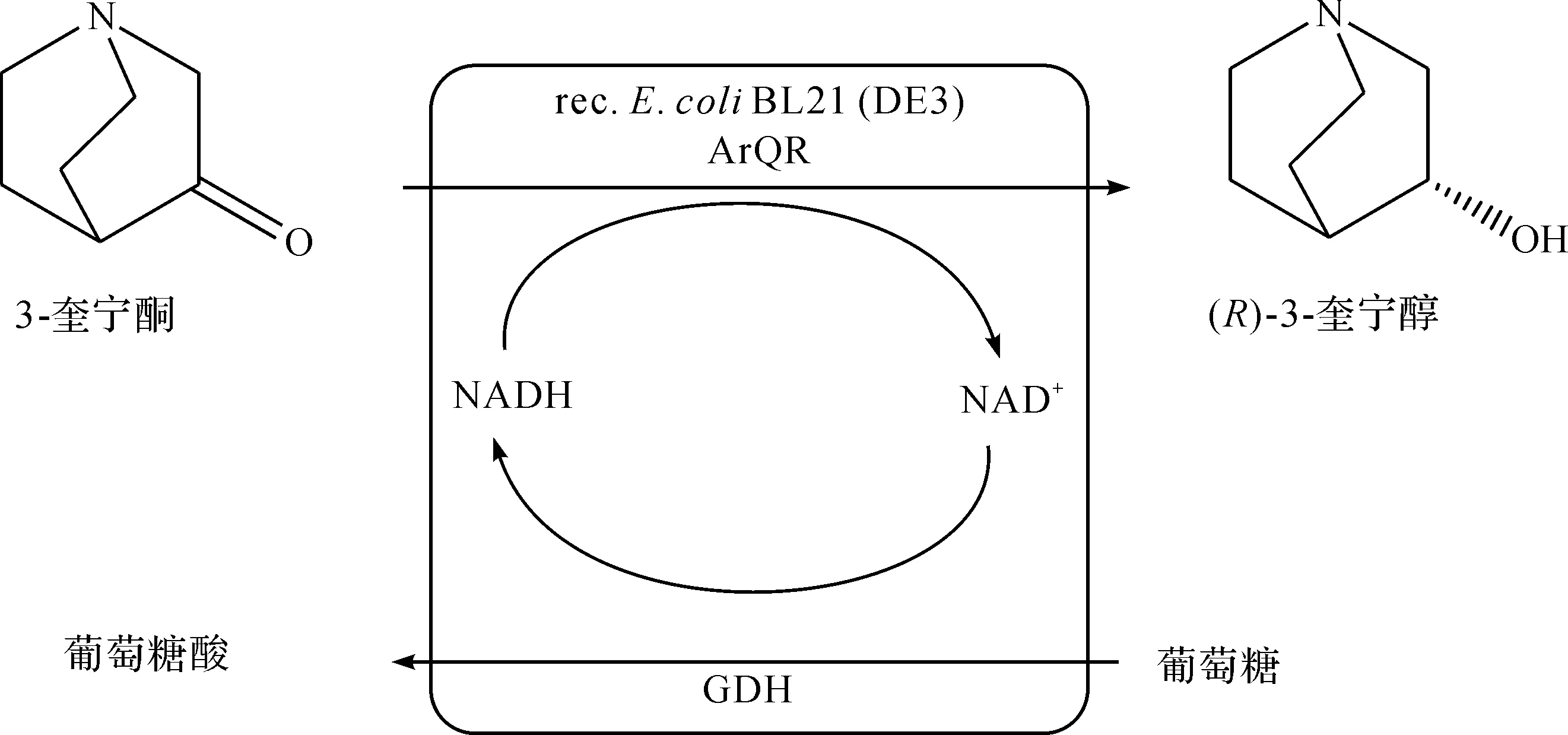
刘笃强[27]采用IMAC(Immobilized metal ion affinity chromatography)法实现了3-奎宁酮还原酶QNR和葡萄糖脱氢酶GDH的原位纯化和固定化,以该固定化酶为催化剂制备(R)-3-奎宁醇的同时实现了辅酶的再生循环.当反应体系中底物与固定化酶质量之比小于14∶1时,底物可完全转化为产物,该固定化酶可重复使用8次.与纯酶催化相比,采用固定化酶不仅增加了酶稳定性,解决了酶回收和重复利用等问题,还实现了辅酶的再生和循环.此外,他还分别采用重组细胞和透性化处理细胞催化转化3-奎宁酮制备(R)-3-奎宁醇.重组细胞可完全转化的最大底物量与湿细胞的质量之比为13∶1,在反应体系中加入体积分数为0.4%的甲苯作为透性剂,可将反应时间缩短0.5~1 h,且e.e.值高达100%.应用透性化技术可增加细胞壁和细胞膜的通透性,提高胞内酶的催化效率.张文霞等[28-29]以不对称还原3-奎宁酮制备(R)-3-奎宁醇为模型反应进行基因挖掘,利用来自放射性土壤杆菌ECU2556的奎宁酮还原酶ArQR催化底物3-奎宁酮还原为(R)-3-奎宁醇.通过镍柱亲和层析对该羰基还原酶进行分离纯化,研究发现在40 ℃,pH 7.0条件下该羰基还原酶的活性最高.此外,还在大肠杆菌中共表达羰基还原酶ArQR和葡萄糖脱氢酶BmGDH,并对葡萄糖脱氢酶和羰基还原酶的串联位置、初始底物加量、生物量和反应时间等因素进行考察,发现0.1 g重组工程菌在30 ℃反应4.5 h后可将质量浓度为242 g/L的底物完全转化为(R)-3-奎宁醇,e.e.值>99%,时空产率达916 g/(L·d),制备路线为
竺伟等[30]以来源于高加索乳杆菌中酮还原酶突变体的重组酮还原酶为催化剂,实现了千克级(R)-3-奎宁醇的制备.反应体系中分别加入适量的重组酮还原酶粉、重组葡萄糖脱氢酶粉、葡萄糖、辅酶以及底物,利用TLC法监控反应进程,当转化率高于99%时结束反应,最高可将7.5 kg的3-奎宁酮盐酸盐转化为5.84 kg(R)-3-奎宁醇,摩尔收率为94%,纯度大于95%,e.e.值大于99%,此反应可转化的底物质量浓度高达500 g/L,与其他合成方法相比大大提高了制备效率.可用于生物不对称还原制备(R)-3-奎宁醇的菌种种类较多,除红酵母属(Rhodotorulasp.)、诺卡菌属(Nocardiasp.)和毛霉属(Mucorsp.)外,戈登氏菌属(Gordoniasp.)、地霉属(Geotrichumsp.)、家村氏菌属(Tsukamurellasp.)和克鲁维酵母属(Kluyveromycessp.)等也可还原3-奎宁酮制备光学纯(R)-3-奎宁醇[31-33].受野生菌受细胞自身结构以及胞内酶数量有限等因素限制,致使底物产物在细胞内外的扩散受阻、可转化的底物浓度有限、催化效率偏低.为此,研究人员采用基因挖掘、定点突变等技术获得了多种可用于制备(R)-3-奎宁醇的羰基还原酶[34]、重组细胞[35-38]以及固定化酶或细胞[39],提高了生物催化剂的催化效率,为(R)-3-奎宁醇的工业化生产提供了技术支持.
3 结 论
(R)-3-奎宁醇作为抗胆碱能药的关键手性中间体一直备受关注,研究人员也从多方面对其制备方法进行了探索.目前采用生物不对称还原法制备(R)-3-奎宁醇的产量可达千克级,且反应条件温和、环境友好,与其他制备方法相比更具有工业化应用前景.虽然采用分离纯化或基因挖掘等方法获得的奎宁酮还原酶的催化能力较强,但在转化体系中酶的稳定性较低,因此可考虑通过定向进化[40-41]等方法进一步提高酶的稳定性,同时利用固定化酶或固定化细胞以实现生物催化剂的重复利用,提高催化效率,降低制备过程的生产成本,更好地实现工业化生产应用.
参考文献:
[1] ENSINGER H A, BECHTEL W, BIRKE F W, et al. WAL 2014 FU(talsaclidine): a preferentially neuron activating muscarinic agonist for the treatment of Alzheimer’s disease[J].Drug development research,2015,40(2):144-157.
[2] BEIER J, MROZ R, KIRSTEN A M, et al. Improvement in 24-hour bronchodilation and symptom control with aclidinium bromide versus tiotropium and placebo in symptomatic patients with COPD: post hoc analysis of a phase III b study[J].International journal of chronic obstructive pulmonary disease,2017,12:1731-1740.
[3] MAGNUSSEN H, ARZT M, ANDREAS S, et al. Aclidinium bromide improves symptoms and sleep quality in COPD: a pilot study[J].European respiratory journal,2017,49(6):1700485.
[4] MCGORUM B C, NICHOLAS D R, FOSTER A P, et al. Bronchodilator activity of the selective muscarinic antagonist revatropate in horses with heaves[J].Veterinary journal,2013,195(1):80-85.
[5] YAMAGUCHI O, KAKIZALI H, HOMMA Y, et al. Solifenacin as add-on therapy for overactive bladder symptoms in men treated for lower urinary tract symptoms-assist, randomized controlled study[J].Urology,2011,78(1):126-133.
[6] KARRAM M, TOGLIA M S, ANDOH M, et al. Treatment with solifenacin increases warning time and improves symptoms of overactive bladder: results from VENUS, a randomized, double-blind, placebo-controlled trial[J].Urology,2009,73(1):14-18.
[7] 胡琦蔚,张俊伟,王远山.生物催化法制备手性酮基布洛芬的研究进展[J].发酵科技通讯,2017,46(3):153-157.
[8] BORNSCHEUER U T, HUISMAN G W, KAZLAUSKAS R J, et al. Engineering the third wave of biocatalysis[J].Nature,2012,485:185-194.
[9] 李书彬,申永存,曾鹏.3-奎宁醇的拆分研究[J].安徽化工,2009,35(1):31-33.
[10] JI J G, LI T, WANG Y. 3-Quinuclidinyl amino-substituted biaryl derivatives: US7309699[P].2007-12-18.
[11] TSUTSUMI K, KATAYAMA T, UTSUMI N, et al. Practical asymmetric hydrogenation of 3-quinuclidinone catalyzed by the XylSkewphos/PICA-Ruthenium(II) complex[J].Organic process research & development,2009,13(3):625-628.
[12] ARAI N, AKASHI M, SUGIZAKI S, et al. Asymmetric hydrogenation of bicyclic ketones catalyzed by BINAP/IPHAN-Ru(II) complex[J].Organic letters,2010,12(15):3380-3383.
[13] 徐亮.一种制备(R)-3-奎宁环醇的方法:CN105085513A[P].2015-11-25.
[14] NOMOTO F, HIRAYAMA Y, IKUNAKA M, et al. A practical chemoenzymatic process to access(R)-quinuclidin-3-ol on scale[J].Tetrahedron asymmetry,2003,14(13):1871-1877.
[15] MUCHMORE D C. Enantiomeric enrichment of(R,S)-3-quinuclidinol: US, EP 0577253 A2[P].1993-06-01.
[16] PRIMOZIC I, BOLANT M, RAMIC A, et al. Preparation of novelmeta- andpara-substituted N-benzyl protected quinuclidine esters and their resolution with butyrylcholinesterase[J].Molecules,2012,17(1):786-795.
[17] 白东亚,何军邀,欧阳斌,等.手性芳基醇的生物催化不对称合成[J].化学进展,2017,29(5):491-501.
[18] TORRELO G, HANEFELD U, HOLLMANN F. Biocatalysis[J].Catalysis letter,2015,145(1):309-345.
[19] BOMMARIUS A S. Biocatalysis: a status report[J].Annual review of chemical & biomolecular engineering,2015,6(1):319-345.
[20] 何军邀,白东亚,王普.恶臭假单胞菌产羰基还原酶的发酵条件优化[J].发酵科技通讯,2017,46(4):243-248.
[21] 邱健,张霞,马宏,等.转化奎宁酮为(R)-3-奎宁醇菌株的筛选及转化条件优化[J].微生物学通报,2011,38(5):736-742.
[22] KOLET S P, JADHAV D D, PRIYADARSHINI B, et al. Fungi mediated production and practical purification of(R)-(-)-3-quinuclidinol[J].Tetrahedron letters,2014,55(43):5911-5914.
[23] WANG Y, LI J, WU Q, et al. Microbial stereospecific reduction of 3-quinuclidinone with newly isolatedNocardiasp. andRhodococcuserythropolis[J].Journal of molecular catalysis B enzymatic,2013,88:14-19.
[24] UZURA A, NOMOTO F, SAKODA A, et al. Stereoselective synthesis of(R)-3-quinuclidinol through asymmetric reduction of 3-quinuclidinone with 3-quinuclidinone reductase ofRhodotorularubra[J].Applied microbiology & biotechnology,2009,83(4):617-626.
[25] ISOTANI K, KUROKAWA J, ITOH N. Production of(R)-3-quinuclidinol byE.colibiocatalysts possessing NADH-dependent 3-Quinuclidinone reductase(QNR or bacC) fromMicrobacteriumluteolumandLeifsoniaalcohol dehydrogenase(LSADH)[J].International journal of molecular sciences,2012,13(10):13542-13553.
[26] ISOTANI K, KUROKAWA J, SUZUKI F, et al. Gene cloning and characterization of two NADH-dependent 3-Quinuclidinone reductases fromMicrobacteriumluteolumJCM 9174[J].Applied environment microbiology,2013,79(4):1378-1384.
[27] 刘笃强.生物催化不对称合成(R)-3-奎宁醇[D].重庆:重庆医科大学,2016.
[28] ZHANG W X, XU G C, HUANG L, et al. Highly efficient synthesis of(R)-3-Quinuclidinol in a space-time yield of 916 g·L-1·d-1using a new bacterial reductase ArQR[J].Organic letters,2013,15(19):4917-4919.
[29] 张文霞.奎宁酮还原酶的挖掘及在制备(R)-3-奎宁醇中的应用性能[D].上海:华东理工大学,2014.
[30] 竺伟,高新星,吴会等.重组酮还原酶在制备(R)-3-奎宁酮中的应用:CN 107435042 A[P].2017-12-05.
[31] SHINYA I. Method for producing optically active 3-quinuclidinol: JP2002153293[P].2002-05-28.
[32] MAKOTO G, MAKOTO U. Production ofR-3-quinuclidinol: JP2000245495[P].2000-09-12.
[33] KAWANO S, NISHIHACHIJYO M, YASOHARA Y, et al. Process for production of(R)-3-quinuclidinol: EP2423320A1[P].2012-02-29.
[34] HOU F, MIYAKAWA T, TAKESHITA D, et al. Expression, purification, crystallization and X-ray analysis of 3-quinuclidinone reductase fromAgrobacteriumtumefaciens[J].Acta crystallographica,2012,68(10):1237-1239.
[35] SPICKERMANN D, HAUSMANN S, EBER S, et al. Variants of the parvibaculum lavamentivorans short-chain alcohol dehydrogenase: EP2904097[P].2015-06-14.
[36] JIA Z, MA H, HUANG Y, et al. Production of(R)-3-quinuclidinol by a whole-cell biocatalyst with high efficiency[J].Biocatalysis & biotransformation,2017:1-8.
[37] 马宏,胡美荣,贾振华,等.一种奎宁酮还原酶KgQR的制备方法及其在制备(R)-3-奎宁醇中应用:CN 106282134 A[P].2017-01-04.
[38] 罗煜,丁时澄,翟旭东,等.一种羰基还原酶及其在制备(R)-3-奎宁醇中的应用:CN 104830814A[P].2015-08-12.
[39] 孙立力,刘笃强,李伟,等.磁性联合交联酶聚集体生物催化剂及其制备方法和应用:CN 107227301A[P].2017-10-03.
[40] 何人宝,胡忠梁,金逸中,等.瑞舒伐他汀侧链(3R,5S)-6-R-取代基-3,5-二羟基己酸叔丁酯合成研究进展[J].发酵科技通讯,2017,46(3):188-192.
[41] SPICKERMANN D, HAUSMANN S, DEGERING C, et al. Engineering of highly selective variants ofParvibaculumlavamentivoransalcohol dehydrogenase[J].Chembiochem,2015,15(14):2050-2052.
