微波辅助萃取人参总皂苷与单体皂苷含量分析
2015-12-10郭双双杨利民张一鸣
郭双双,杨利民,张一鸣,杨 莉,韩 梅
(吉林农业大学中药材学院,吉林 长春 130118)
微波辅助萃取人参总皂苷与单体皂苷含量分析
郭双双,杨利民*,张一鸣,杨 莉,韩 梅
(吉林农业大学中药材学院,吉林 长春 130118)
通过单因素试验和正交试验对微波辅助萃取人参皂苷的工艺条件进行优化,采用分光光度法和高效液相色谱法对萃取物中的人参总皂苷及8 种单体皂苷进行测定,考察不同提取条件下所得人参皂苷产率和组成的差异。结果表明:1)以总皂苷为提取目标时,最佳提取条件为萃取功率600 W、萃取温度45 ℃、萃取时间5 min、料液比1∶20,萃取3 次;2)以8 种单体皂苷为提取目标时,最佳提取条件为萃取功率300 W、萃取温度35 ℃、萃取时间15 min、料液比1∶25,萃取3 次(提取率为0.98%);3)在最佳提取条件下,以体积分数80%甲醇为提取溶剂时,总皂苷提取率为6.02%,而单体皂苷提取率之和为0.43%;以水饱和正丁醇为提取溶剂时8 种单体皂苷提取率达到0.71%。综上所述,人参质量评价和工艺优化结果与提取方法、提取条件、评价指标密切相关。
组成分析;质量评价;单体皂苷;正交试验;高效液相色谱法
人参(Panax ginseng C.A. Mey)为五加科多年生宿生植物,是传统的名贵药材。2012年卫生部批准人参(人工种植)为新资源食品,为人参在食品中应用给予科学的支持与肯定[1]。人参中所含化学成分包括人参皂苷、糖类、氨基酸、维生素、蛋白质、多肽、有机酸、脂溶性成分以及微量元素等[2]。现代医学证明,人参皂苷是人参中最为重要的一类生理活性物质,具有调节中枢神经系统、改善心血管及造血系统、调节内分泌系统、提高免疫力、抗疲劳作用以及抗癌等作用,目前,人参中已发现单体皂苷40多种[3],其含量约占人参干质量的4%[4],而人参主根中总皂苷含量约占干质量的2.0%~7.0%。
人参总皂苷和单体皂苷的生理活性研究一直都是活跃的研究领域,不同的人参皂苷都有其独特的生理功能,甚至某些人参单体成分药理作用截然相反[3],如人参总皂苷是否具有溶血活性常因所用原料、提取方法及提取条件不同导致结论完全相反。这些成分在制剂中差别较大,势必会影响疗效,因此,发展标准化的人参标准提取物是有必要的[5]。单体皂苷作用不同,单体化合物制剂也是一个发展趋势。
人参皂苷的传统提取方法有煎煮法、浸渍法、渗滤法、回流法、连续回流提取法、索氏提取法等[6]。近年来,一些新的提取技术不断应用于人参及人参皂苷提取的研究中,如超声提取法、超临界流体提取法、微波辅助提取法等[7-11]。微波辅助提取法是将微波技术与传统的溶剂提取法结合后形成的一种提取方法,具有萃取时间短、萃取效率高及重复性好等优点,已被广泛应用于人参植物中人参皂苷的提取,但仍存在萃取温度、萃取时间、提取料液比等方面的问题,限制了微波辅助提取技术的实际应用。
针对上述问题,本实验对人参皂苷的微波辅助提取工艺进行研究,在单因素试验的基础上,采用正交试验法对微波辅助提取工艺条件进行优化。现已有多种分析方法被用于人参植物原料、提取物以及人参产品中人参皂苷定性和定量分析[12-17],本实验分别利用分光光度法和高效液相色谱(high performance liquid chromatography,HPLC)法测定人参中总皂苷含量和人参中8 种主要皂苷单体Rg1、Re、Rb1、Rc、Rb2、Rd、Rf、Rb3,研究同一提取方法不同提取条件总皂苷与单体皂苷之间差异程度,为安全、高效、简捷地提取目标单体人参皂苷提供参考。
1 材料与方法
1.1 材料与试剂
生晒参(主根)吉林省集安地区人工种植5 a人参;人参单体皂苷对照品Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd及人参总皂苷对照品Re(纯度≥98%) 中国食品药品检定研究院;甲醇、乙腈(均为色谱纯) 美国Fisher Scientifi c公司;甲醇(萃取剂)等其他试剂均为分析纯。
1.2 仪器与设备
1100高效液相色谱仪 美国安捷伦公司;MARS5微波萃取仪 美国CEM公司;6202高速粉碎机 原鑫田欣镇企业有限公司;AUY220电子天平、UV-1700紫外分光光度计 日本岛津公司;DL-820E智能超声波清洗器 上海之信仪器有限公司;RE-52A旋转蒸发器上海亚荣生化仪器厂;SHZ-95A循环水真空泵 巩义市予华仪器有限责任公司;HH-6数显恒温水浴锅 常州澳华仪器有限公司。
1.3 方法
1.3.1 微波萃取人参皂苷单因素考察
将过筛后(40 目)的人参主根粉末,放入乙醚中浸泡3 h(1∶20(g/mL)),除去脂溶性杂质后过滤,将粉末60 ℃烘干备用。称取1 g人参粉末放入萃取罐,按照设定的条件进行提取、过滤、减压浓缩,浓缩液定容至25 mL备用。
通过控制单一变量的方法,分别对不同萃取时间、萃取温度、萃取功率、萃取次数、萃取溶剂和料液比进行考察。微波提取条件为料液比1∶30(g/mL)、萃取时间15 min、萃取温度50 ℃、萃取功率600 W、萃取次数3 次,以人参总皂苷提取率为考察指标,考察各个因素对结果的影响。单因素梯度分别设置为萃取溶剂(水、体积分数70%乙醇、体积分数80%甲醇、水饱和正丁醇);萃取次数(1、2、3、4 次);萃取温度(35、40、45、50、60 ℃);萃取时间(3、5、10、15、20 min);料液比(1∶10、1∶15、1∶20、1∶30、1∶35)。
1.3.2 微波萃取条件的优化
为全面考察微波萃取中各因素的影响,在单因素试验的基础上设计正交试验。称取人参原料1 g,以体积分数80%甲醇为萃取剂,提取3 次。以萃取温度、萃取时间、萃取功率和料液比为考察因素,以人参总皂苷的提取率为考察指标,采用L9(34)正交试验进行优化,确定微波萃取人参皂苷的最佳工艺条件,试验的各因素水平见表1。

表 1 正交试验因素水平表Table 1 Factors and levels for orthogonal array design
1.3.3 分光光度法测定人参总皂苷
利用香草醛-硫酸比色法[18]测定人参总皂苷。
1.3.4 人参皂苷单体的HPLC测定
1.3.4.1 色谱条件

表 2 梯度洗脱表Table 2 Mobile phase composition for gradient elution
Agilent ZORBAX-C18(250 mm×4.6 mm,5 μm)色谱柱;流动相乙腈(A)-水(B)梯度洗脱;洗脱条件见表2;流速1.0 mL/min;检测波长203 nm;柱温25 ℃;进样量20 μL。
1.3.4.2 对照品溶液的制备
精密称取8 种单体人参皂苷对照品适量,加甲醇制成每毫升含Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd分别为0.25、0.25、0.2、0.25、0.2、0.2、0.125、0.2 mg的对照品混合溶液,过0.45 μm微孔滤膜,备用。
1.3.4.3 线性关系的考察
精密吸取对照品溶液3、6、9、12、15、18 μL按1.3.4.1节色谱条件分别进样,以所测得物质平均峰面积为纵坐标(y),对照品溶液质量浓度为横坐标(x),绘制标准曲线,建立回归方程,见表3。
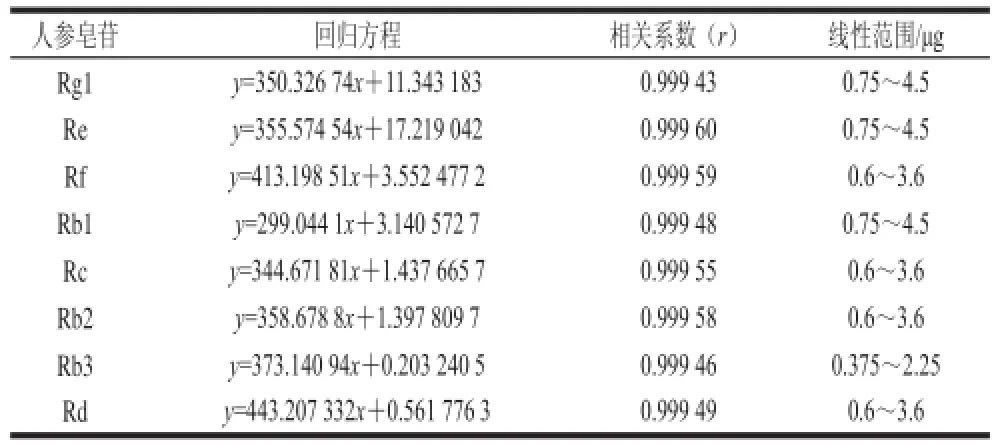
表 3 人参单体皂苷的回归方程Table 3 Regression equations with correlation coeffi cients of 8 ginsenoside monomers
1.3.4.4 样品的测定
将1.3.1节所定容的25 mL提取物,过0.22 μm的滤膜,按照1.3.4.1节色谱条件进样,记录色谱峰面积,利用标准曲线计算上述8 种人参皂苷单体的提取率(提取率即提取物中皂苷质量占样品总质量的百分数)采用SPSS软件对所得数据进行统计分析。
1.4 数据分析
每组实验在相同的条件下平行3 次,以降低实验操作过程所产生的误差,数据均以±s表示,利用SPSS 17.0方差分析对组间和组内差异进行比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 微波辅助萃取人参皂苷单因素试验结果
2.1.1 不同萃取溶剂的影响
由图1可以看出,以体积分数80%甲醇作萃取剂时,人参皂苷提取率最高,体积分数70%乙醇提取率仅次于甲醇,且与其他萃取剂之间存在显著差异(P<0.05),水为提取剂时人参皂苷提取率最低。

图 1 萃取溶剂对人参皂苷提取率的影响Fig.1 Effect of extraction solvents on the yield of ginsenosides
2.1.2 单因素试验结果

图 2 微波辅助提取单因素试验结果Fig.2 Single factor experimental results of microwave-assisted extraction
由图2可知,微波辅助提取人参总皂苷各个单因素的最佳水平分别为萃取次数为3 次、料液比1∶30、萃取温度40 ℃、萃取时间5 min。
2.2 正交试验结果
按照表4进行正交试验,对不同因素水平的试验结果进行极差分析,结果如表5所示。根据表4中的R值,可以看出各因素对微波辅助萃取人参皂苷提取率的影响程度依次为B>D>C>A,即萃取功率的影响最大,其次分别为料液比、萃取温度、萃取时间。由表5的方差分析结果可知,萃取时间、萃取温度、料液比和萃取功率均对人参皂苷提取率的影响达到极显著水平(P<0.01),说明影响人参皂苷提取率的4 个因素变化都很敏感。
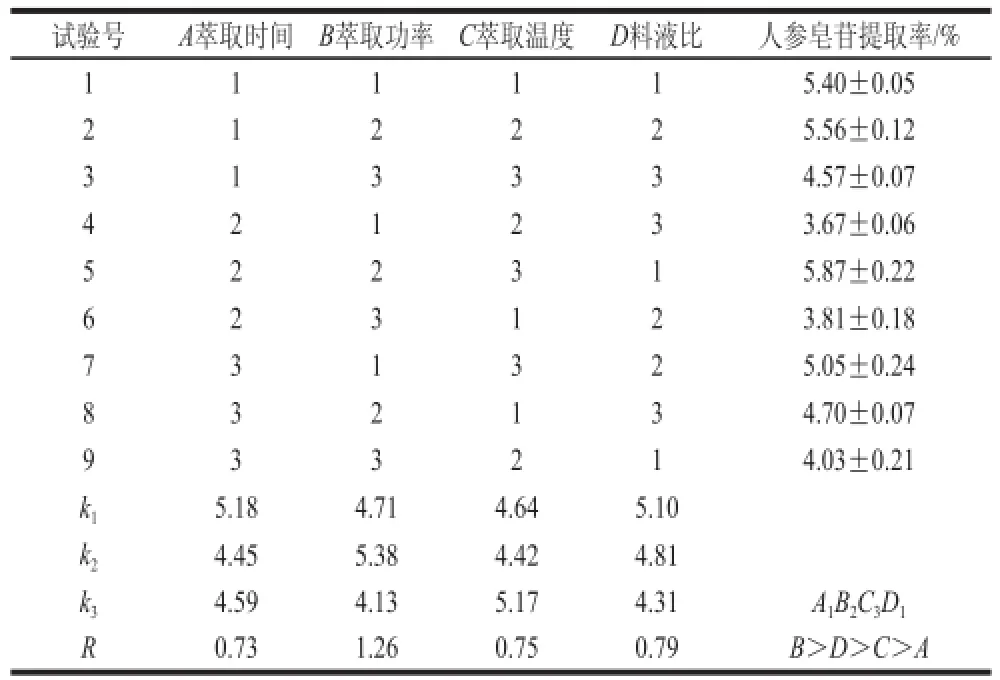
表 4 L9(34)正交试验结果与极差分析Table 4 Results of L9(34) orthogonal array design and range analysis

表 5 正交试验方差分析结果Table 5 Analysis of variance of the orthogonal array design
根据极差分析结果,确定微波辅助萃取人参皂苷的最佳理论条件为萃取功率600 W、萃取温度45 ℃、萃取时间5 min、料液比1∶20,以体积分数80%甲醇为萃取剂萃取3 次。在最佳理论条件下进行验证实验,总皂苷提取率为6.02%。
2.3 微波辅助萃取人参皂苷HPLC组成分析
2.3.1 最佳理论条件下组成分析
分别对Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd 8 种人参单体皂苷进行测定,含量依次为0.263%、0.096%、0.052%、0.144%、0.050%、0.039%、0.000%、0.013%。按照含量从大到小排序为:Rg1>Rb1>Re>Rf>Rc>Rb2>Rd>Rb3。这8 种皂苷是人参中含量较丰富的几种皂苷,常作为评价人参质量和鉴定人参标准。其中Rg1提取率最高,其次是Rb1和Re,文献中报道人参皂苷Rg1具有促进中枢神经兴奋、抗疲劳、改善记忆、促进DNA和RNA合成等作用;人参皂苷Rbl对提高记忆具有促进作用,还具有促进神经递质释放、增强第2信使活性等作用;而人参皂苷Re具有抑制中枢神经、促进刺激肾皮质荷尔蒙分泌作用。这与樊红秀等[19]超临界萃取人参皂苷及HPLC分析Rb1的提取率较高相关,其次为Rg1和Re结果基本一致。
2.3.2 不同提取剂组成分析

表 6 不同提取剂微波萃取人参皂苷组成分析Table 6 Effect of different extraction solvents on ginsenoside composition
由表6可知,用不同提取剂萃取所得8 种单体皂苷含量按大小排序。利用SPSS分析可知8 种单体皂苷含量之间存在显著差异。以水饱和正丁醇作提取剂时,除Re外其他7 种单体皂苷提取率均最高,并且8 种皂苷总和仍然最高。水和体积分数70%乙醇做萃取剂时仅Rg1、Rb3、Rd 3 种皂苷存在显著差异,其他5 种皂苷含量一样。当以体积分数80%甲醇为萃取剂时,8 种单体皂苷的提取率均处于最低水平,且Rb3、Rd未被检测到。与2.1.1节结果不符,说明虽然体积分数80%甲醇作为提取剂总皂苷提取率高,但是这8 种常见皂苷含量较低,可能是微波辅助提取过程中皂苷被分解成次级皂苷。人参中含量较高的人参皂苷有Rg1、Re、Rb1、Rc、Rb2和Rd等,一些在人参中含量极低的人参皂苷被称为次级人参皂苷或稀有人参皂苷。研究结果表明,一些次级人参皂苷具有很强的药理活性,如人参皂苷Rg3具有抑制肿瘤细胞的增殖、抗肿瘤细胞浸润和转移等作用,人参皂苷Rh1也具有抗癌的功效等。王玉堂等[20-21]分别对人参皂苷Rg1、Re、Rb1、Rc、Rb2和Rd标准品进行高压微波降解,从而确定人参提取液中各次级人参皂苷的来源。压力600 kPa、时间10 min条件下6 种人参单体皂苷均完全降解,主要产物为一些中低极性产物。
2.3.3 不同因素水平间的组成分析
由表7可知,正交试验9 个水平萃取所得8 种单体皂苷含量按大小排序,与表6结果基本一致。但同1 种人参单体皂苷在不同提取条件下存在显著差异。由此可知8 种常见人参单体皂苷在人参主根中含量存在显著差异,且当改变提取条件时,对同一种人参单体皂苷的提取率存在显著影响,但对8 种人参皂苷提取率排序无显著影响。
分别以8 种单体皂苷提取率之和、三醇型提取率、二醇型提取率、总皂苷提取率为指标,分别进行极差分析,所得结果如表8所示。

表 7 L9(34)正交试验HPLC结果Table 7 Results of L9(34) orthogonal array design

表 8 正交试验以不同指标进行极差分析结果Table 8 Results of range analysis for different indexes
由表8可知,选择不同指标时,所得的结果存在很大差异。说明当提取条件发生改变时,各单体皂苷含量会发生很大变化。目前中国药典中以人参皂苷Rg1和Re的含量作为评判标准[22],但很多生产企业由于技术力量及检测设备等存在缺陷,仍有大部分地区以总皂苷含量作为质控的主要指标,其中的差异应予以重视。有必要研究以不同皂苷含量为指标,并且人参质量评价结果与选择的结果密切相关[23],研究同种提取方法相同条件下,对所得结果进行分析,建立合理统一的质量评价标准,不仅可以规范人参质量评价指标,而且可以获得更多的目标成分。
3 结 论
皂苷类物质是人参中主要的活性物质,根据皂苷元的结构,人参皂苷可分为二醇型、三醇型和齐墩果酸型,每种类型中又包括多种单体皂苷。目前研究显示,人参总皂苷含量、不同类型人参皂苷含量或单体人参皂苷含量均可作为人参品质评价的指标[24]。根据本研究结果显示,以总皂苷为指标时,微波辅助提取最佳条件为萃取功率600 W、萃取温度45 ℃、萃取时间5 min、料液比1∶20,以体积分数80%甲醇为萃取剂萃取3 次,以8 种单体皂苷提取率之和为指标时,微波辅助最佳提取最佳条件为萃取功率300 W、萃取温度35 ℃、萃取时间15 min、料液比1∶25,以体积分数80%甲醇为萃取剂萃取3 次。通过对8 种单体皂苷研究发现,不同提取条件下8 种单体皂苷的大小顺序基本无变化,说明这8 种单体皂苷在人参主根中含量差别很大。另外,当以总皂苷为指标时,以体积分数80%甲醇作萃取剂最好与张晶等[25]研究不同,甲醇提取提取率最高只是在实验室得到的理论值,但在实际的生产中还是要考虑采用乙醇。而以8 种单体皂苷提取率之和为指标时,以水饱和正丁醇为萃取剂最好,体积分数80%甲醇提取率最次。体积分数70%乙醇对总皂苷和单体皂苷的提取效果都比较稳定,在食品或药品原料制备中,选择萃取溶剂不仅要考虑到提取率的高低,还要考虑到食品安全性方面的问题,同时说明同一种提取方法不同提取条件,人参皂苷的提取率及组成具有较大差异。这与张艳荣等[26]研究基本一致,从而可知提取方法的不同与提取条件的不同都对人参皂苷的提取率及组成具有较大差异。
本研究仅对微波辅助提取条件对人参皂苷含量的影响进行研究,为更加细致的建立人参品质评价系统及深度研究开发不同单体皂苷还需进一步对不同提取方法及不同提取条件进行比较分析。
[1] 卫生部. 卫生部公告2012年第17号: 关于批准人参(人工种植)为新资源食品的公告[S].
[2] 张萍, 王金东, 肖新月, 等. 人参化学成分分析方法的研究进展[J].中草药, 2004, 35(10): 1429-1433.
[3] 窦德强, 靳玲, 陈英杰. 人参的化学成分及药理活性的研究进展与展望[J]. 沈阳药科大学学报, 1999, 16(2): 151-156.
[4] SHI Wei, WANG Yutang, LI Juan, et al. Investigation of ginsenosides in different parts and ages of Panax ginseng[J]. Food Chemistry, 2007, 102(3): 664-668.
[5] 王玉堂. 人参中人参皂苷的提取、分离和测定[D]. 长春: 吉林大学, 2008.
[6] 冯育林, 谢平, 孙叶兵, 等. 中药提取工艺应用进展[J]. 中药材, 2002, 25(12): 908-911.
[7] ZHANG Shouqin, CHEN Ruizhan, WU Hua, et al. Ginsenoside extraction from Panax quinquefolium L. (American ginseng) root by using ultrahigh pressure[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(1): 57-63.
[8] GAFNER S, BERGERON C, MCCOLLOM M M, et al. Evaluation of the efficiency of three different solvent systems to extract triterpenesaponins from roots of Panax quinquefolius using highperformance liquid chromatography[J]. Journal of Agricultural and Food Chemistry, 2004, 52(6): 1546-1550.
[9] KIM S J, MURTHY H N, HAHN E J, et al. Parameters affecting the extraction of ginsenosides from the adventitious roots of ginseng (Panax ginseng C.A. Meyer)[J]. Separation and Purifi cation Technology, 2007, 56(3): 401-406.
[10] 陈军辉. 西洋参皂苷的HPLC测定及不同提取方法比较[J]. 天然产物研究与开发, 2006, 18(1): 120-125.
[11] WOOD J A, BERNARDS M A, WAN W K, et al. Extraction of ginsenosides from North American ginseng using modified supercritical carbon dioxide[J]. The Journal of Supercritical Fluids, 2006, 39(1): 40-47.
[12] FUZZATI N, GABETTA B, JAGAKER K, et al. Liquid chromatography-electrospray mass spectrometric identification of ginsenosides in Panax ginseng roots[J]. Journal of Chromatography A, 1999, 854(1/2): 69-79.
[13] FUZZATI N. Analysis methods of ginsenosides[J]. Journal of Chromatography B, 2004, 812(1): 119-133.
[14] CORTHOUT J, NAESSENS T, APERS S, et al. Quantitative determination of ginsenosides from Panax ginseng roots and ginseng preparations by thin layer chromatography-densitometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 1999, 21(1): 187-192.
[15] 桂双英, 周亚球. 比色法测定人参中人参总皂苷的含量[J]. 安徽中医学院学报, 2003, 22(4): 51-55.
[16] CORBIT R M, FERREIRA J F S, EBBS S D, et al. Simplified extraction of ginsenosides from american ginseng (Panax quinquefolius L.) forhigh-performance liquid chromatography-ultraviolet analysis[J]. Journal of Agricultural and Food Chemistry, 2005, 53(26): 9867-9873.
[17] PARK M K, PARK J H, HAN S B, et al. High-performance liquid chromatographic analysis of ginseng saponins using evaporative light scattering detection[J]. Journal of Chromatography A, 1996, 736: 77-81.
[18] 曲正义, 赵景辉, 刘宏群, 等. 比色法测定保鲜人参中人参总皂苷的含量[J]. 人参研究, 2012(1): 13-14.
[19] 樊红秀, 刘婷婷, 刘鸿铖, 等. 超临界萃取人参皂苷及HPLC分析[J].食品科学, 2013, 34(20): 121-126.
[20] 王玉堂, 李绪文, 金海燕, 等. 人参中人参皂苷的直接高压微波辅助降解[J]. 高等学校化学学报, 2007, 28(12): 2264-2269.
[21] WANG Yutang, YOU Jingyang, YU Yong, et al. Analysis of ginsenosides in Panax ginseng in high pressure microwave-assisted extraction[J]. Food Chemistry, 2008, 110(1): 161-167.
[22] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 化学工业出版社, 2010: 7.
[23] 王晓郁, 林红梅, 杨莉, 等. 吉林省几个主要产区人参药材品质评价[J].吉林农业大学学报, 2013, 35(5): 673-678.
[24] 张崇喜, 郑兰友, 李向高, 等. 规范化栽培的吉林人参质量评价研究[J].吉林农业大学学报, 2003, 25(4): 404-406.
[25] 张晶, 陈全成, 弓晓杰, 等. 不同提取方法对西洋参皂苷提取率的影响[J]. 吉林农业大学学报, 2003, 25(1): 71-73.
[26] 张艳荣, 张帅, 樊红秀, 等. 提取方法对吉林种植人参提取物皂苷含量及组成的影响[J]. 食品科学, 2013, 34(12): 16-21.
Determination of Contents of Total Saponins and Monomer Saponins in Panax ginseng by Microwave-Assisted Extractiion Method
GUO Shuangshuang, YANG Limin*, ZHANG Yiming, YANG Li, HAN Mei
(College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China)
Single factor and orthogonal array designs were applied to optimize the conditions for microwave-assisted extraction of ginsenosides, and the determination of eight main monomer saponins and total saponins in Panax ginseng extracts was performed by high performance liquid chromatography and spectrophotometry to investigate the influence of different extraction conditions on the ginsenoside contents and composition in Panax ginseng extracts. The results showed that 1) the optimum extraction conditions for total saponins were determined as follows: microwave power, 600 W; extraction temperature, 45 ℃; extraction time, 5 min; the ratio of material to solvent, 1:20; and extraction number, 3; 2) the optimum extraction conditions for saponin monomers (leading to an extraction yield of 0.98%) were 300 W, 35 ℃, 15 min, a material-to-solvent of 1∶25, and three extraction cycles; 3) under the optimum conditions, with 80% aqueous methanol as the extraction solvent, the yield of total saponins was 6.02%, while the total yield of eight ginsenoside monomers was 0.43% compared to 0.71% with water-saturated butanol as the extraction solvent. In summary, ginseng quality evaluation and process optimization results were infl uenced by different extraction methods, extraction conditions and evaluation indexes.
composition analysis; quality evaluation; monomer saponin; orthogonal array design; high performance liquid chromatography (HPLC)
TS201.4
A
1002-6630(2015)02-0001-06
10.7506/spkx1002-6630-201502001
2014-06-11
国家自然科学基金面上项目(31270371);“十二五”国家科技支撑计划项目(2011BAI03B01-02);吉林省科技成果转化项目(20125068)
郭双双(1991—),男,硕士研究生,研究方向为中药材质量评价。E-mail:1530811226@qq.com
*通信作者:杨利民(1963—),男,教授,博士,研究方向为中药资源生态与药材质量调控。E-mail:ylmh777@126.com
