蜂毒镇痛作用的昼夜变化及对外周血P物质β-内啡肽和IL-1β水平的影响
2024-04-07李振彬高囡囡郭静波郭栋梁
董 泓, 李振彬, 高囡囡, 郭静波, 郭栋梁
(1.中国人民解放军白求恩国际和平医院, 河北 石家庄 050082 2.河北医科大学研究生院, 河北 石家庄 050011)
国际疼痛研究协会(The International Association for the Study of Pain,IASP)将疼痛定义为:与实际或潜在的组织损伤相关或类似的不愉快的感觉和情感体验[1]。我国慢性疼痛患病率超过30%,而疼痛完全缓解率、知晓率和就诊率均处于较低水平[2]。疼痛已成为继心脑血管疾病、肿瘤之后第三大健康问题,严重影响我国人民生命健康和生活质量。完善镇痛方案已成为临床治疗疼痛的一个亟待解决的问题。研究表明,疼痛反应具有明显的昼夜节律;而时间治疗,即择时给药方案有助于达到增效或减毒的目的[3]。蜂毒作为一种传统的抗风湿治疗药物,其镇痛抗炎作用得到了现代研究的证实。但是,关于蜂毒镇痛作用的昼夜变化迄今尚未见报道。本研究首次探索了蜂毒镇痛作用的时间治疗学方案,在建立小鼠疼痛模型昼夜节律的基础上,观察了注射用蜂毒在昼夜不同时间给药对多种小鼠疼痛模型的镇痛效应,并分析其对疼痛模型小鼠血清P物质(Substances P,SP)、β-内啡肽(Beta-endorphin, β-EP)和IL-1β(interleukin-1β,IL-1β)水平的影响,以期为蜂毒的临床时间治疗提供实验依据。
1 材料与方法
1.1动物与环境:SPF级昆明小鼠,体质量(20±2)g,由北京华阜康生物科技股份有限公司提供,实验动物许可证号:SCKX京2019-0008。将实验动物置于光照(L)∶黑暗(D)=12∶12时间生物学实验室饲养2周后用于实验,其中明期光照强度为250~350Lux。饲养期间,实验动物自由饮水、摄食,维持室温(21±3)℃,相对湿度50%~60%。该研究项目获得中国人民解放军白求恩国际和平医院医学伦理委员会批准(批件号:2020-KY-200)。
1.2药品与试剂:注射用蜂毒购于华北制药厂(批号:FDMG10302);盐酸吗啡注射液购于东北制药集团沈阳第一制药有限公司(批号:200604-2);冰乙酸分析纯购于天津市致远化学试剂有限公司(批号:2018-091018);P物质和β-内啡肽ELISA 检测试剂盒(批号:ZCIBIO202203),IL-1β ELISA 检测试剂盒(批号:A201B20314),均购于杭州联科生物技术有限公司。
1.3仪器:HSS-1B数字式超级恒温浴槽、YLS-12A鼠尾光照测痛仪和YLS-Q1型小鼠固定筒架,均购于中国济南益延科技发展有限公司;S1010E微型离心机,美国SCILOGEX公司;MK3型酶标仪,美国Thermo Forma公司;JCZ-GPL型干燥培养两用箱,上海成顺仪器仪表有限公司,WSZ-100B型回旋振荡器/培养摇床,上海一恒科学仪器有限公司。
1.4方 法
1.4.1小鼠痛阈的昼夜节律观察:采用热板法、辐射热甩尾法建立小鼠疼痛模型。将自然时间转化为授时时间(Zeitgeber Time,ZT),在6个授时时间点(ZT2、ZT6、ZT10、ZT14、ZT18、ZT22)分别测量其痛阈变化。 热板法:调节恒温装置,使水温控制在(55±0.1℃)。为避免雄性小鼠受热后阴囊下垂对痛阈评价的影响,本实验选用雌鼠。将雌性小鼠置于预热好的热板上,计算小鼠出现舔后足所需时间(s)作为痛阈值。选择痛阈值在5~30s的雌性小鼠20只,分别于上述6个授时时间点测量痛阈。每只鼠在每个时间点测2次痛阈值,取2次平均值作为该鼠的痛阈。辐射热甩尾法:取小鼠20只,雌雄各半,将其装入固定筒架中,距鼠尾尖1/3处用75%酒精消毒后标记照射部位,置于辐射热测痛仪的光源处,以照射(辐射热照射强度为30W)开始到甩尾反应的潜伏期(s)作为痛阈值。每只鼠在上述6个授时时间点各测2次, 每次间隔 5min, 取2次测量平均值作为其痛阈。
1.4.2注射用蜂毒对3种疼痛模型的镇痛作用及其昼夜差异:根据小鼠痛阈昼夜节律实验的结果,选择在痛阈昼夜节律的峰值(ZT6)和谷值(ZT22)2个时间点给药,给药剂量参照文献[4]。采用热板法、辐射热甩尾法和扭体法三种小鼠疼痛模型进行3批实验。小鼠分组与给药:在热板法、辐射热甩尾法和扭体法三种实验中,每种方法设ZT6和ZT22两个时间点给药,每个时间点均设立模型(Model,MOD)、吗啡(Morphine,MOR,10mg/kg)、注射用蜂毒高剂量(Bee venom for injection-High dose,BVI-H,4mg/kg)、注射用蜂毒中剂量(Bee venom for injection-Medium dose,BVI-M,2mg/kg)和注射用蜂毒低剂量(Bee venom for injection-low dose,BVI-L,1mg/kg)组,每组10只。均采用腹腔注射给药。热板法:参照1.4.1实验方法,将合格雌性小鼠于ZT6和ZT22两个时间点测量基础痛阈后腹腔注射给药,在给药后20、40、60、80min分别测量小鼠痛阈值。如60s内小鼠仍无反应,将小鼠取出,以免烫伤,痛阈按60s计算。计算痛阈增加值(Increased threshold of pain,ITP):给药后痛阈-基础痛阈。辐射热甩尾法:参照1.4.1实验方法,选择基础痛阈在8s以内的小鼠(雌雄各半),于给药后20、40、60、80min分别测量其痛阈值。如小鼠于16.01s内仍无反应,照射自动停止,以免烫伤,其痛阈以16.01s计算。计算痛阈增加值(ITP):给药后痛阈-基础痛阈。扭体法:取小鼠(雌雄各半)于ZT6和ZT22两个时间点给药;给药60min后于小鼠腹腔注射0.6%冰醋酸0.2mL/只,摄影记录小鼠的扭体反应(腹部内凹、伸展后肢、臀部抬高),以注射冰醋酸后60min内出现的扭体次数作为痛阈值。实验结束后,分别将小鼠脱颈处理,立即心脏取血,室温静置1h后, 离心15min(3500r/min),采集血清,-80℃冰箱低温保存。ELISA法检测小鼠外周血P物质、β-内啡肽和IL-1β的含量。

2 结 果
2.1小鼠痛阈的昼夜节律:实验结果显示,采用热板法和辐射热甩尾法致痛模型小鼠的痛阈均具有明显的昼夜差异:痛阈的峰值位于ZT6,而谷值位于ZT22 ,见图1。采用余弦法分析,其峰值相位分别为-190度和-220度,位于明中期;谷值相位分别为-20度和-40度,位于暗后期,见图2。热板法与辐射热甩尾法的最佳拟合余弦曲线分别为:Y热板=23.37+3.55cos(15t-203.50);Y辐射热=5.36+1.16cos(15t-199.75)。
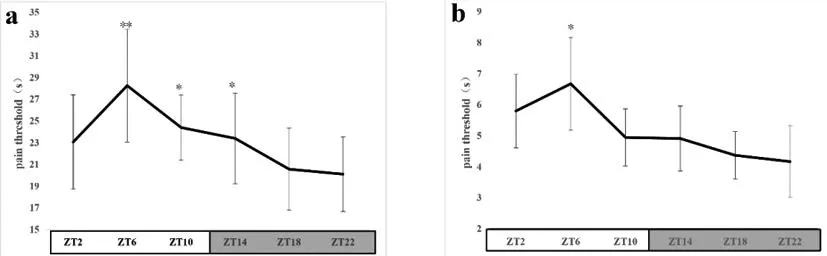
图1 热板法和辐射热甩尾法所致正常小鼠痛阈的昼夜变化
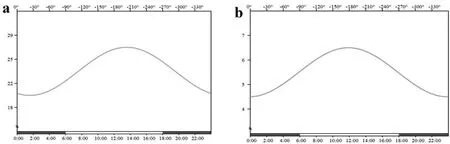
图2 小鼠痛阈余弦法分析
2.2注射用蜂毒镇痛作用的昼夜差异
2.2.1热板法:以痛阈增加值(ITP)评价BVI和MOR的镇痛作用可见,不同剂量的BVI对热板法致痛模型小鼠的镇痛作用均具有显著的昼夜差异,BVI在ZT22给药的痛阈改善值明显优于ZT6给药。与此相似,MOR在快速起效的同时,其镇痛作用也存在昼夜变化,ZT22给药优于ZT6给药。BVI三个剂量组痛阈改善值在60min内持续增高,呈量-效关系:随给药时间推移,BVI剂量越高,痛阈改善值越大。见图3(a)

图3 BVI对热板法和辐射热甩尾法致痛模型镇痛作用的昼夜差异
2.2.2辐射热甩尾法:与热板法的结果相似,BVI和MOR对辐射热甩尾法致痛模型小鼠的镇痛作用也具有昼夜变化,ITP以ZT22给药组明显优于ZT6给药组,但是在该模型小鼠BVI的镇痛作用未显示量-效关系,其镇痛效应以BVI-M组最佳。见图3(b)。
2.2.3扭体法:以扭体次数评价BVI和MOR的镇痛作用可见,MOR和不同剂量BVI对扭体法致痛小鼠模型均具有明显的镇痛效应;其中,MOR的镇痛作用显示出昼夜差异,ZT22给药组优于ZT6给药组(P<0.01),而不同剂量BVI对扭体法小鼠疼痛模型的镇痛作用未显示昼夜变化,尽管小剂量和大剂量BVI也显示了ZT22给药优于ZT6给药的趋势。不同剂量BVI对扭体法小鼠疼痛模型镇痛作用的昼夜差异无统计学意义。见图4。
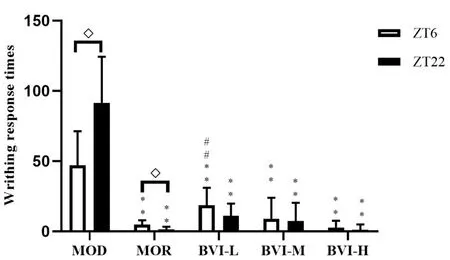
图4 BVI对扭体法疼痛模型小鼠扭体次数的影响
2.3BVI对疼痛模型小鼠血清β- EP、SP和IL-1β水平影响的昼夜差异。
2.3.1BVI对疼痛模型小鼠血清β-EP水平影响的昼夜差异:由图5(a-b-c)可见,吗啡组在热板法、辐射热甩尾法和扭体法三种疼痛模型均可明显上调疼痛模型小鼠血清β-EP水平(P<0.05),且呈现ZT22给药上调程度高于ZT6给药的昼夜变化趋势。注射用蜂毒给药组中,仅BVI-L组对热板法疼痛模型小鼠血清β-EP水平具有上调效应,但随着剂量增加反呈现下调效应;在其他两种疼痛模型中也具有类似现象,且无昼夜差异。
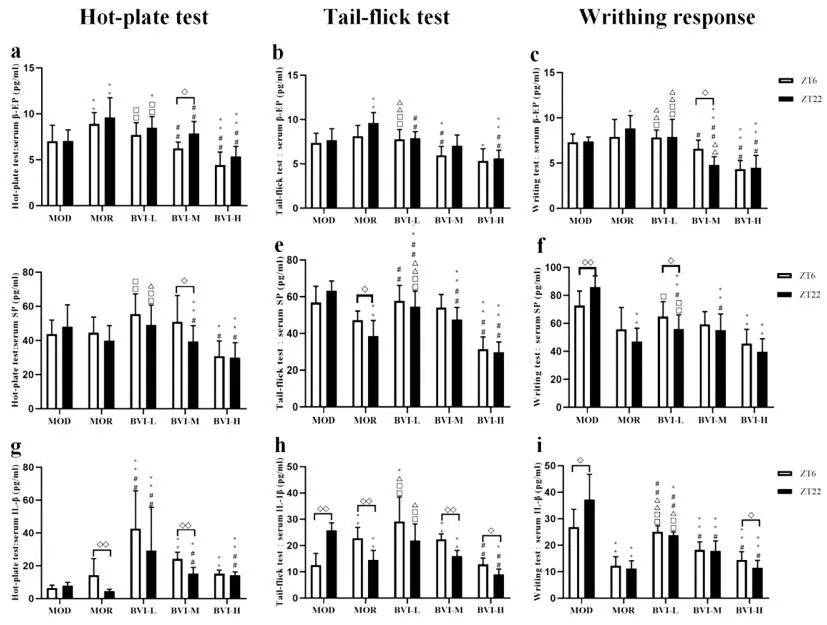
图5 BVI对3种疼痛模型小鼠血清β-EP、SP和IL-1β水平影响的昼夜差异
2.3.2BVI对疼痛模型小鼠血清SP水平影响的昼夜差异:由图5(d-e-f)可见,在热板法、辐射热甩尾法和扭体法三种疼痛模型中,吗啡和注射用蜂毒均可下调血清SP含量,且显示出ZT22给药低于ZT6给药的昼夜变化趋势(P<0.05)。同时,注射用蜂毒对疼痛模型小鼠血清SP含量的下调效应在热板法和扭体法呈现出一定的量-效关系(P<0.05~0.01)。
2.3.3BVI对疼痛模型小鼠血清IL-1β水平影响的昼夜差异:由图5(g-h-i)可见, 在热板法疼痛模型中,注射用蜂毒和吗啡用药组血清促炎细胞因子IL-1β水平较模型组明显增高,而注射用蜂毒随剂量增加其IL-1β水平呈现下降趋势;在辐射热疼痛模型中,注射用蜂毒和吗啡均显示ZT6给药血清IL-1β水平较模型组增高(BVI-H组除外),而ZT22给药组血清IL-1β水平则较模型组明显降低(P<0.05);在扭体法疼痛模型中,模型组小鼠的血清IL-1β水平显著增高,注射用蜂毒和吗啡给药组对血清IL-1β水平具有显著的下调作用(P<0.05~0.01)。
蜂毒对疼痛模型小鼠血清β-EP水平未显示上调作用;但可明显降低血清SP含量,且具有ZT22给药低于ZT6给药的昼夜变化(P<0.05);对扭体法和辐射热法(仅ZT22给药组)疼痛模型小鼠血清IL-1β水平显著下调,而在热板法则显示IL-1β水平明显增高。
3 讨 论
几乎所有的生物系统及其过程都显示出昼夜节律,疼痛行为和阿片类处理系统也受到生物钟的调节[5]。一系列关于啮齿类动物疼痛昼夜节律的研究表明,动物在其活动期内(夜间)出现出对疼痛的高敏感性[6]。刘晓平等[7]用热板法及压尾法对小鼠进行痛阈昼夜变化分析,结果提示小鼠对疼痛反应的峰值在暗后期(痛阈谷值),谷值在明后期(痛阈峰值)。本研究采用热板法和辐射热甩尾法对昆明小鼠痛阈的昼夜变化分析显示:小鼠痛阈存在昼夜节律,其峰值在明中期,谷值在暗后期。该研究结果与国内外相关研究结论基本一致。
目前,临床上针对疼痛的干预多为对症治疗,考虑维持镇痛药的血药浓度,每天需多次给药。但是,这种用药方法忽视了疾病节律变化的特殊性和药物疗效的时相性,在一定程度上影响镇痛效果以及副作用的发生。现代研究提示,基于疼痛的昼夜变化择时给药有助于提高镇痛效果。Yoshida M[8]通过小鼠实验证实,吗啡的镇痛效应存在昼夜节律,暗期镇痛作用明显大于明期。Kusunose等[9]采用神经病理性疼痛小鼠模型阐明了加巴喷丁抗异常性疼痛作用的剂量时间依赖性的分子基础:加巴喷丁通过阻断电压门控钙通道α2δ-1亚单位而发挥镇痛作用,根据该蛋白质水平24h节律的时间疗法可最有效地缓解小鼠的异常性疼痛。本研究发现,尽管给药剂量相同,但给药时间不同则镇痛效果具有明显差异:MOR和BVI在热板法、辐射热法和扭体法3种小鼠疼痛模型的镇痛作用均存在昼夜时间依赖性,于ZT22给药比ZT6给药呈现更显著的镇痛效应。此外,本研究结果还提示:吗啡镇痛起效快但维持时间短,而蜂毒则起效慢但维持时间长。
研究提示,某些外周血生物标志物与疼痛相关[10]。本研究通过分析疼痛模型小鼠血清P物质、β-内啡肽和IL-1β水平发现,P物质和IL-1β作为内源性致痛物质,其血清水平存在昼夜变化,在小鼠活动期(暗期)高于静止期(明期);BVI对多种疼痛模型小鼠血清P物质以及扭体法、辐射热法IL-1β具有下调作用,且具有一定昼夜变化趋势。β-内啡肽作为内源性镇痛物质,与局部组织受体结合发挥外周镇痛作用。本实验发现MOR对外周血β-EP具有上调效应并显示一定的昼夜变化趋势;但BVI随着剂量的增加,β-EP水平反呈下降趋势。与本研究结果相似,国内外多项针刺镇痛研究也发现针刺后外周血β-EP 水平不变或下降,分析认为可能由于疼痛缓解而导致具有镇痛作用的外周β-内啡肽水平下降[11]。此外,鉴于蜂毒肽可刺激离体大鼠腺垂体释放β-内啡肽,推测注射用蜂毒也通过影响中枢β-EP水平而发挥镇痛效应,尚需要进一步研究。
相关研究显示,蜂毒不仅具有镇痛、抗炎等作用,同时可能还具有急性促炎和促伤害性[12]。Raghuraman H等[13]研究发现,高剂量蜂毒肽会引起瘙痒、局部疼痛等症状。本实验中,对热板法模型小鼠应用注射用蜂毒后血清IL-1β水平增高,便可能与其蜂毒肽等成分的致炎等伤害反应有关,需要进一步分析。
综上所述,本研究结果提示:小鼠疼痛模型的痛阈具有显著的昼夜节律;注射用蜂毒的镇痛作用显示昼夜时间依赖性,提示了蜂毒时间疗法可能具有增效作用。值得注意的是,人类在正常状态和疾病状态下对疼痛的敏感性存在差异。研究发现,健康人群的疼痛敏感性具有峰值在活动期结束时和夜间的昼夜节律;而在疾病状态下,人类疼痛敏感性的峰值和谷值在不同疾病间差异显著。因此,为了确定包括蜂毒在内的镇痛药物治疗的准确时间,还有赖于对生物钟和疾病之间联系,以及疼痛和昼夜节律之间相互作用的进一步深入研究。
