高脂肪饮食促进TLR2的表达促进3T3L1脂肪细胞分泌IFN-γ诱导胰岛素抵抗的发生及发展
2024-04-07白继昌谈力欣刘赞朝朱亚军
白继昌, 谈力欣, 刘赞朝, 杨 洋, 朱亚军
(1.河北省石家庄市第二医院, 河北 石家庄 050000 2.河北省人民医院内分泌科, 河北 石家庄 050000)
脂肪细胞通过调节细胞因子分泌在脂肪和葡萄糖代谢中发挥重要作用。脂肪细胞中细胞因子分泌调节的紊乱被认为是代谢综合征的发病机制[1]。此外,内脏区域脂肪细胞的过度积累与肿瘤坏死因子α ( tumor necrosis factor a,TNF-α )的表达升高有关。与内脏脂肪堆积相关的脂肪细胞对细胞因子产生的异常调节似乎导致了代谢综合征中的血脂紊乱、高血压和葡萄糖不耐受。脂肪细胞的大小根据代谢条件而变化。这种特征实际上似乎是肥胖和代谢综合征发病机制的一个因素。这些细胞大小的变化伴随着甘油三酯合成、游离脂肪酸(FFA)产生和细胞因子产生的变化。较大的脂肪细胞倾向于分泌细胞因子IFN-γ和抵抗素,较小的脂肪细胞分泌脂联素[2]。因此,脂肪细胞的大小似乎是脂肪组织中细胞因子产生类型的组织学标志。研究表明,内脏脂肪的堆积而非皮下脂肪的堆积,是由于堆积的脂肪细胞分泌TNF-α增多而引起系统性胰岛素抵抗[3]。IFN-γ通过激活JAK/STAT途径减弱人类脂肪细胞中的胰岛素信号传导、脂质储存和分化[4]。因此,脂肪细胞根据脂肪组织的积聚位置调节细胞因子的产生,脂肪细胞的功能变化随后导致胰岛素抵抗。基因芯片分析发现,内脏区域聚集的脂肪细胞表达多种基因,尤其是蛋白酶基因家族,导致胰岛素抵抗的发生[5]。因此,了解积聚在内脏区域的脂肪细胞功能变化的潜在机制,了解分泌IFN-γ和其他细胞因子的细胞的特征是十分重要的。本研究的目的是确定哪些类型的脂肪细胞表达IFN-γ,并阐明内脏脂肪细胞功能变化与高脂肪摄入有关的机制。
1 材料与方法
1.1从小鼠脂肪组织中分离脂肪细胞:从8周龄开始,给予雄性C57 BL/6 J小鼠(Charles River,MA)正常饮食或含有20%蛋白质、20%碳水化合物和60%脂肪的高脂肪饮食(Research Diet,New Brunswick,NJ)。14d后处死两组小鼠,此时对照组平均体重为25.1g,高脂喂养组平均体重为28.3g。取附睾、肠系膜或皮下脂肪组织,称重,用磷酸盐缓冲盐水冲洗,切碎,在含有4%牛血清白蛋白(BSA)和1mg/mL I型胶原酶(NITTA GELATIN,Osaka,日本)的Krebs-Ringer磷酸盐缓冲液(pH7.4)中37℃消化60min。将消化的组织通过250μm尼龙网过滤以去除未消化的组织,并以400rpm离心4min。洗涤漂浮的脂肪细胞部分,并用70μm尼龙过滤器将大脂肪细胞与小脂肪细胞分离。
1.2细胞培养:3T3-L1细胞(American Type Culture Collection,美国)维持在含有25mM葡萄糖(DMEM-H)培养基(Sigma Chemicals,St.Louis,MO)的DMEM中,该培养基补充有10%胎牛血清(Gemini Bio Products,美国)和庆大霉素硫酸盐(Schering-Plough,美国),温度为37℃,湿度为5%CO2/95%空气。3T3-L1脂肪细胞参照前面描述的方法分化。
1.3酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA):将缺乏血清的3T3-L1脂肪细胞与由肉豆蔻酸盐和棕榈酸盐组成的FFAs混合物(Sigma Chemicals)或500μM Zymosan A(Wako Chemicals,Osaka,Japan)孵育,并根据制造商的说明书(BioLegend,美国)对培养基中的小鼠TNF-a进行测定。
1.4使用定量实时逆转录聚合酶链式反应(quantitative real-time reverse transcriptase-polymerase chain reaction ,RT-PCR)测量mRNA水平: 用ISOGEN(Nippon gene,日本)从附睾脂肪组织分离的脂肪细胞或3T3-L1脂肪细胞中分离总RNA。小鼠TLR2和TNF-a mRNA表达水平通过定量实时RT-PCR测定,基本上如前所述[6]。
1.5流式细胞仪分析:从脂肪组织中分离的脂肪细胞( 1×106个细胞)用4 %多聚甲醛固定,PBS洗涤。将固定的脂肪细胞与2μg鼠Toll样受体2 ( toll-like receptor 2,TLR2 )单克隆抗体偶联的藻红蛋白( PE ) ( e-bioscience,美国)在Hanks平衡盐溶液( HBSS )中室温避光孵育60min。然后将小鼠TNF-α多克隆抗体(Rockland Immunochemicals,美国)偶联异硫氰酸荧光素( FITC )与含有0.1 %皂甙( Wako chemicals,日本)的HBSS在室温下避光孵育脂肪细胞60min。细胞用PBS洗涤3次,用FACS流式细胞仪流式细胞仪( Becton-Dickinson )分析。使用与正常IgG缀合的PE或FITC孵育的细胞作为阴性对照。
1.6TLR2的siRNA敲除:用5nmoL TLR2 siRNA或Allstars阴性对照siRNA(Qiagen,德国)通过电穿孔转染3T3-L1脂肪细胞。处理后的细胞立即在37℃,湿度为5%CO2/95%空气。然后对细胞进处理。
1.7苏木精-伊红染色和免疫组化分析:石蜡包埋后,切片(4μm厚度)用苏木精-伊红染色。使用ImageJ软件计算胰岛的大小。用抗TLR2和IFN-γ的特异性抗体(Santa Cruz,美国)进行免疫组织化学染色,以检测脂肪组织中的炎症因子和胰岛素途径蛋白表达。使用链霉亲和素过氧化物酶组织染色SP试剂盒检测抗体反应性。免疫组化阳性染色定义为黄棕色。
1.8统计分析:本研究的数据以平均值±SE的形式表示。均值之间差异的显著性通过使用Statistica软件(Tulsa,OK)的单向或双向方差分析和不平衡设计的Tukey检验进行评估,或通过使用Statview软件(Abacus Concepts,Berkeley)的双尾不配对Student t检验进行评估。P<0.05被认为是具有显著性差异。
2 结 果
2.1高脂摄入小鼠附睾脂肪中脂肪细胞IFN-γ的表达与脂肪细胞肥大:为了解 IFN-γ基因表达与脂肪细胞肥大的关系,分析了高糖摄入对小鼠脂肪组织中 IFN-γ表达的影响。喂食高脂饮食2周的小鼠和喂食正常饮食的小鼠在口服葡萄糖负荷后血糖水平没有显著差异。胰岛素耐受试验表明,与对照组小鼠相比,喂食高脂肪饮食的小鼠胰岛素敏感性降低。(胰岛素负荷后30min,血糖水平分别为147.7±30.9mg/dL 和43.3±32.0mg/dL。)与正常组相比,高脂饮食组小鼠附睾脂肪组织中 IFN-γ mRNA 表达水平显著升高(图1A)。为了确定脂肪细胞中IFN-γ mRNA表达与其大小的关系,我们使用胶原酶处理,然后用2%四氧化锇固定,测量了从附睾脂肪垫分离的脂肪细胞的直径。喂食高糖的小鼠中的大脂肪细胞数量高于喂食正常饮食的小鼠(图1B)。我们通过尼龙网筛过滤将分离的漂浮脂肪细胞分为两组。小脂肪细胞被定义为直径<70μm,而大脂肪细胞则被定义为具有>70μm的直径。在喂食高脂肪饮食的小鼠中,两组细胞中的IFN-γ mRNA表达水平均增加(图1C)。一个值得注意的发现是,高脂肪摄入在较大脂肪细胞中的影响比在较小脂肪细胞中更明显。这些结果表明,高糖摄入诱导脂肪细胞,特别是大脂肪细胞中IFN-γ的表达。
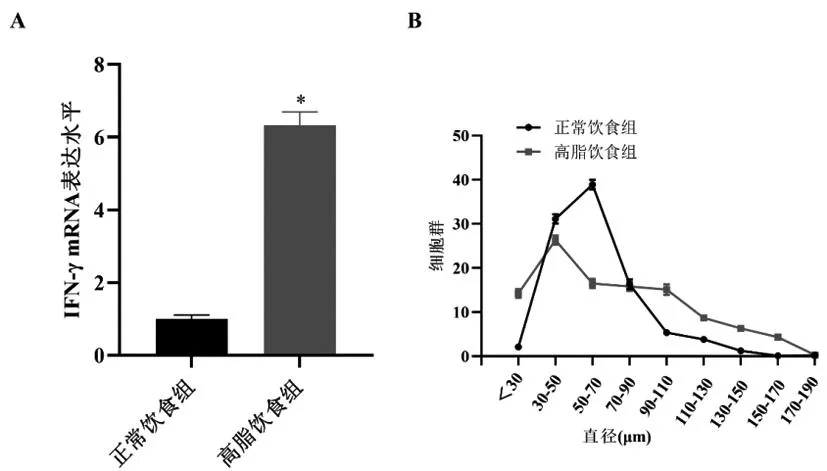
图1 附睾脂肪组织和脂肪细胞的细胞大小和IFN-γ mRNA表达。从正常饮食或高脂饮食喂养2周的小鼠中分离附睾脂肪组织。
2.2高脂肪饮食小鼠和正常饮食的小鼠在大脂肪细胞中基因表达谱的比较:为了阐明高脂肪摄入诱导分离脂肪细胞中IFN-γ表达的机制,我们使用微阵列分析了高脂肪饮食小鼠和正常饮食小鼠的大脂肪细胞的基因表达谱。对喂食高脂肪饮食的小鼠脂肪细胞中表达显著增加的560个基因进行了进一步分析(图2)。在这些基因中,我们关注TLR2基因,因为它对免疫细胞中IFN-γ mRNA表达的影响[9]。为了确定TLR2表达对分离的脂肪细胞中IFN-γ表达的影响,我们使用流式细胞术来检测表达TLR2或IFN-γ的脂肪细胞的数量。在喂食正常饮食的小鼠的附睾脂肪组织中检测到表达TLR2的脂肪细胞。我们还观察到,在喂食高脂肪饮食的小鼠中,脂肪细胞的数量急剧增加(图3A)。在高脂肪摄入的小鼠中,表达IFN-γ的细胞数量也显著增加(图3B)。因此,我们试图确定表达TLR2的细胞是否也表达IFN-γ。流式细胞术分析清楚地检测到在所有小鼠中存在TLR2/IFN-γ共表达的脂肪细胞;然而,在高脂肪摄入的小鼠中,这些双阳性脂肪细胞的数量急剧增加(图3C-E)。因此,我们确定了TLR2和IFN-γ共表达的脂肪细胞的数量在小鼠中通过高脂肪摄入而增加。

图2 正常饮食和高脂饮食喂养小鼠脂肪细胞中的差异表达基因
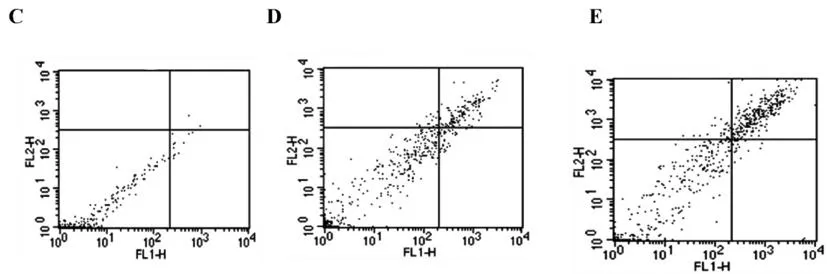
图3 流式细胞术分析正常或高脂饮食小鼠附睾脂肪组织中表达TLR2 / IFN-γ的脂肪细胞。
从正常或高脂饮食喂养2周的小鼠中收集附睾脂肪组织,随后分离脂肪细胞。脂肪细胞用4 %多聚甲醛固定,用PE标记的抗小鼠TLR2抗体( FL2-H )和抗小鼠TIFN-γ抗体孵育,然后用FITC标记的二抗( FL1-H )染色。从附睾脂肪组织制备的脂肪细胞暴露于PE偶联的抗小鼠TLR2抗体( A )或抗小鼠INF-γ抗体,然后用FITC连接的二抗染色( B )。(C)将从喂食高脂肪饮食的小鼠制备的脂肪细胞暴露于PE缀合的抗兔正常IgG,然后用FITC连接的第二抗体染色作为阴性对照。来自喂食正常饮食(D)或高脂肪饮食(E)的小鼠的脂肪细胞暴露于PE缀合的抗小鼠TLR2抗体和抗小鼠IFN-γ抗体,然后用FITC连接的二抗体染色。
2.3TLR2/IFN-γ阳性脂肪细胞主要存在于内脏脂肪组织中:我们还检测了不同类型脂肪组织中TLR2/IFN-γ阳性脂肪细胞的比例(表1)。在附睾和肠系膜脂肪组织中,TLR2 / IFN-γ阳性脂肪细胞的比例分别为脂肪细胞总数的7.0 %和7.7 %。皮下脂肪中TLR2/ IFN-γ阳性脂肪细胞的比例较低(2.0%)。高脂肪饮食使附睾和肠系膜脂肪中TLR2/ IFN-γ阳性脂肪细胞分别增加到26.9%和18.5%。但皮下脂肪( 1.2 % )中双阳性脂肪细胞比例无明显变化。这些结果表明,TLR2 / IFN-γ阳性脂肪细胞主要存在于内脏脂肪中,其数量随着高脂摄入而增加。

表1 在正常饮食和高脂饮食小鼠的不同脂肪组织中共表达TLR2和IFN-γ的脂肪细胞的数量
2.4高脂肪饮食对小鼠胰腺功能及炎症反应的影响:H&E结果显示,与正常饮食小鼠相比,高脂饮食组小鼠的胰岛大小和空泡化有代偿性增加(图4A)。与正常饮食小鼠相比,高脂饮食诱导小鼠的胰岛面积显著增加(图4B)。免疫组织化学结果显示,与正常饮食小鼠相比,高脂饮食小鼠脂肪组织中TLR2和 IFN-γ的表达显著提高(图4C-D)。
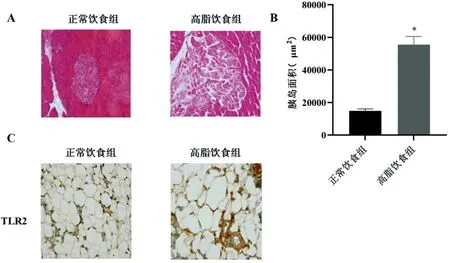
图4 高脂肪饮食对小鼠胰腺功能及炎症反应的影响
2.5FFAs诱导TLR2 mRNA表达,TLR2激动剂诱导3T3-L1脂肪细胞分泌IFN-γ:与喂食正常饮食的小鼠相比,喂食高脂肪饮食的小鼠的血浆FFA水平增加(图5A)。为了确定TLR2表达是否有助于脂肪细胞中IFN-γ的表达,我们检测了FFA水平对3T3-L1脂肪细胞中TLR2表达与IFN-γ表达的影响。用棕榈酸盐和肉豆蔻酸盐的混合物处理以时间依赖的方式诱导3T3-L1脂肪细胞中TLR2 mRNA的表达(图5B)。用已知的TLR2激活剂Zymosan A处理也诱导3T3-L1脂肪细胞分泌IFN-γ(图5C)。为了分析TLR2表达对FFA诱导的IFN-γ表达的影响,我们通过用TLR2特异性siRNA预处理3T3L1脂肪细胞来敲低TLR2途径。在用对照siRNA转染的3T3-L1脂肪细胞中,FFAs诱导IFN-γ mRNA表达增加三倍。用TLR2特异性siRNA处理使FFA诱导的IFN-γ mRNA表达水平降低40%(图5D)。因此,我们得出结论,TLR2的表达通过培养的脂肪细胞中的受体激活引起IFN-γ的表达。
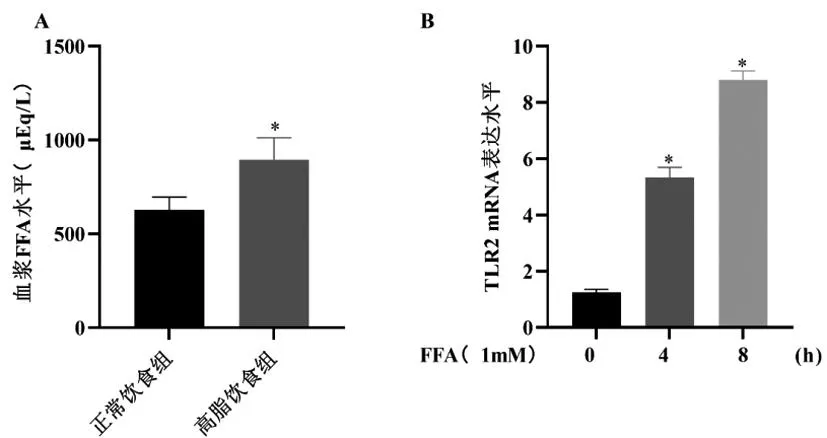
图5 FFA诱导3T3-L1脂肪细胞中TLR2和IFN-γ的表达
3 讨 论
本研究的目的是了解小鼠脂肪细胞在高脂肪摄入导致胰岛素抵抗过程中的表型变化。本研究进行了微阵列分析,以全面比较喂食高脂肪饮食或正常饮食的小鼠中脂肪细胞的基因表达模式。本研究结果表明,TLR2和IFN-γ基因在高脂饮食的小鼠脂肪细胞中高度表达。流式细胞术分析鉴定出一组同时表达TLR2和IFN-γ蛋白的脂肪细胞。在喂食高脂肪饮食的小鼠中,共表达TLR2和IFN-γ的脂肪细胞的数量显著增加。附睾和肠系膜脂肪组织中共表达TLR2和IFN-γ的脂肪细胞数量也显著高于皮下脂肪组织。在3T3-L1脂肪细胞中,FFA(棕榈酸盐和肉豆蔻酸盐的混合物)诱导TLR2和IFN-γ mRNA表达,而TLR2特异性siRNA抑制FFA诱导的IFN-γ mRNA的表达。
脂肪细胞分泌多种细胞因子,参与调节葡萄糖和脂质稳态。肥胖个体的脂肪细胞表现出分泌功能的改变,从而导致更高水平的细胞因子或促炎分子(包括TNFa、白细胞介素-6、血管紧张素原和抵抗素)的释放[7-8]。此外, Wada T等研究指出,Ⅰ型和Ⅱ型IFN通过诱导不同的SOCS亚型诱导胰岛素抵抗,IL-6通过增强STAT3介导的3T3-L1脂肪细胞中SOCS3的诱导而协同增强IFN-γ诱导的胰岛素抵抗[9]。因此,我们重点研究了高脂肪摄入和脂肪细胞中IFN-γ表达之间的关系,以阐明IFN-γ在积聚的内脏脂肪组织中表与喂食正常饮食的小鼠相比,喂食高脂肪饮食的小鼠中的大脂肪细胞和小脂肪细胞都表达更高水平的IFN-γ mRNA。先前已经表明,脂肪细胞肥大与胰岛素抵抗有关[10]。然而,脂肪细胞中TNFa基因的表达与胰岛素信号传导受损有关,而与脂肪细胞大小无关[11]。我们的研究结果表明,IFN-γ的表达在很大程度上取决于高脂肪摄入以及脂肪细胞肥大。微阵列分析表明,高脂肪饮食改变了大脂肪细胞中的各种基因。达诱导背后的机制。
除了IFN-γ表达外,喂食高脂肪饮食的小鼠的脂肪细胞中TLR2基因表达水平显著增加。由于TLRs在固有免疫和适应性免疫中的重要作用,其功能主要在免疫细胞中进行研究[12-13]。最近的研究表明,TLR2基因多态性的不同频率与胰岛素抵抗及其相关疾病的高风险显著相关[14]。这些观察结果以及我们的观察结果表明,脂肪组织中TLR2的表达可能与人类的胰岛素抵抗有关。棕榈酸酯是一种饱和脂肪酸,可激活TLR2并诱导促炎途径,导致肌管中的胰岛素抵抗[15]。在本研究中,发现FFA刺激显著增加了3T3-L1脂肪细胞中TLR2和IFN-γ mRNA的表达水平,并且脂肪细胞中的TLR2表达的敲低未能通过FFA增加IFN-γ基因的表达。因此,脂肪细胞中的TLR2信号被认为是由FFA激活的。健康受试者的FFA升高会短暂诱导胰岛素抵抗,肌肉细胞中的FFA暴露会通过NF-κB和蛋白激酶Cs激活炎症途径[16]。FFA水平的升高也可能激活脂肪细胞中的炎症途径,TLR2似乎通过诱导IFN-γ的产生来促进该途径。
在本研究中,初步鉴定了内脏脂肪组织中共表达IFN-γ和TLR2的脂肪细胞,并且脂肪细胞的数量因高脂肪摄入而增加。共表达IFN-γ和TLR2的脂肪细胞可能是脂肪组织中的“病理”细胞,参与代谢综合征中胰岛素抵抗的发展。细胞的进一步表征将提供关于脂肪细胞在胰岛素抵抗发病机制中的作用的重要信息。
