METTL3调控miR-126介导TGF-β/Smad信号通路影响糖尿病肾病的机制研究
2024-04-07帕提古丽阿斯讨拜
张 静, 任 荣, 帕提古丽·阿斯讨拜
(新疆医科大学第五附属医院肾病科, 新疆 乌鲁木齐 830011)
糖尿病肾病(Diabetic kidney disease,DKD)是糖尿病常见的微血管并发症,是世界范围内导致终末期肾病(end-stage renal disease,ESRD)的重要原因之一[1]。表观遗传因素在DKD的进展中起到重要作用[2]。N6-甲基腺苷(m6A)是最丰富的RNA内部修饰,甲基转移酶样3 (Methyltransferase-like 3,METTL3)构成 m6A甲基转移酶复合体的核心组分,负责催化 RNA 发生 m6A 修饰[3]。已有研究表明,METTL3参与DKD的进程[4]。进一步研究发现METTL3可以通过调控miRNA在DKD的发病机制中发挥重要作用[5]。其中miR-126参与了DKD的发生发展[6]。但关于METTL3与miR-126在DKD中的调控机制尚不明确。研究因此,本次研究拟通过建立糖尿病肾病大鼠模型,以METTL3为切入点,探讨METTL3调控miR-126影响糖尿病肾病发生发展的机制研究,为临床 DKD 的治疗提供新的思路。
1 材料与方法
1.1试验动物:SD大鼠,体重(300±20)g,雌雄各半,6~8周龄。动物来源湖北省实验动物中心。动物质量合格证编号:42000600048916,SCXK(鄂)2022-0065,伦理证明编号为202220159。
1.2试验试剂:尿素氮(BUN)含量检测试剂盒,Solarbio,中国;尿蛋白测试试剂盒,南京建成,中国;TGF-β1 ELISA试剂盒,Cusabio,中国;smad2抗体、smad3抗体、smad7抗体、METTL3抗体,Proteintech,中国;GAPDH,Bioswamp Goat anti-Rabbit IgG,Bioswamp,中国;TIANScript RT Kit,SuperReal PreMix Plus(SYBR Green),天根,中国;BCA蛋白浓度测定试剂盒,Solarbio,中国。
1.3方 法
1.3.1动物模型建立:大鼠适应性饲养一周,随机分为两组,模型组与对照组。对照组喂食正常饲料,模型组给与高脂饲料喂养4周,在第二周摘除左侧肾脏,注射青霉素防止感染。术后3周给与 30mg/kg STZ 腹腔注射,连续3d,诱导DKD。若FBG ≥ 16.7moL/L,则判断糖尿病模型制备成功;然后,继续高脂饲料喂养,4周后测定尿白蛋白,尿白蛋白≥30mg/24h 即判断DKD模型制备成功。
1.3.2动物分组及处理:将模型组大鼠按照随机数字法分为3组(每组8只):DKD组、DKD+siMETTLE3组和DKD+siMETTL3 NC组。siMETTL3 NC 组和siMETTL3组,尾静脉分别注射METTL3干扰对照慢病毒和METTL3干扰慢病毒,注射20μL,病毒滴度为 1×108TU/mL,每周注射1次,连续4周。对照组和模型组注射等量生理盐水。
1.3.3标本采集:在取材前收集尿液。心脏采血,静置30min后,以3000r/ min离心10min,分离血清后于-20℃保存。所有大鼠麻醉处死后,获得肾脏组织,0.9%氯化钠溶液中清洗后,一部分肾组织通过4%多聚甲醛固定,另一部分肾组织于-80℃保存。
1.3.4生化指标检测:采用生化检测方法测空腹血糖 (FBG)、尿素氮 (BUN)、24h尿蛋白(UTP)的水平。
1.3.5实时荧光定量PCR检测不同分组细胞中miR126相对表达量:设计miR-126的荧光定量PCR引物。miR-126 loop primer:GTCGTATCC-AGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGCGTACC,Forward primer:TGCGCCATTATTACTTTTGGT,Reverse primer:CCAGTGCAGGGTCC GAGG TATT;U6 Forward primer:CGCTTCGGCAGCACATATAC,Reverse primer:AAATATGGAACGC TTCACGA。加入4 × gDNA wiper Mix 4μL、RNA 2μg,RNAase-free Water加入至15μL,在42℃环境下进行2min的反应,继续加入5 × HiScript Ⅱ Select qRT SuperMix Ⅱ 4μL、Oligo (dT)23VN /mirna loop primer (10μM) 1μL,在温度为50℃环境下,进行15min的分离,再在85℃环境下进行5s的分离,随后将获取得到的逆转录产物cDNA置于冰上或冷藏备用。qPCR的反应试剂及步骤:Forward primer 10μM和Reverse primer 10μM各加入0.4μL,2XSYBR Select Master Mix (2×) 加入10μL,RNase-free water 加入4.8μL,cDNA template 加入4μL,50×ROX Reference Dye 2 加入0.4μL,配制成20μL 体系混合均匀。实时荧光定量PCR仪上设计反应参数,参数如下:95℃,10min,95℃,15s,60℃ 60s,95℃,15s,40个循环。使用2-ΔΔCt方法统计分析qPCR结果。
1.3.6Western blot检测METTL3、smad2、smad3、smad7的蛋白表达情况:将不同分组组织裂解、离心、BCA定量后,检测METTL3、smad2、smad3、smad7的蛋白表达。方法:配置5%浓缩胶和12%分离胶、样本变性加样、电泳和转膜,将膜装入 5% TBST封闭液,制置室温摇床2h,加5mL一抗稀释液,4℃过夜。10mL二抗 ( 1∶1000稀释 ) 置于摇床上2h。显色于暗室中压片曝光显影。结果用BandScan分析胶片灰度值,分别计算检测蛋白条带与参比蛋白条带强度比值( % )。
1.3.7ELISA检测血清中TGF-β1表达:实验开始前,组织匀浆,取上清。分别设标准孔和样品孔,每孔加入相应标准品50μL;待测样本孔中先加入样本稀释液40μL,再加入待测样本10μL。37℃温育30min。每孔中加入检测抗体50μL,充分混匀,37℃温育30min。每孔加显色剂A 50μL,显色剂B 50μL,振荡混匀后,37℃避光显色10min,每孔加终止液50μL。用酶标仪在450nm波长测量各孔的光密度(OD值)。

2 结 果
2.1各组大鼠体重、血糖、尿蛋白、尿素氮的变化:大鼠血糖结果显示,DKD组的大鼠血糖水平、尿素氮、24h尿蛋白含量高于Control组,差异有统计学意义(P<0.05);DKD+siMETTL3的血糖水平、尿素氮、24h尿蛋白含量低于DKD组,差异有统计学意义(P<0.05)。大鼠体质量结果显示,DKD组的体质量低于Control组,差异有统计学意义(P<0.05);DKD+ siMETTL3组的大鼠体质量高于DKD组,差异有统计学意义(P<0.05)。见图1。
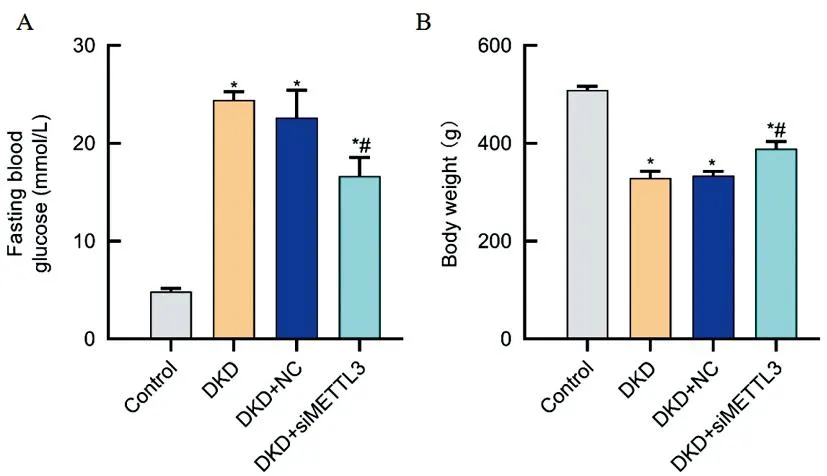
图1 各组大鼠体重、血糖、尿蛋白、BUN的变化
2.2各组大鼠miR-126表达水平的比较:实时荧光定量PCR结果显示,DKD组的miR-126的表达水平低于Control组,差异有统计学意义(P<0.05);DKD+siMETTL3组的miR-126的表达水平高于DKD组,差异有统计学意义(P<0.05),见图2。
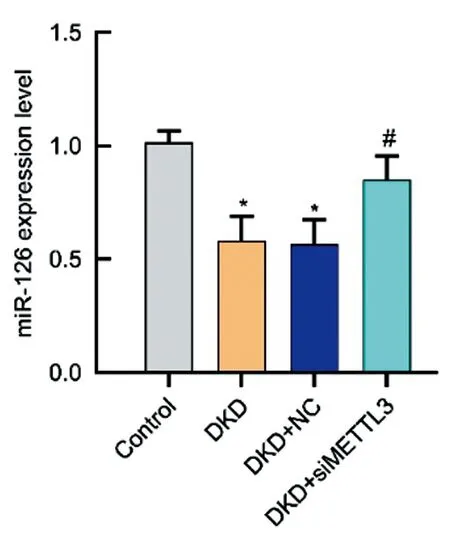
图2 各组大鼠miR-126表达水平的比较
2.3各组大鼠TGF-β、METTLE3、smad2、smad3、smad7表达水平的比较:采用ELISA检测不同分组中TGF-β,Western blot检测不同分组中METTLE3、smad2、smad3、smad7的蛋白表达。实验结果显示DKD组的TGF-β、METTLE3、smad2、smad3的表达水平高于Control组,smad7的表达水平低于Control组,差异有统计学意义(P<0.05);DKD+siMETTL3组的TGF-β、METTLE3、smad2、smad3的表达水平低于DKD组,smad7的表达水平高于DKD组,差异有统计学意义(P<0.05),见图3A-F。

图3 各组大鼠TGF-β、METTLE3、smad2、smad3、smad7表达水平的比较
3 讨 论
m6A修饰是由m6A WER(“writer”,“Erasers”和“Readers”)蛋白介导的动态可逆修饰过程,可以影响几乎所有类型肾细胞的生物学功能,参与DKD的发生发展[7]。METTL3是一类writer蛋白,在糖尿病肾病患者肾活检足细胞中升高,并与肾损伤相关[8]。敲除METTL3可显著降低高糖诱导的足细胞炎症和凋亡。本研究发现,DKD大鼠肾脏组织中METTL3的表达水平显著升高,通过siRNA干扰后,METTL3的表达水平降低。同时研究发现,DKD组的血糖、尿素氮、24h尿蛋白含量显著升高,体质量降低。这与袁瑾的研究结果一致[9]。通过siRNA干扰后,可以显著降低血糖、尿素氮、24h尿蛋白,提高大鼠体质量。表明糖尿病肾病可促进肾脏组织中METTL3的表达,METTL3也可以对糖尿病肾病发挥调控功能。
进一步研究发现,miRNA可被METTL3介导的m6A修饰调控,影响miRNA的稳态[10]。已知,METTL3的异常表达可以调控miRNA的成熟进程,进而调控miRNA的表达水平,影响疾病的发生发展[11]。前期研究发现在高糖细胞模型中METTL3可以调控miR-126的表达水平,但在DKD动物水平两者之间的调控关系尚不清楚[6]。本研究发现,在DKD大鼠肾脏组织中miR-126的表达水平显著降低,干扰METTL3后,miR-126的表达水平显著升高。表明了METTL3可以在DKD大鼠模型中调控miR-126的表达影响疾病的进展。
肾脏纤维化是DKD发生发展的主要病理特征及核心事件[12]。转化生长因子-β1 (TGF-β1)是DKD纤维化的关键调控因子,TGF-β1的过表达可以激活下游效应Smad通路,刺激肾小球和肾小管细胞上皮间充质转化、细胞外基质(ECM)的沉积,促进肾脏纤维化,影响肾功能。本研究发现,DKD诱导TGF-β1、smad2、smad3,抑制smad7的表达。通过siRNA干扰后,发生回复。Smad2和smad3是促纤维化因子,而smad7是抗纤维化因子。故本次研究结果表明,抑制METTL3可以有效的抑制DKD肾脏组织的纤维化。
综上所述,在DKD中METTL3高表达,干扰METTL3可以促进miR-126的表达活性,抑制TGF-β/smad通路,改善病理特征,缓解DKD的进展,这为DKD的机制研究提供了新的方向。
