WNT3A结合并稳定FZD2激活Wnt通路促进成骨细胞增殖和分化的分子机制研究
2024-04-07崔永建王巧梅
崔永建, 李 艳, 王巧梅, 唐 庆
(新疆医科大学第六附属医院, 新疆 乌鲁木齐 830002)
骨质疏松症(Osteoporosis,OP)的定义为髋部骨密度(bone mineral density,BMD)T评分为-2.5或更低[1]。OP(即“多孔骨”)会增加骨骼脆性和骨折的易感性。OP影响全球2亿女性,每年导致890多万例骨折。一半的绝经后妇女在其一生中发生过至少一次OP相关骨折[2]。尽管安慰剂对照试验表明,雷洛昔芬可减少妇女椎体骨折,但雌激素类似物治疗OP与脑血管意外和静脉血栓栓塞的风险增加有关,国际标准治疗指南因此建议不使用雌激素类似物[3]。而指南推荐的药物包括双膦酸盐、地诺单抗和特立帕肽等,与安慰剂组相比,可将骨折的相对风险降低至0.40~0.60。然而长期服用上述药物,仍存在不确定的潜在风险[4]。随着社会老龄化加剧,未来对更为安全有效、可长期服用以治疗OP预防骨折的新药物的需求持续增加。临床组织病理学能够观察到年龄相关性OP患者骨形成减少和骨髓脂肪积累增加。骨髓间充质干细胞向脂肪细胞分化而非向成骨细胞分化,在一定程度上导致了OP[5]。经典Wnt(the wingless/int1)信号通路促进成骨细胞分化和骨形成。Wnt信号通路的激活是由配体、受体和共受体的结合决定的。WNT3A等配体可与七次跨膜受体蛋白Frizzled(FZD)家族成员形成复合物,再结合单次跨膜共受体低密度脂蛋白受体相关蛋白5/6(low-density lipoprotein receptor-related protein 5/6,LRP5/6),以激活经典Wnt信号通路,并介导包括个体发育、成骨分化、骨形成等在内的多个过程[6]。WNT3A是多种潜在的、具有改善OP骨密度的药物的作用靶点。如冬凌草苷(oridonin)是一种改善免疫力、维持免疫系统平衡、改善组织微循环的中药有效化合物。它可通过上调WNT3A/β-catenin信号通路促进血管发生和骨组织供血,改善OVX小鼠骨密度[7]。FZD2是Frizzled(FZD)家族成员,是一种重要的Wnt信号通路受体蛋白。已报道的关于FZD2的病理生理学功能主要是激活经典Wnt/β-Catenin信号通路,介导肿瘤细胞上皮-间质转化等促进肿瘤发生、发展的过程。但最近研究发现FZD2杂合突变通过WNT经典和非经典信号通路两种方式导致人类胚胎肢体和颅面骨骼显性发育不良,这种遗传病被称为Robinow综合征和2型显性发育不良(OMOD2)。说明FZD2至少对于个体胚胎发育过程中的肢体发育至关重要[8]。然而FZD2的基因突变或表达下调是否参与骨质疏松症的致病机理,或者FZD2的表达可在治疗中发挥保护功效,尚未有深入研究。在本研究中,首先通过对雌二醇(17β-Estradiol,E2)治疗OVX诱导的OP小鼠模型后,其后肢胫骨中Wnt信号通路相关配体和受体表达水平的测定,探讨配体WNT3A通过稳定和激活FZD2增加成骨细胞骨形成的活性和分子机制。
1 材料与方法
1.1实验材料:24只雌性6~8周龄C57BL/6J小鼠,体质量23±2g,购自新疆医科大学实验动物中心。小鼠胚胎成骨细胞MC3T3-E1购自武汉普诺赛生命科技有限公司(中国)。腺病毒pADV-U6-shRNA-CMV-EGFP载体购自上海和元生物(中国),腺病毒颗粒包装也委托其代为完成。shRNA-FZD2和shRNA-NT由上海生工生物(中国)设计和合成。一抗:抗WNT3A多抗(货号PA5-87468)、抗FZD2多抗(货号38-4700)、抗Active-β-Catenin和β-Catenin多抗(货号71-2700)、抗ALP多抗(货号PA5-106391)、抗Runx2多抗(货号PA5-82787)、抗磷酸化(phospho-,p-)STAT3单抗(货号12-9033-42)、抗STAT3多抗(货号PA5-84386)、抗p-JAK2 (Tyr119)多抗(货号PA5-105889)、抗JAK2多抗(货号44-406G)、抗泛素(ubiquitin,Ub)多抗(货号PA3-16717)和抗β-actin多抗(货号PA5-78715)购自Thermo Fisher Scientific(美国)。山羊抗兔IgG二抗(货号XY0650)购自上海信裕生物(中国)。Cell Counting Kit-8(CCK-8)细胞增殖能力测定试剂盒(货号KTC011001)湖北艾美捷生物科技有限公司(中国)。
1.2方 法
1.2.1实验动物:C57BL/6J小鼠饲养于22±3℃恒温、45%~65%恒湿、配备12h/12h光照/黑暗循环的SPF级实验动物房。小鼠喂食标准啮齿类饲料,可以自由取食和饮水。每6只小鼠一个鼠笼。对小鼠实施OVX诱导OP之前,先适应性饲养一周。所有动物实验均经我院伦理委员会批准。
1.2.2双侧卵巢摘除术(OVX)诱导建立OP小鼠模型:小鼠手术前禁食12h。手术开始前对小鼠施以2%异氟烷麻醉。向小鼠皮下注射克林霉素(45μg/g体重)预防手术感染。将小鼠俯卧位置于37℃恒温加热垫上并固定,剔除背部毛发并消毒皮肤。用无菌手术刀在小鼠背部肋弓向下1cm的脊柱侧面1cm处切开一个切口,暴露腹腔。拨开性腺周围脂肪组织,找到卵巢,然后结扎双侧卵巢周围的血管并摘除双侧卵巢。逐层缝合伤口。假手术(Sham)组仅实施背部脊柱侧面切口和缝合。小鼠手术后连续3d向其饮用水中添加曲马多(25mg/L)进行镇痛。手术后监测小鼠死亡和恢复情况,并继续饲养7周诱导OP。
1.2.3动物实验分组和处理方式:24只小鼠随机分为4组,每组6只。对照(Control)组,对小鼠不做任何处理。假手术(Sham)组,仅对小鼠实施背部脊柱侧面切口和缝合。OVX组,对小鼠实施OVX并连续饲养7周诱导建立OP小鼠模型。OVX+E2 Treatment组,诱导建立OP小鼠模型后,腹腔注射给予小鼠雌二醇(E2)(10μg kg/day),连续治疗6周。结束后采用颈椎脱臼法处死小鼠。
1.2.4Western blot:处死小鼠,立即解剖获取小鼠左、右后肢胫骨,剔除肌肉和结缔组织,将胫骨浸没于EDTA溶液中,在4℃冷室中脱钙处理满2周。加入含蛋白酶抑制剂的RIPA裂解液,在液氮中研磨制备骨组织匀浆。在完成SDS-PAGE凝胶电泳和半干电转印后,使用5%脱脂奶粉对PVDF膜进行封闭,室温1h。向膜上滴加一抗工作液,4℃孵育过夜。次日,向膜上滴加二抗工作液,室温孵育1h。抗体工作液稀释度如下:抗WNT3A一抗(稀释度1∶1500)、FZD2一抗(稀释度1∶1000)、Active-β-Catenin和β-Catenin一抗(稀释度1∶1500)、ALP一抗(稀释度1∶2000)、Runx2一抗(稀释度1∶1500)、p-STAT3(稀释度1∶1000)、STAT3(稀释度1∶1500)、p-JAK2(稀释度1∶1000)、JAK2(稀释度1∶1500)和β-actin一抗(稀释度1∶2000);山羊抗兔IgG二抗(稀释度1∶8000)。使用超敏ECL化学发光液显影目的条带。
1.2.5细胞培养:MC3T3-E1细胞培养于添加10%胎牛血清的DMEM培养液中,置于37℃恒温、湿润、通入5% CO2的细胞孵育箱中维持培养。
1.2.6免疫共沉淀(co-Immunoprecipitation,co-IP):向处于指数生长期的MC3T3-E1细胞中加入WNT3A(5nmoL/L)处理6h,然后进行co-IP测定。使用冰预冷的PBS缓冲液洗涤细胞2次,然后加入免疫沉淀裂解缓冲液(20 mM Tris-HCl pH7.5,150 mM NaCl,1mM EDTA,10μM/mL 100×Halt蛋白酶,磷酸酶抑制剂混合物)裂解细胞。4℃,10,000 ×g离心5min,取上清液。加入偶联有抗IgG抗体(1μg)或抗泛素(ubiquitin,Ub)抗体(1μg)的Protein A-Sepharose至全细胞裂解物上清液中,置于4℃下缓慢搅拌孵育过夜。次日,向Protein A-Sepharose-蛋白质复合物沉淀中加入3×SDS样品缓冲液,在37℃下孵育5min解离蛋白质。然后使用抗FZD2抗体(稀释度1∶1000)或抗Ub抗体(稀释度1∶2000)或抗β-actin抗体(稀释度1∶1500)进行免疫印迹(Immuno blot,IB)检测。
1.2.7构建腺病毒-shRNA-FZD2载体和转染:使用腺病毒pADV-U6-shRNA-CMV-EGFP载体构建腺病毒-shRNA-FZD2载体或其对照组腺病毒-shRNA-NT载体。shRNA-FZD2:5’-CCTCATGAACAAGTTCGGTTT-3’,shRNA-NT:5’-CCGGCTCACTGGTCTCCACTC-3’。委托上海和元生物代为进行腺病毒颗粒包装。种2.5×105细胞于6孔板中,待其贴壁培养过夜。次日,向MC3T3-E1细胞中加入WNT3A(5nmoL/L)处理6h后,更换细胞培养液为含6μg/mL polybrene和腺病毒颗粒(1×109PFU /mL,10μL)(腺病毒-shRNA-FZD2或腺病毒-shRNA-NT)的新鲜培养液,处理细胞4h。再次更换回新鲜的含10%胎牛血清的完全DMEM培养液,连续培养48h后采用Western blot法测定其对FZD2的敲低效率。
1.2.8Cell Counting Kit-8(CCK-8)细胞增殖能力测定:使用CCK-8细胞增殖能力测定试剂盒进行测定。具体实验操作按照试剂盒说明书中的指导进行即可。
2 结 果
2.1E2治疗的OVX小鼠胫骨组织中WNT3A和FZD2水平均上调:如(图1A)所示,与Sham组相比,OVX组小鼠胫骨组织中WNT3A、FZD2、Active-β-Catenin、β-Catenin、ALP和Runx2表达水平均被下调(P<0.05);与OVX组相比,OVX+E2 Treatment组小鼠胫骨组织中上述蛋白因子的表达水平均被上调(P<0.05)。Sham组与Control组相比,小鼠胫骨组织中上述蛋白因子的表达水平无统计学差异(P>0.05)。
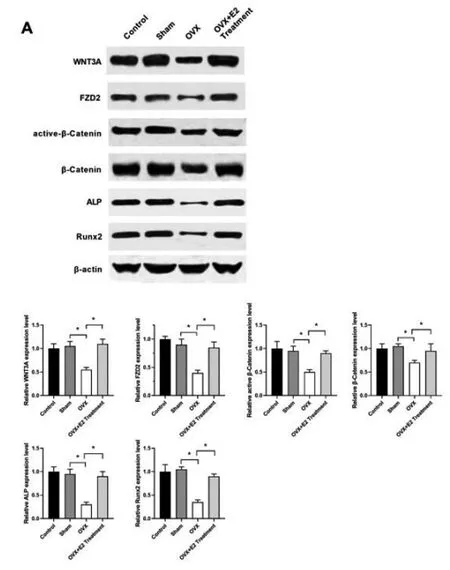
图1 小鼠胫骨组织中成骨分化相关蛋白因子表达水平测定
2.2WNT3A处理增加MC3T3-E1细胞中FZD2的表达并促进细胞增殖和分化:如(图2A)所示,与Control组相比,WNT3A Treatment组MC3T3-E1细胞中FZD2、Active-β-Catenin、β-Catenin、ALP和Runx2的表达水平均升高(P<0.05)。如(图2B)所示,与Control组相比,WNT3A Treatment组MC3T3-E1细胞增殖能力增强(P<0.05)。

图2 WNT3A处理后MC3T3-E1细胞中成骨分化相关蛋白因子表达水平测定。
2.3WNT3A处理增加MC3T3-E1细胞中FZD2的稳定性:如(图3A-左图和右图)所示,在Input对照组中,WNT3A处理(-/+)的MC3T3-E1细胞中FZD2和Ub的表达,IB检测均为阳性;且与WNT3A处理(-)的细胞相比,WNT3A处理(+)的细胞中FZD2的表达水平升高(P<0.05)。如(图3A-中图和右图)所示,在WNT3A处理(-)的IP:IgG对照组中FZD2和Ub的表达,IB检测均为阴性;在IP:Ub组中,与WNT3A处理(-)的细胞相比,WNT3A处理(+)的细胞中FZD2的表达水平升高(P<0.05)。
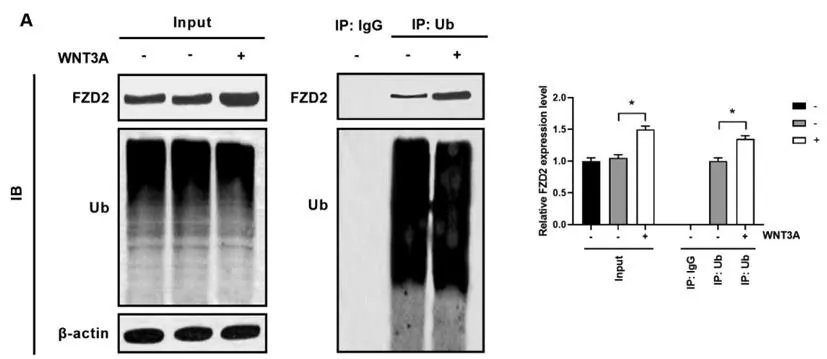
图3 对MC3T3-E1细胞给予WNT3A处理(-/+)后,免疫共沉淀检测FZD2和Ub的直接相互作用。
2.4敲低-FZD2抑制WNT3A处理引起的MC3T3-E1细胞向骨合成代谢方向分化:如(图4A)所示,与WNT3A Treatment组相比,WNT3A Treatment+Adv-shRNA-FZD2组FZD2、Active-β-Catenin、β-Catenin、ALP和Runx2的表达水平均降低(P<0.05)。与WNT3A Treatment+Adv-shRNA-FZD2组相比,WNT3A Treatment+Adv-shRNA-NT组上述蛋白因子表达水平均升高(P<0.05)。

图4 敲低FZD2后WNT3A处理的MC3T3-E1细胞中成骨分化相关蛋白因子表达水平测定。
2.5敲低-FZD2抑制WNT3A处理引起的MC3T3-E1细胞的增殖:如(图5A)所示,与WNT3A Treatment组相比,WNT3A Treatment+Adv-shRNA-FZD2组p-STAT3和p-JAK2的磷酸化水平均降低(P<0.05);而2组细胞中STAT3和JAK2的表达水平无统计学差异(P>0.05)。与WNT3A Treatment+Adv-shRNA-FZD2组相比,WNT3A Treatment+Adv-shRNA-NT组上述蛋白因子的磷酸化水平均升高(P<0.05);而2组细胞中STAT3和JAK2的表达水平无统计学差异(P>0.05)。如(图5B)所示,与WNT3A Treatment组相比,WNT3A Treatment+Adv-shRNA-FZD2组细胞增殖能力降低(P<0.05);与WNT3A Treatment+Adv-shRNA-FZD2组相比,WNT3A Treatment+Adv-shRNA-NT组细胞增殖能力增强(P<0.05)。
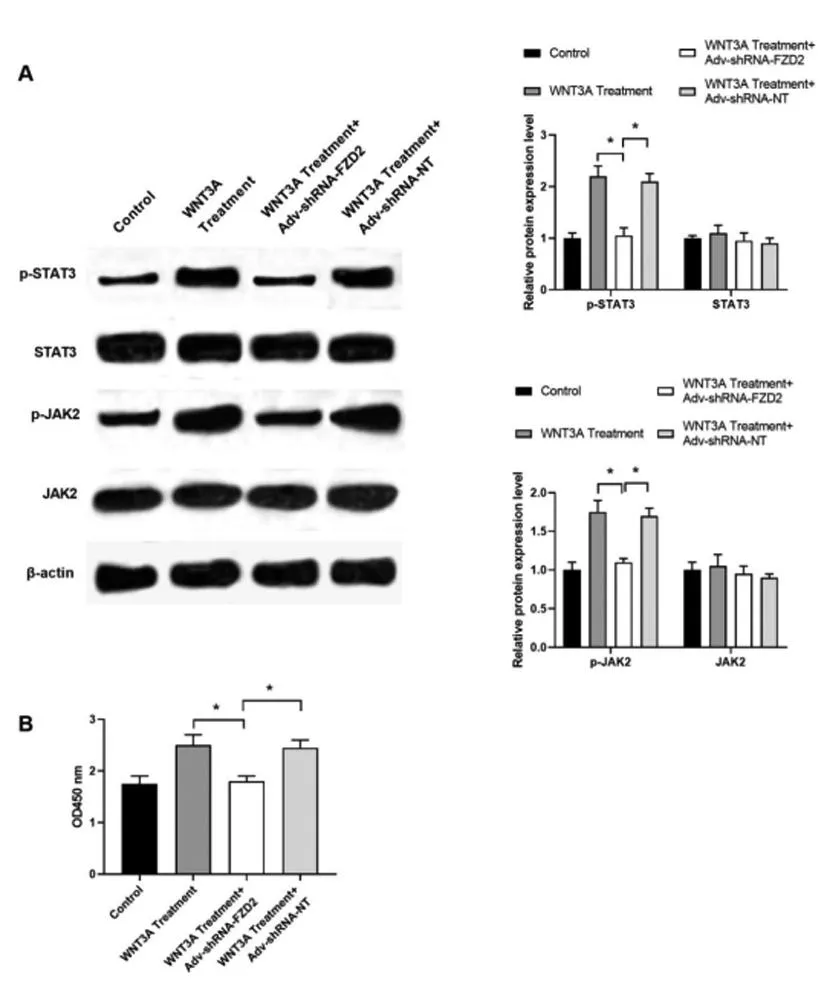
图5 敲低FZD2后WNT3A处理的MC3T3-E1细胞中细胞增殖相关信号和增殖能力测定。
3 讨 论
对于OP的治疗,目的是维持正常的骨量,其途径包括抑制骨吸收或促进骨合成代谢。目前,抑制骨吸收的药物种类较多,而促进骨合成代谢的药物较少,后者还有很多药物开发的策略有待深入探索。Wnt信号在决定骨髓间充质干细胞命运、增殖和分化中是必不可少的。Wnt信号包括经典的β-catenin依赖性信号(Wnt/β-catenin)和β-catenin非依赖性信号。其中Wnt/β-catenin信号通路是通过配体与一个7次跨膜卷曲蛋白(Frizzleds,FZDs)受体以及辅助受体LRP5/6结合,以阻止β-catenin的磷酸化和降解,从而激活β-catenin信号。未磷酸化并被激活的β-catenin将转运至细胞核中,决定MSCs的分化命运。许多证据表明,Wnt/β-catenin信号转导具有促成骨细胞前体细胞分化和抗脂肪细胞分化的作用。Wnt/β-catenin信号在维持骨量中起着关键作用。如Wnt/β-catenin信号通过激活成骨分化关键转录因子Runx2(runt-related transcription factor 2)/osterix(Sp7)促进MSCs向成骨细胞分化。与此同时,Wnt/β-catenin/Runx2也是抑制MSCs向脂肪细胞分化的关键信号。MSCs中Runx2表达缺失会引起PPARγ的表达上调并介导MSCs转为向脂肪细胞分化。出生后Runx2表达缺失将导致小鼠骨量降低和骨组织中脂肪细胞积累[9]。
WNT3A属于Wnt/β-catenin信号通路配体,促进骨形成。局部给予WNT3A治疗可恢复骨髓炎手术清创后大段骨缺损的骨再生。在绝经后OP小鼠模型中WNT3A参与改善骨重塑增强小鼠骨骼的机械负荷和血管生成[10]。说明WNT3A作为促进骨形成的配体,在改善骨密度方面具有显著效果。在本次研究结果中也显示,与Sham组相比,OVX小鼠模型(OVX组)WNT3A表达下调;而与OVX组相比,阳性治疗组(OVX+E2 Treatment组)中WNT3A表达被明显上调。FZDs是7次跨膜细胞表面受体,归属于G蛋白偶联受体超家族,并且与其他类别G蛋白偶联。FZDs被Wnt家族配体激活后,介导调控胚胎发育、干细胞分化、器官发生和模式形成等重要生理学过程[11]。并在维持成人机体组织稳态、再生、可塑性和修复中起着至关重要的作用[8]。哺乳动物具有10种FZDs,FZD2是其中一员。FZD2对于胚胎的肢体发育至关重要,FZD2基因杂合型点突变就可以显性方式致胚胎肢体和颅面骨骼发育缺陷[8]。之前未有报道在OP中FZD2的表达情况。而在本次研究结果中发现,与Sham组相比,OVX小鼠模型(OVX组)FZD2的表达水平被抑制;而与OVX组相比,阳性治疗组(OVX+E2 Treatment组)中FZD2的表达水平被明显增强。虽然这一结果尚未在OP患者低骨密度的骨骼中进行验证,但在OVX小鼠模型水平上发现了WNT3A和FZD2的这一特殊的表达模式。
ALP(Alkaline phosphatase,碱性磷酸酶)在矿化组织细胞中高度表达,在硬组织的形成中起着至关重要的作用。ALP增加无机磷酸盐在局部的沉积,促进矿化,并降低细胞外焦磷酸盐(骨骼矿化抑制剂)。骨骼矿化是羟基磷灰石晶体从增生性成骨细胞和软骨细胞的外膜萌发,在基质囊泡内产生,并在胶原原纤维之间积聚,参与形成骨骼细胞外基质。
在本研究结果中显示,与OVX组相比,OVX+E2 Treatment组小鼠胫骨组织中WNT3A、FZD2、Active-β-Catenin、Runx2和ALP表达水平均上调。说明WNT3A和FZD2参与了E2促进OP骨合成代谢的分子机制。更为重要的是,在本研究中发现配体WNT3A与FZD2结合并上调FZD2的水平可促进MC3T3-E1细胞的增殖和向骨合成代谢方向分化,上调Runx2和ALP。随后对这一过程的分子机制研究发现,WNT3A处理可稳定细胞中FZD2免于进入泛素化降解途径。可以看出WNT3A具有促进骨合成代谢的重要活性。但是在这些过程中,与此配体作用的关键受体仍未确定。在本研究中发现敲低FZD2抑制WNT3A处理引起的MC3T3-E1细胞的增殖和促骨合成代谢活性。这是一项重要的发现,由此可知介导配体WNT3A的促成骨分化活性和促骨合成代谢活性的重要细胞表面受体为FZD2。STAT3/JAK2信号是细胞重要的促存活、促增殖信号。敲低-FZD2抑制了WNT3A处理引起的MC3T3-E1细胞的增殖能力,以及p-STAT3和p-JAK2的磷酸化水平。这也进一步佐证了配体WNT3A是与FZD2结合后介导发挥其促进成骨细胞增殖和骨形成活性的。
总之,在本研究中虽然尚未深入探讨单纯过表达FZD2是否能够起到促进骨合成代谢的功效。但基于本研究目前的结果可知,WNT3A的促骨合成代谢活性是通过结合并稳定FZD2激活Wnt/β-Catenin信号通路实现的。
