TRIM25通过EZH2介导巨噬细胞M2极化促进食管鳞状细胞癌细胞的增殖迁移和侵袭
2024-04-07张诗彤田新春花海洋刘洪运
张诗彤, 田新春, 花海洋, 刘洪运
(承德医学院第二附属医院, 河北 承德 067000)
食管癌是常见癌症之一,其中,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)占据了所有食管癌患者的近九成,多数患者在确诊时已处于肿瘤晚期。尽管手术、化疗和放疗等技术不断进步,但ESCC患者的5年生存率仍然较低。饮酒、吸烟、贲门失弛缓症、种族和高淀粉饮食等是ESCC发生的危险因素,至今ESCC发生的具体机制尚不清楚[1]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肿瘤微环境(tumor microenvironment,TME)的重要组成部分,主要为M2表型。靶向抑制TAM浸润在阻止肿瘤发生和发展中具有重要作用[2]。含三联基元25(Tripartite Motif Containing 25,TRIM25)是TRIM家族成员之一,参与发育、细胞生长、分化、肿瘤和先天免疫反应等过程。研究结果显示,胃癌中TRIM25表达与巨噬细胞、B细胞和CD8+T细胞浸润密切相关[3]。目前,关于TRIM25与ESCC中巨噬细胞浸润的关系还尚未见报道。另有研究证据显示,ZEST2多梳抑制复合物2亚单位增强子(ehancer of zeste 2 polycomb repressive complex 2 subunit,EZH2)与巨噬细胞浸润呈正相关,其可能通过促进巨噬细胞活化,诱导乳腺癌细胞增殖、迁移和侵袭[4]。目前研究发现,TRIM25通过上调EZH2表达诱导大肠癌细胞奥沙利铂耐药[5]。然而,目前TRIM25 与EZH2调控关系及其作用在ESCC尚不清晰,寻求新的治疗靶点意义重大。因此,本研究旨在探讨ESCC细胞中TRIM25/EZH2轴对巨噬细胞M2极化的影响及其对ESCC细胞增殖、迁移和侵袭的作用,为明确ESCC发生与发展的分子机制和开发新的治疗靶点提供参考资料。
1 材料与方法
1.1细胞及主要试剂:正常人食管鳞状上皮细胞HET-1A、ESCC细胞KYSE510和急性单核细胞白血病细胞THP-1均购自美国ATCC。TRIM25特异性shRNA(sh-TRIM25)和shRNA阴性对照(sh-NC)、EZH2过表达载体(oe-EZH2)和过表达载体阴性对照(oe-NC)构建及对应的慢病毒包装均交由吉满生物科技上海有限公司完成。2×SYBR Green qPCR Master Mix购自美国Bimake生物科技有限公司,TRIM25、EZH2、Arg-1和APC-F4/80抗体均购自英国Abcam公司,放线菌酮购自美国Sigma公司,FITC-CD206抗体购自美国Santa Cruz公司,CCK-8试剂盒购自奥默生物技术(上海)有限公司。
1.2细胞培养、分组及慢病毒感染:HET-1A、KYSE510和THP-1细胞用含10% FBS的RPMI-1640培养基培养,待细胞密度长至80%时,胰酶消化细胞继续传代。待细胞生长至对数期,将THP-1细胞、KYSE510细胞分别接种于6孔板(1×106个/孔),培养过夜。将KYSE510细胞随机分为空白对照组(Ctrl组)、sh-NC组、sh-TRIM25组、sh-NC+oe-NC组、sh-TRIM25+oe-NC组、sh-NC+oe-EZH2组和sh-TRIM25+oe-EZH2组,用sh-NC、sh-TRIM25、oe-NC和oe-EZH2慢病毒液(MOI=20)分别感染上述KYSE510细胞。按照参考文献[9],向THP-1细胞中加入100ng/mL的佛波酯处理48h,诱导产生M0巨噬细胞。将M0巨噬细胞置于Transwell小室下室,上室接种上述各组转染处理的KYSE70细胞,培养24h后,收集共培养上清液,分别命名为TAM、sh-NC+TAM、sh-TRIM25+TAM、sh-NC+oe-NC+TAM、sh-TRIM25+oe-NC+TAM、sh-NC+ oe-EZH2+TAM和sh-TRIM25+oe-EZH2+TAM。收集共培养巨噬细胞,分别命名为Ctrl、sh-NC、sh-TRIM25、sh-NC+oe-NC、sh-TRIM25+oe-NC、sh-NC+oe-EZH2和sh-TRIM25+oe-EZH2。将KYSE510细胞接种于6孔板(1×106个/孔),培养过夜,弃去旧培养基,细胞分为Ctrl组、TAM组、sh-NC+TAM组、sh-TRIM25+TAM组、sh-NC+oe-NC+TAM组、sh-TRIM25+oe-NC+TAM组、sh-NC+oe-EZH2+TAM组和sh-TRIM25+oe-EZH2+TAM组,按照分组,将上述各组共培养上清液分别加入KYSE510细胞中。继续培养用于后续实验。
1.3qPCR法检测KYSE510细胞中TRIM25和EZH2 mRNA表达:收集KYSE510细胞,TRIzol法提取RNA并逆转录成cDNA。采用2×SYBR Green qPCR Master Mix进行qPCR实验。TRIM25引物序列:上游为5'-GTCTCTACCCAGAACAGTTTCC-3',下游为5'-ATCCAACACA GGCTGATTCC-3';EZH2引物序列:上游为5'-AATCAGAGTACATGCGACTGA GA-3',下游为5'-GCTGTATCCTTCGCTGTTTCC-3';GAPDH引物序列:上游为5'-GCCGGTGCTGAGTATGTC-3',下游为5'-CTTCTG GGTGGCAGTGAT。PCR反应条件:95℃ 10min;95℃ 15s,60℃ 30s,72℃ 10s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算TRIM25和EZH2 mRNA的相对表达量。
1.4WB法检测KYSE510细胞中TRIM25、EZH2和Arg-1蛋白表达:收集各组KYSE510细胞,经RIPA裂解液裂解后,收集细胞上清液进行SDS-PAGE、转膜,5%脱脂奶粉封闭2h,加入TRIM25抗体(1∶1 000)、EZH2抗体(1∶2 000)、Arg-1抗体(1∶1 000)和GAPDH抗体(1∶2 000),4℃孵育 12h。随后,特异性二抗(1∶5 000)作用1h,凝胶成像系统检测蛋白条带,并用ImageJ软件进行分析。
1.5放线菌酮(CHX)蛋白合成抑制实验检测KYSE510细胞中EZH2蛋白的表达:稳定表达sh-NC和sh-TRIM25的KYSE510细胞接种于6孔板(1×106个/孔),过夜培养后,更换培养基,并添加10μg/mL CHX。分别收集0、8、12和16h后的细胞样品,按照WB法检测细胞中EZH2蛋白表达。
1.6FCM检测F4/80+CD206+巨噬细胞比例:将KYSE510细胞与M0巨噬细胞的共培养,收集共培养巨噬细胞,用PBS将细胞密度调整为1×107个/mL,将细胞悬液转移至离心管,分别加入APC-F4/80抗体、FITC-CD206抗体,室温条件下避光处理30min。PBS清洗并重悬细胞,取细胞悬液,上FCM仪检测F4/80+CD206+巨噬细胞。
1.7CCK-8法检测KYSE510细胞的增殖活力:KYSE510细胞接种至96孔板(1×104个/孔),共培养上清液处理KYSE510细胞后,按照CCK-8试剂盒说明操作,酶标仪检测各孔细胞在450nm处的光密度(D)值。另设置空白组(未接种细胞)用作读值调零。细胞活力(%)=(实验组D值-空白组D值)/(对照组D值-空白组D值)×100%,或者是细胞活力(%)=(实验组D值-空白组D值)/(sh-NC+oe-NC+TAM组D值-空白组D值)×100%
1.8克隆形成实验检测KYSE510细胞的克隆形成能力:KYSE510细胞接种至培养皿(3×102个细胞/皿),共培养上清液处理KYSE510细胞,连续培养2周。弃去培养液,PBS清洗3次。经多聚甲醛固定,吉姆萨染色液染色,流水冲洗、干燥后,计算克隆形成数。
1.9Transwell实验检测KYSE510细胞的迁移和侵袭能力:无血清培养基重悬KYSE510细胞后,接种至Transwell小室的上室。Transwell小室的下室加入RPMI 1640培养基。过夜培养后,取出小室,经多聚甲醛固定,结晶紫染色液染色后,光学显微镜下观察细胞迁移情况。进行侵袭实验时,除使用预铺20%的matrigel胶Transwell小室外,其余实验方法同细胞迁移实验。

2 结 果
2.1KYSE510细胞中TRIM25和EZH2 mRNA与蛋白均高表达:qPCR法和WB法检测结果(图1)显示,与HET-1A组相比,KYSE510组细胞中TRIM25和EZH2 mRNA与蛋白表达水平均显著升高(t=6.32,P<0.01;t=5.98,P<0.01;t=6.15,P<0.01;t=5.85,P<0.01)。实验结果表明,TRIM25和EZH2 mRNA及蛋白在KYSE510细胞中高表达。
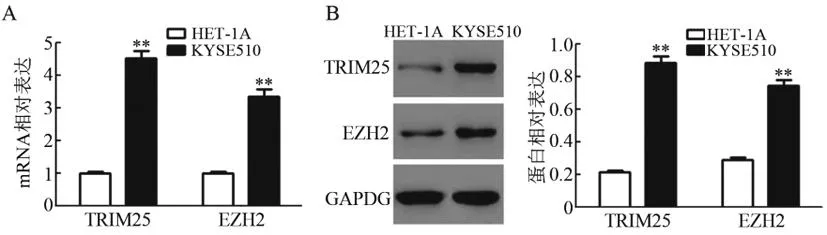
图1 食管癌KYSE510细胞中TRIM25和EZH2 mRNA(A)和蛋白(B)的表达
2.2KYSE510细胞中TRIM25对巨噬细胞M2极化的影响:qPCR法和WB法检测结果(图2)显示,与Ctrl组和sh-NC组相比,sh-TRIM25组KYSE510细胞中RIM25 mRNA和蛋白表达明显降低(LSD-t=5.73,P<0.01;LSD-t=5.65,P<0.01)。KYSE510细胞与M0巨噬细胞共培养后,FCM和WB法检测结果(图3)显示,与Ctrl组和sh-NC组相比,sh-TRIM25组巨噬细胞中F4/80+CD206+巨噬细胞比例和Arg-1蛋白表达明显降低(LSD-t=3.25,P<0.01;LSD-t=3.43,P<0.01)。
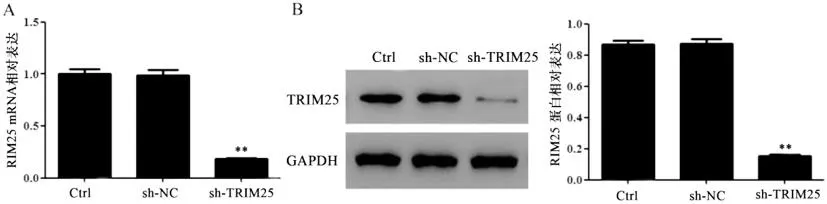
图2 qPCR法(A)和WB法(B)检测sh-TRIM25的敲低效率
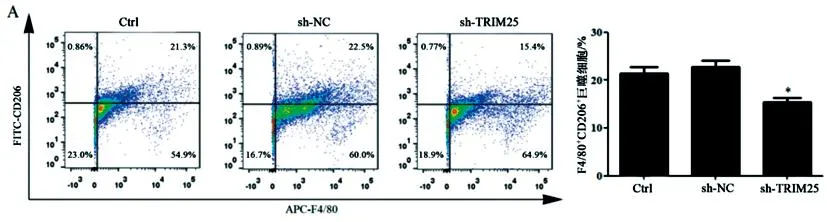
图3 FCM(A)和WB法(B)检测敲低TRIM25对巨噬细胞M2极化的影响
2.3TRIM25通过巨噬细胞M2极化对KYSE510细胞的影响:KYSE510细胞与M0巨噬细胞共培养上清液处理KYSE510细胞,CCK-8实验结果(图4)显示,与Ctrl组相比,TAM组KYSE510细胞活力、克隆形成数、迁移和侵袭细胞数均显著升高(LSD-t=3.85,P<0.05;LSD-t=4.12,P<0.05;LSD-t=3.20,P<0.05;LSD-t=3.31,P<0.05);TAM组和sh-NC+TAM组两组间KYSE510细胞活力、克隆形成数、迁移和侵袭细胞数差异无统计学意义(均P>0.05);与sh-NC+TAM组相比,sh-TRIM25+TAM组KYSE510细胞活力、克隆形成数、迁移和侵袭细胞数均显著降低(LSD-t=3.24,P<0.05;LSD-t=3.24,P<0.05;LSD-t=3.46,P<0.05;LSD-t=3.05,P<0.05;LSD-t=2.84,P<0.05)。

图4 TRIM25通过巨噬细胞M2极化对KYSE510细胞的影响
2.4TRIM25介导EZH2蛋白稳定性:qPCR法和WB法检测结果(图5)显示,与Ctrl组和sh-NC组相比,sh-TRIM25组KYSE510细胞中EZH2蛋白表达显著降低(LSD-t=4.62,P<0.05;LSD-t=4.71,P<0.05)。经CHX处理后,与sh-NC组相比,sh-TRIM25组KYSE510细胞中EZH2蛋白半衰期显著降低(LSD-t=4.12,P<0.05;LSD-t=5.12,P<0.01)。

图5 TRIM25介导EZH2蛋白的稳定性
2.5KYSE510细胞中TRIM25/EZH2轴对巨噬细胞M2极化的影响:WB法检测结果(图6)显示,与sh-NC+oe-NC组相比,sh-TRIM25+oe-NC组KYSE510细胞中TRIM25和EZH2蛋白表达均显著降低(LSD-t=6.89,P<0.01;LSD-t=5.68,P<0.01),sh-NC+oe-EZH2组KYSE510细胞中EZH2蛋白表达显著升高(P<0.01),而TRIM25蛋白表达差异无统计学意义(P>0.05);与sh-TRIM25+oe-NC组相比,sh-TRIM25+oe-EZH2组KYSE510细胞中EZH2蛋白表达显著升高(LSD-t=5.25,P<0.01),TRIM25蛋白表达差异无统计学意义(P>0.05)。KYSE510细胞与M0巨噬细胞共培养,FCM和WB法检测结果(图7)显示,与sh-NC+oe-NC组相比,sh-TRIM25+oe-NC组巨噬细胞中F4/80+CD206+巨噬细胞比例和Arg-1蛋白表达均显著降低(LSD-t=4.15,P<0.05,LSD-t=4.62,P<0.05),sh-NC+oe-EZH2组巨噬细胞中F4/80+CD206+巨噬细胞比例和Arg-1蛋白表达均显著升高(LSD-t=4.85,P<0.05,LSD-t=4.52,P<0.05);与sh-TRIM25+oe-NC组相比,sh-TRIM25+oe-EZH2组巨噬细胞中F4/80+CD206+巨噬细胞比例和Arg-1蛋白表达明显升高(LSD-t=3.37,P<0.05,LSD-t=3.95,P<0.05)。

图6 WB法检测KYSE510细胞中TRIM25和 EZH2蛋白表达

图7 KYSE510细胞中TRIM25对巨噬细胞M2极化的影响
2.6TRIM25/EZH2轴通过巨噬细胞M2极化对KYSE510细胞的影响:用KYSE510细胞与M0巨噬细胞共培养上清液处理KYSE510细胞后,CCK-8法、克隆形成实验、Transwell实验结果(图8)显示,与sh-NC+oe-NC+TAM组相比,sh-TRIM25+oe-NC+TAM组KYSE510细胞增殖活力、克隆形成数、迁移和侵袭细胞数均显著降低(LSD-t=4.12,P<0.05,LSD-t=4.35,P<0.05,LSD-t=4.56,P<0.05),sh-NC+oe-EZH2+TAM组KYSE510细胞增殖活力、克隆形成数、迁移和侵袭细胞数均显著升高(LSD-t=4.85,P<0.05,LSD-t=5.02,P<0.05,LSD-t=5.13,P<0.05);与sh-TRIM25+oe-NC+TAM组相比,sh-TRIM25+oe-EZH2+TAM组KYSE510细胞活力、克隆形成数、迁移和侵袭细胞数均显著升高(LSD-t=4.02,P<0.05,LSD-t=4.08,P<0.05,LSD-t=4.11,P<0.05)。
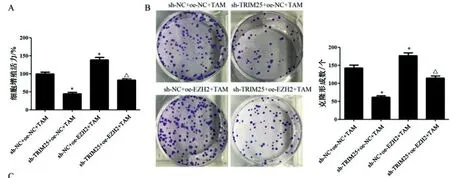
图8 TRIM25/ EZH2轴通过巨噬细胞M2极化对KYSE510细胞的影响
3 讨 论
ESCC的发生发展是一个多因素、多基因变化、多阶段的综合过程[6]。肿瘤浸润性免疫细胞作为TME的主要组成部分,对肿瘤的进展、治疗和预后有重要影响[7]。近年来,越来越多的研究关注免疫微环境对抗肿瘤免疫的调控作用,但对ESCC免疫细胞浸润的调控机制却知之甚少。因此,还需继续探究ESCC免疫细胞浸润的相关分子机制,以期为开发新的临床治疗靶点提供科学依据。
免疫细胞浸润包括TAM,它们产生各种血管生成、免疫抑制和生长相关的因子,从而促进肿瘤的恶性进展[8]。巨噬细胞表现出明显的表型异质性,可分为M1型和M2型,前者以分泌促炎细胞因子为特征,后者有助于产生细胞外基质并促进肿瘤进展。在肿瘤发展的最初阶段,TAM表现为M1表型,而在肿瘤进展的后期,它们则向M2表型极化[9]。研究结果表明,ESCC中M2巨噬细胞可通过分泌Arg1、IL-10和TGF-β增强肿瘤细胞的侵袭和迁移能力[10]。目前,关于ESCC中M2巨噬细胞形成的相关分子机制仍需继续研究。TRIM25是TRIM蛋白家族的成员,参与多种类型肿瘤的进展,是癌症中的重要促癌因子。TRIM25除了对肿瘤细胞本身的调控作用外,还与巨噬细胞浸润相关,可调控巨噬细胞免疫应答[11]。本研究结果显示,TRIM25在ESCC细胞中表达升高。敲低TRIM25后可抑制与ESCC细胞共培养的M0巨噬细胞向M2表型极化。进一步实验结果显示,敲低TRIM25通过抑制M0巨噬细胞向M2表型极化,抑制ESCC细胞增殖、迁移和侵袭。该研究结果表明,敲低TRIM25通过抑制巨噬细胞M2极化在ESCC中发挥抗肿瘤作用。
EZH2是多克隆阻遏复合体的一个组蛋白甲基转移酶亚单位,在多种类型肿瘤中反复突变或过表达[12]。EZH2在食管癌组织和细胞中高表达,其高表达促进了食管癌的进展。5-FU通过下调EZH2表达抑制食管癌细胞增殖并诱导细胞凋亡[13]。本研究结果显示,EZH2在ESCC细胞中表达升高。值得注意的是,EZH2是巨噬细胞激活的关键介质,EZH2的缺失有可能阻止巨噬细胞依赖性疾病的发展[14]。本研究结果显示,过表达EZH2可促进与ESCC细胞共培养的M0巨噬细胞向M2表型极化。进一步实验结果显示,过表达EZH2通过促进M0巨噬细胞向M2表型极化,促进ESCC细胞增殖、迁移和侵袭。该研究结果表明,EZH2通过促进巨噬细胞M2极化在ESCC中发挥促肿瘤作用。另外,已有研究证据[7]显示,TRIM25通过上调EZH2表达参与癌细胞化疗耐药性的形成。本研究结果显示,敲低TRIM25对EZH2 mRNA表达无明显影响,但可降低EZH2蛋白半衰期,导致EZH2蛋白稳定性降低。进一步实验结果显示,过表达EZH2可逆转sh-TRIM25对巨噬细胞M2极化的影响,导致M2巨噬细胞比例升高,最终导致ESCC细胞增殖、迁移和侵袭能力升高。该研究结果表明,敲低TRIM25通过下调EZH2蛋白稳定性,抑制巨噬细胞M2极化,在ESCC中发挥抗肿瘤作用。
综上所述,TRIM25和EZH2在ESCC细胞中高表达,TRIM25通过促进EZH2蛋白的稳定性,上调EZH2蛋白表达,诱导巨噬细胞M2极化,从而促进ESCC细胞增殖、迁移和侵袭。此研究为揭示ESCC相关巨噬细胞浸润的分子机制及挖掘新的临床治疗靶点提供了理论依据。
