长链非编码RNA生长停滞特异性转录子5负调控核仁磷酸蛋白1对胃癌细胞顺铂耐药性的影响
2023-10-20石飞霍晓雪徐建国
石飞,霍晓雪,徐建国
1.青海省人民医院药学部,青海西宁 810000;2.青海省人民医院肿瘤外科,青海西宁810000
胃癌是全球最常见的消化道恶性肿瘤,其发病率位居恶性肿瘤第5 位,死亡率高达第3 位,具有易转移、复发的特点,导致患者预后差,生存率低,严重威胁人们的身体健康[1-2]。胃癌早期无明显临床症状,且我国胃癌早期筛查未普及,导致大多患者就诊时已失去手术治疗的机会,因此临床上多采用化疗手段治疗,顺铂(cisplatin,DDP)是胃癌化疗方案的关键药物,但其常引起胃癌细胞化疗耐药,导致化疗效果不佳[3-4]。因此探究胃癌细胞耐药机制及相关生物指标对于提高化疗疗效,改善患者预后十分重要。长链非编码RNA(long non-coding RNA,LncRNA)作为转录及转录后调控的一类重要RNA,长度一般大于200 个核苷酸,在机体内发挥广泛的调控作用,尤其在肿瘤发生、发展中发挥重要作用[5-6]。研究发现,LncRNA 生长停滞特异性转录子5(growth arrest specific transcript 5,GAS5)在胃癌组织和细胞中表达下调,上调其水平能够抑制胃癌细胞增殖、促进细胞凋亡[7-8]。核仁磷酸蛋白1(nucleophosmin 1,NPM1)广泛高表达于多种肿瘤组织或细胞中,与细胞增殖能力呈正相关[9]。通过生物信息学数据库starbase预测显示,NPM1 是LncRNA GAS5 的靶基因,但关于LncRNA GAS5与NPM1在胃癌细胞DDP 耐药中的作用及关系尚未见相关报道,因此,本研究构建了DDP耐药细胞,并测定相关因子水平,以探究LncRNA GAS5与NPM1在DDP耐药细胞中的调控作用。
1 材料与方法
1.1细胞、质粒及序列 正常人胃黏膜细胞系GES-1和人胃癌细胞系BG3-823、MGC-803、AGS 购自中国科学院上海细胞库,于37 ℃,5%CO2,相对湿度98%的恒温培养箱中培养,培养液为含10%胎牛血清(fetal bovine serum,FBS)、100µg/mL链霉素和100 U/mL青霉素的DMEM 培养液;隔天换液,观察细胞生长情况,待各细胞单层平铺约培养瓶底部80%时进行消化传代,取对数生长期的细胞用于后续试验。pLJM 空质粒、pLJM-GAS5无关序列、pLJM-GAS5购自湖南丰晖生物科技有限公司。
1.2主要试剂及仪器 FBS、DMEM 培养液购自北京索莱宝科技有限公司;兔抗人核仁磷酸蛋白1(nucleophosmin 1,NPM1)单抗、兔抗人多药耐药基因1(multidrug resistance 1,MDR1)多抗、兔抗人耐药基因切除修复交叉互补基因1(excision repair cross complementation group 1,ERCC1)多抗、兔抗人多药耐药相关蛋白1(multidrug resistance-associated protein 1,MRP1)多抗、兔抗人神经性钙黏附素(N-cadherin)多抗、兔抗人β-actin 多抗及羊抗兔IgG/HRP 购自上海恒斐生物科技有限公司;DDP(货号:B24462)购自上海源叶生物科技有限公司;MTT 溶液(5 mg/mL,货号:SY0502)购自北京百奥莱博科技有限公司;V arioskan LUX多功能酶标仪、Veriti™PCR仪购自美国赛默飞世尔科技有限公司;ZF-388 凝胶成像仪购自上海嘉鹏科技有限公司。
1.3各细胞中LncRNA GAS5水平的检测 采用qRTPCR 法。TRIzol 法提取各组细胞总RNA,按照逆转录试剂盒说明书进行逆转录获得cDNA(逆转录体系:5×gDNA Eraser Buffer 2µL,Total RNA 2µL,gDNA Eraser 1 µL,RNase-free dH2O 5 µL),以其为模板进行qRT-PCR 扩增。LncRNA GAS5 上游引物序列:5'-AATAATCAAGGTTTTCGAGGTAGGAGTCGA-3',下游引物序列:5'-AATAATTTCGAATGGATTGCAAAAATTTATAAAATTG-3';GAPDH 上游引物序列:5'-GGTGAAGGTCGGAGTCAACG-3',下游引物序列5'-CCATGTAGTTGAGGTCAATGAAG-3'。引物由苏州泓迅生物科技股份有限公司合成。扩增体系:2 ×QuantiFast SYBR Green PCR Master Mix 10 µL,正向引物2 µL,反向引物2 µL,cDNA 2 µL,RNase-free dH2O 4 µL;扩增条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火34 s,68 ℃延伸30 s,共38 个循环;72 ℃延伸10 min。反应结束后观察熔解曲线,采用2-ΔΔCT法计算LncRNA GAS5、NPM1 相对定量的结果,每个样本重复6次。
1.4胃癌AGS 细胞DDP 耐药模型的构建及细胞转染 参考文献[10]及预试验对AGS细胞构建DDP 耐药(AGS/DDP)。用0.5、1.0、2.0、4.0、8.0µg/mL DDP进行梯度诱导,每个浓度37 ℃诱导14 d,至AGS细胞呈对数生长时,更换至下一浓度,待AGS细胞在8.0µg/mL DDP 中呈对数生长后,结束诱导。MTT法检测半抑制浓度(IC50)[11]。常规培养7 d后进行后续试验。实验分为对照组(无DDP耐药、无转染)、空质粒组(BC 组,DDP 耐药、转染pLJM 空质粒)、GAS5无义干扰组(pLJM-GAS5 NC 组,DDP 耐药、转染pLJM-GAS5 无关序列)、GAS5 过表达组(pLJM-GAS5组,DDP耐药、转染pLJM-GAS5)。
取AGS/DDP细胞经0.25%胰酶消化后,用不含FBS的DMEM培养液调整细胞密度至2×104个/mL,接种24 孔培养板,待细胞密度约占培养板50%时,按照实验分组,采用LipofectamineTM2000 将pLJMGAS5、pLJM-GAS5 无关序列、pLJM 空质粒分别转染至AGS/DDP 细胞中,37 ℃转染24 h后,更换DMEM培养液,qRT-PCR法检测LncRNA GAS5水平,Western blot法检测NPM1水平,继续培养用作后续试验。
1.5DDP 对AGS、AGS/DDP 细胞增殖能力影响的检测 用不含FBS 的DMEM 培养液将AGS 和AGS/DDP 细胞密度调整为5 × 104个/mL,接种96 孔板,37 ℃,5% CO2恒温培养箱培养至细胞贴壁;弃原培养液,PBS 洗涤3 次,加入200µL 含终浓度分别为0、10、20、40、80、100µmol/L DDP 的培养液,设6 个复孔,同时设调零孔和不加DDP 的对照组,继续培养48 h;加入25 µL MTT 溶液,继续培养4 h;弃原培养液,加入150 µL DMSO 溶液,37 ℃,100 r/min 恒温振荡混合10 min;多功能酶标仪检测样品在490 nm波长处的A值,按下式计算细胞增殖抑制率。
细胞增殖抑制率(%)=[1-(实验组A值-调零孔A值)/(对照组A值-调零孔A值)]×100%
1.6AGS、AGS/DDP细胞中NPM1、MDR1、ERCC1、MRP1、N-cadherin 水平的检测 采用Western blot法。加入400 µL RIPA 蛋白裂解液,充分裂解细胞后,离心取上清,提取各细胞总蛋白,BCA 法测定各细胞蛋白含量,以20µg/mL蛋白上样,经10%SDSPAGE(80 V 电泳30 min,120 V 电泳60 min)分离后,转膜,5% BSA 常温封闭结合位点60 min;加入兔抗人NPM1、MDR1、ERCC1、MRP1、N-cadherin、β-actin抗体(均1∶1 000 稀释),4 ℃孵育24 h;加入羊抗兔IgG/HRP(1∶1 000 稀释),37 ℃避光孵育30 min;曝光,ECL 显色后,用凝胶成像软件Image Lab 分析灰度值,计算各细胞中蛋白相对含量。
1.7统计学分析 采用SPSS 22.0软件对所有数据进行统计和分析。实验数据以均数± 标准差(x ± s)表示,多组比较行单因素方差分析,任意两组比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1各细胞中LncRNA GAS5水平 与人正常胃黏膜GES-1细胞(1.02±0.13)相比,人胃癌BG3-823(0.84±0.10)、AGS 细胞(0.57 ± 0.08)中LncRNA GAS5 水平明显降低(q分别为4.139、10.346,P均<0.05),MGC-803 细胞(0.94 ± 0.11)中LncRNA GAS5 水平差异无统计学意义(q=1.839,P>0.05)。表明AGS细胞中LncRNA GAS5 相对表达水平最低,因此选择AGS细胞进行后续试验。
2.2转染后AGS/DDP细胞中LncRNA GAS5及NPM1水平 经DDP诱导耐药后,与对照组相比,BC和pLJMGAS5 NC 组AGS 细胞中LncRNA GAS5 水平明显降低(q分别为10.038、8.880,P均<0.05),NPM1水平显著升高(q分别为18.870、18.031,P均<0.05);与BC 和pLJM-GAS5 NC 组相比,pLJM-GAS5 组AGS/DDP 细胞中LncRNA GAS5 水平显著升高(q分别为8.108、6.950,P均<0.05),NPM1水平明显降低(q分别为12.999、12.160,P均<0.05);pLJM-GAS5 NC和BC 组AGS/DDP 细胞中LncRNA GAS5、NPM1 水平差异无统计学意义(q分别为1.158、0.839,P均>0.05),提示转染成功,pLJM-GAS5 组AGS/DDP 细胞中NPM1下调。见图1和表1。
表1 转染后AGS/DDP 细胞中LncRNA GAS5、NPM1 水平比较(±s,n=6)Tab.1 Comparison of LncRNA GAS5 and NPM1 levels in AGS/DDP cells after transfection(±s,n=6)

表1 转染后AGS/DDP 细胞中LncRNA GAS5、NPM1 水平比较(±s,n=6)Tab.1 Comparison of LncRNA GAS5 and NPM1 levels in AGS/DDP cells after transfection(±s,n=6)
注:a表示与对照组相比,P <0.05;b表示与BC组相比,P <0.05;c表示与pLJM-GAS5 NC组相比,P <0.05。
?
2.3DDP 对转染后AGS/DDP 细胞增殖能力的影响 不同浓度DDP 分别处理AGS、AGS/DDP 细胞48 h后,细胞增殖抑制率均随DDP 浓度增大而增加,具有浓度依赖性。同浓度DDP(除0µmol/L 外)处理后,与对照组相比,BC、pLJM-GAS5 NC 组AGS/DDP 细胞增殖抑制率明显降低(q分别为13.729、14.347,15.624、16.114,19.529、20.011,21.633、21.994,25.541、25.826,P均<0.05);与BC、pLJMGAS5 NC 组相比,pLJM-GAS5 组AGS/DDP 细胞增殖抑制率显著升高(q分别为6.772、7.390,10.107、10 598,15.046、15.527,16.426、16.787,19.611、19.896,P均<0.05)。DDP 对pLJM-GAS5 组AGS/DDP细胞48 h的IC50为(65.38±5.04)µmol/L,显著高于对照组[(49.17±4.59)µmol/L](q=8.756,P均<0.05),明显低于BC[(120.74±4.17)µmol/L]、pLJM-GAS5 NC 组[(120.24 ± 4.29)µmol/L](q分别为29.902、29.632,P均<0.05)。见图2。提示上调LncRNA GAS5 水平,可增强DDP 对AGS/DDP 细胞增殖抑制率。
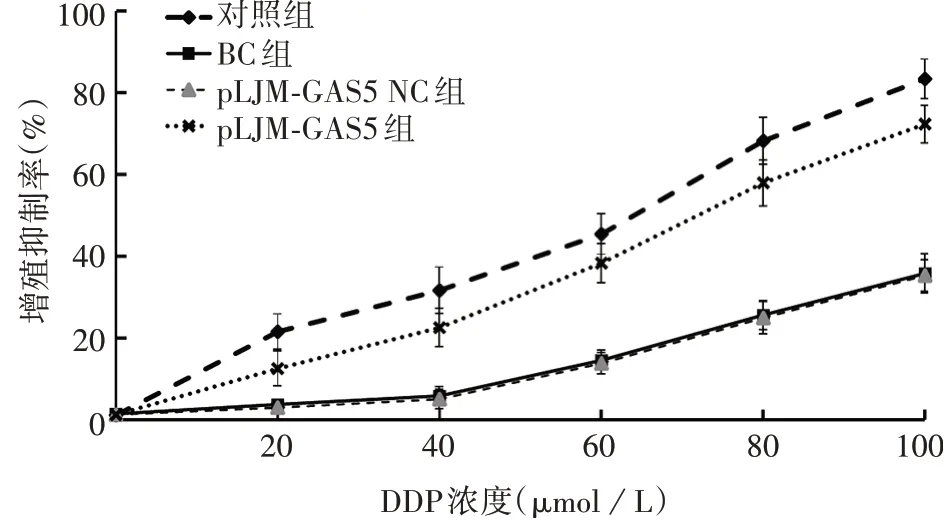
图2 DDP处理后AGS、AGS/DDP细胞增殖抑制率Fig.2 Inhibition rate of proliferation of AGS and AGS/DDP cells after treatment with DDP
2.4转染后AGS/DDP细胞中MDR1、ERCC1、MRP1、N-cadherin水平 与对照组相比,BC、pLJM-GAS5 NC组AGS/DDP细胞中MDR1、ERCC1、MRP1、N-cadherin水平显著升高(q分别为14.587、15.462,11.737、12.149,17.917、17.241,16.494、16.733,P均<0.05);与BC、pLJM-GAS5 NC组相比,pLJM-GAS5组MDR1、ERCC1、MRP1、N-cadherin 水平明显降低(q分别为5.543、6.418,5.560、5.972,11.832、11.156,5.737、5.976,P均<0.05);pLJM-GAS5 NC 和BC 组AGS 细胞中MDR1、ERCC1、MRP1、N-cadherin水平差异无统计学意义(q分别为0.875、0.412、0.676、0.239,P均>0.05)。见图3 和表2。提示上调LncRNA GAS5 水平,可降低AGS/DDP细胞中MDR1、ERCC1、MRP1、N-cadherin表达。
表2 转染后AGS/DDP 细胞中MDR1、ERCC1、MRP1、Ncadherin水平比较(±s,n=6)Tab.2 Comparison of MDR1,ERCC1,MRP1 and N-cadherin levels in AGS/DDP cells after transfection(±s,n=6)
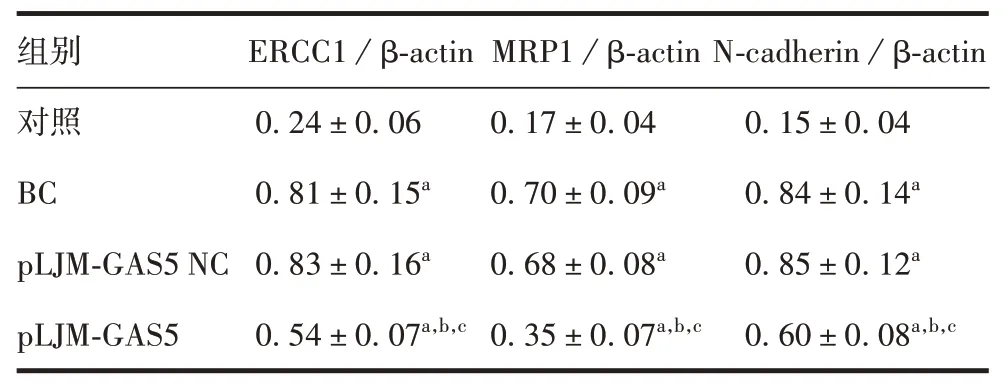
表2 转染后AGS/DDP 细胞中MDR1、ERCC1、MRP1、Ncadherin水平比较(±s,n=6)Tab.2 Comparison of MDR1,ERCC1,MRP1 and N-cadherin levels in AGS/DDP cells after transfection(±s,n=6)
注:a 表示与对照组相比,P <0.05;b 表示与BC 组相比,P <0.05;c表示与pLJM-GAS5 NC组相比,P <0.05。
?
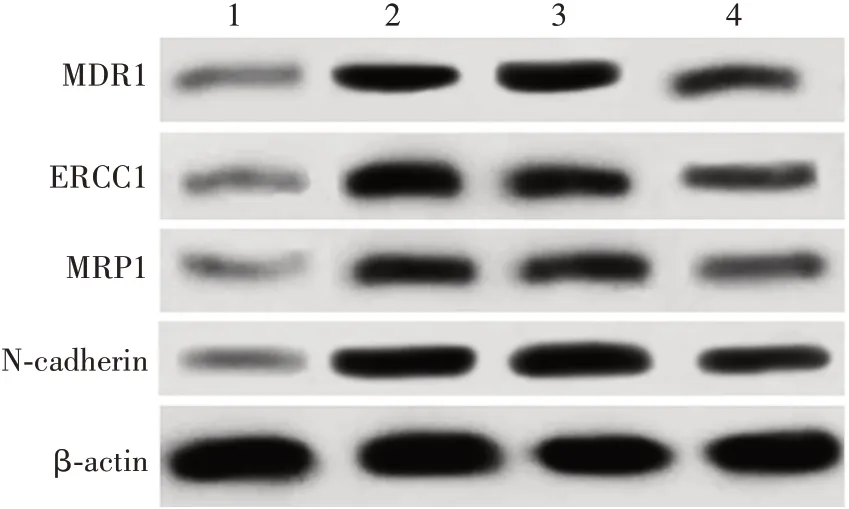
图3 转染后AGS/DDP 细胞中MDR1、ERCC1、MRP1、Ncadherin水平Fig.3 Levels of MDR1,ERCC1,MRP1 and N-cadherin in AGS/DDP cells after transfection
3 讨论
DDP 是临床上胃癌化疗首选药物之一,可作用于DNA 的嘧啶和嘌呤碱基,从而抑制DNA 复制过程,具有抗癌谱广、疗效确切的特点[12-13]。DDP 能够降低胃癌患者转移、复发率,但约有35%的胃癌患者因出现DDP 耐药导致化疗失败,目前DDP 耐药已成为治疗胃癌的主要障碍[14]。为进一步探讨LncRNA GAS5 和NPM1 在人胃癌细胞DDP 耐药中的作用,本研究首先选取正常人胃黏膜细胞系GES-1 和人胃癌细胞系BG3-823、MGC-803、AGS作为研究对象,测定LncRNA GAS5 水平,结果显示,与GES-1 细胞相比,人胃癌BG3-823、AGS 细胞中LncRNA GAS5 水平降低,其中AGS 细胞中LncRNA GAS5 水平最低,因此采用AGS 细胞开展后续试验,并依据浓度梯度诱导法,用低浓度DDP构建AGS/DDP细胞模型,MTT试验发现,DDP 对AGS/DDP 细胞IC50明显高于AGS细胞,表明AGS/DDP细胞模型构建成功。
由于化疗药物的耐药机制尚不明确,癌基因、抑癌基因以及常见的一些细胞因子等均可能参与化疗药物耐药形成的过程,其中目前在胃癌多药耐药机制中研究最多的主要包括MDR1、MRP1、ERCC1、Ncadherin、P-糖蛋白(P-glycolprotein,P-gp)及肺耐药蛋白(lung resistance protein,LRP)等,这些主要通过改变药物的胞内分布或将化疗药物排出细胞外而参与肿瘤的多药耐药机制[15-16]。研究还发现,多药耐药的产生与ATP 结合盒蛋白家族的药物转运载体高表达相关,其中包括MDR1及其编码产物P-gp、MRP1[17]。皮间质转化(epithelial-mesenchymal transition,EMT)可促进肿瘤细胞侵袭及迁移,使肿瘤细胞产生化疗耐药。研究还发现,上调N-cadherin表达,可促进上皮细胞向间质细胞转化,最终引起EMT[18-19]。而ERCC1是核苷酸切除修复系统中的关键环节,其主要通过在核苷酸切除修复过程中发挥识别损伤DNA 以及链接切割的作用,参与着色性干皮病F 蛋白(xeroderma pigmentosum group F,XPF)形成复合物切除损伤DNA 序列,从而快速修复DNA 损伤而介导肿瘤细胞对DDP耐药[20]。本研究发现,AGS/DDP细胞中MDR1、ERCC1、MRP1、N-cadherin 水平显著高于AGS 细胞,同样说明AGS/DDP 细胞模型构建成功,DDP 耐药性增强。
近来研究发现,LncRNA 在肿瘤细胞耐药性中发挥关键作用,LncRNA GAS5在膀胱尿路上皮癌(T24)细胞中低表达,上调其水平可抑制T24 细胞多柔比星耐药性,下调抗凋亡蛋白Bcl-2水平,促进耐药T24细胞凋亡[21]。李孝敏等[22]研究发现,与正常结肠细胞相比,结肠癌(SW480)细胞中LncRNA GAS5 水平明显降低,过表达LncRNA GAS5 可增强SW480 细胞放射敏感性。本研究为评价LncRNA GAS5在AGS/DDP细胞中的作用,构建了pLJM-GAS5转染的AGS/DDP细胞,与BC和pLJM-GAS5 NC组相比,pLJM-GAS5组AGS/DDP 细胞中LncRNA GAS5 水平升高,表明pLJM-GAS5 转染成功。MTT 试验发现,与BC、pLJMGAS5 NC 组相比,pLJM-GAS5 组AGS/DDP 细胞增殖抑制率升高;DDP 对pLJM-GAS5 组AGS/DDP 细胞48 h 的IC50值低于BC、pLJM-GAS5 NC 组AGS/DDP 细胞,表明上调LncRNA GAS5 水平可提高DDP对AGS/DDP细胞增殖抑制能力,逆转DDP耐药。此外上调LncRNA GAS5水平后,AGS/DDP细胞中MDR1、ERCC1、MRP1、N-cadherin 水平降低,表明LncRNA GAS5 可能抑制相关耐药蛋白表达从而发挥逆转耐药作用。
NPM1可穿梭于胞质、核质、核仁,参与核糖体的装配、染色体复制等胞内信号转导[23]。陈思颖等[24]研究发现,在乳腺癌甲氨蝶呤耐药(MCF-7/MTX)细胞中NPM高表达,下调其水平可降低MCF-7/MTX耐药性,促进细胞凋亡。随后贺兼斌等[25]将肺腺癌DDP 耐药细胞接种至小鼠皮下,行化学治疗,发现耐药组小鼠抑瘤率明显低于非耐药组,瘤组织中NPM水平显著高于非耐药组。本研究发现,AGS/DDP细胞中NPM1水平高于AGS细胞,表明NPM1与AGS细胞耐药相关。上调LncRNA GAS5水平后,与BC和pLJMGAS5 NC组AGS/DDP细胞相比,pLJM-GAS5组NPM1水平降低,表明LncRNA GAS5 可能通过下调NPM1水平参与AGS细胞耐药进程。
综上所述,LncRNA GAS5 在AGS/DDP 细胞低表达,NPM1 高表达,上调LncRNA GAS5 表达可降低AGS/DDP细胞耐药性,且下调NPM1水平。但本文仅使用一种胃癌细胞系进行功能研究,可能证据不够充分,后期将通过其他胃癌细胞系进行LncRNA GAS5 的功能验证,从而更加完善本研究的内容。同时,本研究未探讨LncRNA GAS5 通过何种信号通路作用于NPM1,有待后续完善。
