纳米肿瘤疫苗抗小鼠黑色素瘤的免疫效果
2023-10-20申玉蓉梁朝远张晓菲何学松琚琪王晓丽邓雄威肖向茜盛望
申玉蓉,梁朝远,张晓菲,何学松,琚琪,王晓丽,邓雄威,肖向茜,盛望
1.北京工业大学环境与生命学部,北京 100124;2.国家纳米科学中心,北京100190
黑色素瘤虽然仅占所有皮肤癌的1%,但却是最具侵袭性和危险性的一种肿瘤,占所有皮肤癌死亡病例的90%[1]。目前治疗黑色素瘤的方法有手术切除、放疗、化疗、靶向治疗、免疫治疗等[2]。但单纯通过手术切除肿瘤术后复发风险较高,而放化疗消灭肿瘤细胞易产生多种副作用[3],会对癌症患者身体造成二次伤害。靶向治疗,如v-raf 鼠科肉瘤病毒癌基因同源物B(v-raf murine sarcoma viral oncogene homolog B,BRAF)的抑制剂,已经用于临床。但靶向治疗面临的一大瓶颈是继发性耐药,甚至有的患者对药物不产生反应或药物副作用严重[4]。急需开发一种个性化的抗黑色素瘤药物疗法。
免疫疗法治疗肿瘤如今受到医学界和生物学界的广泛关注。免疫疗法包括免疫检查点抑制剂、嵌合抗原受体(chimeric antigen receptor,CAR-T)细胞疗法、Toll 样受体(Toll-like receptor,TLR)激动剂、过继性免疫细胞疗法、肿瘤疫苗等。TLR 是模式识别受体(pattern recognition receptors,PRRs)的一种,在先天免疫反应中具有重要作用[5],TLR9 在人B 细胞和浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)中表达[6],人工合成的CpG寡脱氧核苷酸(CpG ODN)可激活TLR9,降低免疫耐受,从而促进免疫系统的抗肿瘤反应[7],目前已有100款以上以CpG 作为佐剂的预防性、治疗性疫苗正处于临床试验阶段。纳米佐剂有较强的免疫募集活性,其大小、形状和表面性质均可根据需求设计[8],CpG被纳米颗粒包载后有利于被细胞通过内吞作用进入活细胞,并与内体/溶酶体表面的TLR9结合,进一步激发细胞内的免疫级联反应,具有免疫原性增强作用[9]。
肿瘤疫苗根据用途分为预防型和治疗型两种,是近些年的研究热点之一,根据成分可分为肿瘤全细胞疫苗、蛋白多肽疫苗、基因工程疫苗、抗体肿瘤疫苗等。癌症疫苗将肿瘤细胞、肿瘤相关蛋白或多肽、表达肿瘤抗原的基因等多种形式的肿瘤抗原导入患者体内,激发免疫系统的抗肿瘤免疫反应。肿瘤细胞裂解物中含有丰富的抗原,可有效激发免疫系统产生免疫应答,通过与佐剂共同作用可增强肿瘤特异性免疫应答。
本实验前期自行设计并构建了β葡聚糖-CpG复合佐剂纳米颗粒,该纳米颗粒利用自组装原理将CpG 包裹其中,形态近球形,作为佐剂,可成为良好的药物递送系统[10],本研究将该纳米颗粒和黑色素瘤细胞裂解液分别在体外对骨髓来源树突状细胞(bone marrow-derived dendritic cells,BMDCs)进行刺激后,按一定比例将二者混合制备成疫苗对荷瘤小鼠进行治疗,通过体内外免疫效果评价探讨该疫苗对黑色素瘤的治疗作用。
1 材料与方法
1.1细胞 小鼠黑色素瘤细胞系(B16F10)购自北京协和细胞库,保存于北京工业大学生命科学与化学工程学院药物研究所实验室。
1.2实验动物 SPF 级雌性C57BL/6N 小鼠,50 只,6 ~8周龄,体质量18 ~20 g,购自斯贝福(北京)生物技术有限公司,动物合格证号:SCXK(京)2019-0010,饲养于北京神瑞生物技术有限公司,动物使用许可证号:SYXK(京)2020-0001。本实验以科研为目的进行小鼠的养殖和使用,且经北京工业大学动物伦理委员会审查批准,严格按照中国科学院过程工程研究所伦理要求进行动物实验(IPEAECA2019016)。
1.3主要试剂及仪器 包载CpG 的纳米颗粒(CpGcoated nanoparticles,CNP,即纳米复合佐剂)由本实验室自行设计并构建[10];CpG 1826 由北京睿博兴科生物技术有限公司合成;羧甲基β 葡聚糖(carboxymethyl β-glucan,CMG)购自美国Sigma公司;小鼠IFNγ ELISA 试剂盒(货号:1210002)、IL-12 ELISA 试剂盒和TNF-α ELISA 试剂盒(货号:1217202)购自达科为生物技术有限公司;小鼠IL-6试剂盒(货号:431304)、IL-2p40 ELISA 试剂盒(货号:431604)、鼠抗CD11c(FITC 标记)、MHC-Ⅱ(PE 标记)、CD80(APC 标记)、CD86(PerCP-Cy5.5)和TruStain FcX™PLUS(CD16/32)抗体购自美国BioLegend 公司;4%多聚甲醛组织细胞固定液购自北京索莱宝科技有限公司;CD8α 试剂(D4W2Z)XP®Rabbit mAb(Mouse Specific)、4',6-二脒基-2-苯基吲哚(DAPI)购自美国CST 公司;粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)购自美国Thermo公司;辣根过氧化物酶标记的山羊抗兔IgG 购自美国Merck公司;FACS Calibur型流式细胞仪购自美国BD公司。
1.4肿瘤裂解液及疫苗的制备 采用反复冻融法制备肿瘤裂解液。将B16F10 细胞用含10%FBS 和1%PS的DMEM完全培养基于37 ℃,5%CO2恒温培养箱培养至融合度约80%时,用0.25%胰酶(含EDTA)消化,PBS 洗涤去除残留培养基,经细胞计数后调整细胞密度至1 × 107个/mL,分装至细胞冻存管中,1 mL/管;将冻存管先置于液氮中5 min,然后迅速置预热的37 ℃水浴锅中加热5 min,反复冻融5 次;将冻存管中液体转移至离心管中,25 ℃,2 000×g离心15 min;收集上清,BCA 试剂盒检测上清蛋白含量,-20 ℃条件下保存。
将肿瘤裂解液(50µg/mL)与CNP(20µg/mL)混合,制备肿瘤裂解物疫苗。
1.5小鼠BMDCs 的分离及体外刺激成熟试验 将C57BL/6N小鼠经10%水合氯醛麻醉并脱颈处死后进行酒精消毒处理,无菌取完整的股骨和胫骨,分别剪开两端露出骨髓腔,用RPMI1640培养基冲洗骨髓多次至髓腔变白,将收集的骨髓冲洗液经70 µm 细胞筛网过滤后,置培养皿中,恒温培养箱静置30 min;收集悬浮细胞以及皿底松散贴壁细胞置50 mL 离心管中,400×g离心5 min;弃上清,细胞计数后,按4×106个/孔接种6 孔板,补加DCs 培养基(RPMI1640培养液加入50 µmol/L β-巯基乙醇、10% FBS、1%PS、0.05% IL-4 和1% GM-CSF),4 mL/孔,37 ℃恒温培养箱静置培养,记为第0天;第3天细胞全换液;第5 天细胞半换液;第7 天收集悬浮细胞,350×g离心5 min;细胞计数后,按1×106个/孔接种24孔板,补加DCs培养基,1 mL/孔。设PBS、CpG(2µg/孔)、CNP(2µg/孔)、裂解液(3、5、8µg/孔)组,每组设3个复孔,培养24 h 后分别收集细胞及其上清液。BMDCs 用流式抗体CD11c-FITC、MHC-Ⅱ-PE、CD86-PerCPCy5.5、CD80-APC 4 ℃染色15 min 后,上流式细胞仪检测;上清液中细胞因子含量检测按IL-6、IL-12 ELISA试剂盒说明书进行操作。
1.6B16F10动物模型的建立及分组给药 经C57BL/6N小鼠右后肢皮下接种2×105个对数生长期的B16-F10 细胞,7 d 后,筛选肿瘤大小相对一致的40 只小鼠,随机分为4组,每组10只:对照(PBS,100µL/只)、佐剂(CNP,20µg/只)、裂解液(Lysate,50µg/只)、疫苗(Vaccine,CNP 20 µg/只、Lysate 50 µg/只)组,均经颈部皮下注射,100µL/只,每周给药1 次,连续3 周。给药期间,用游标卡尺每隔2 d 记录肿瘤最大直径(a)和最小直径(b),计算肿瘤体积(V=1/2×a×b2),计算肿瘤大小,绘制肿瘤生长曲线。
1.7外周血中IFNγ和TNF-α含量的检测 于最后1次给药后第7 天,用10%水合氯醛麻醉小鼠,眼眶取血,置EDTA 抗凝管中,450 ×g离心10 min,收集上清,按IFNγ和TNF-α ELISA试剂盒说明书进行检测。
1.8肿瘤组织中细胞毒性杀伤细胞(cytotoxic T Cells,CTLs)浸润情况的检测 剥离各组小鼠肿瘤,置4%多聚甲醛固定,石蜡包埋后制备组织切片,用抗原修复缓冲液(pH 6.0)进行修复(中火8 min,停火8 min,再转中低火7 min);切片置3%双氧水溶液(阻断内源性过氧化物酶),室温避光25 min;滴加3%BSA 封闭30 min;加入一抗(CD8α试剂,1∶1 000稀释),4 ℃过夜;加入二抗(辣根过氧化物酶标记的山羊抗兔IgG,1∶1 000 稀释)避光孵育50 min;甩干,加入DAB 显色液,显微镜下控制显色时间,阳性为棕黄色,自来水洗涤终止显色;苏木素复染细胞核约3 min;自来水洗涤后脱水封片。显微镜下采集图像,分析肿瘤组织中CTLs(也称CD8+T淋巴细胞)浸润情况。
1.9统计学分析 采用SPSS 17.0软件进行统计学分析,GraphPad Prism 6.0 软件绘制图表。组间比较采用单因素方差分析和t检验,随时间变化的数据采用重复测量的方差分析,以P<0.05 为差异有统计学意义。流式细胞术检测结果用FlowJo软件分析。
2 结果
2.1BMDCs 体外刺激成熟结果 与PBS 组比较,经CpG 和CNP 刺激后,BMDCs 表面的MHC-Ⅱ、CD86、CD80 表达明显增加,其中,CNP 与CpG 比较,可刺激产生更高水平的的MHC-Ⅱ、CD86 和CD80(t分别为3.686、4.031 和4.093,P均<0.05),表明CpG 可促进BMDCs 成熟,且纳米颗粒包载后可提高CpG 促BMDCs成熟的作用。此外,与PBS组比较,加入不同剂量的肿瘤细胞裂解液刺激BMDCs,对其成熟的作用差异无统计学意义(P>0.05),表明裂解物对DCs无免疫调控活性。见图1。
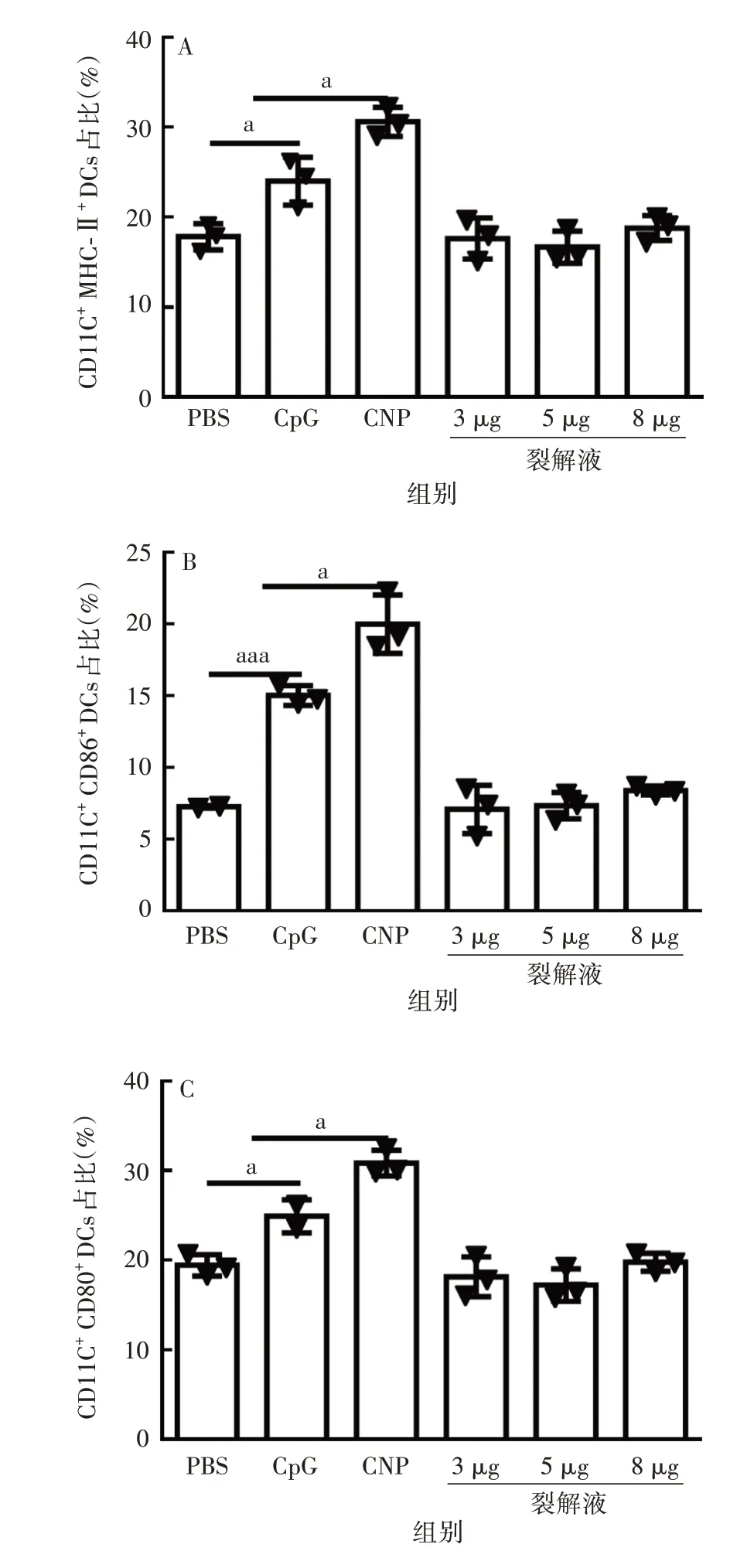
图1 BMDCs 表面标志物MHC-Ⅱ(A)、CD86(B)和CD80(C)表达的分析Fig.1 Expression of surface markers MHC-Ⅱ(A),CD86(B)and CD80(C)in BMDCs
经CpG刺激后,BMDCs分泌IL-6和IL-12的能力提高。CNP 刺激后分泌IL-6 和IL-12 的水平,与CpG组比较差异有统计学意义(t分别为7.776 和3.163,P分别为<0.01和<0.05),其中,分别为CpG刺激后的1.4和1.2倍,表明纳米颗粒包载后可提高CpG的免疫调节活性,在促进BMDCs 成熟后,促进其细胞因子分泌。经不同剂量裂解液刺激后的BMDCs,IL-6和IL-12 分泌水平与PBS 组比较,差异无统计学意义(P>0.05),表明裂解物对DCs 无免疫调控活性。见图2。

图2 BMDCs培养上清中IL-6(A)和IL-12(B)分泌水平的检测Fig.2 IL-6(A)and IL-12(B)secretion levels in culture supernatant of BMDCs
2.2小鼠肿瘤体积生长曲线 与PBS 组比较,CNP、Lysate 和Vaccine 组小鼠肿瘤生长速度均变缓,其中Vaccine 组小鼠肿瘤体积最小,表明疫苗接种可诱导更强的抗肿瘤免疫效应(与PBS、CNP、Lysate组比较,t分别为17.44、10.78、13.93,P均<0.000 1)。见图3。
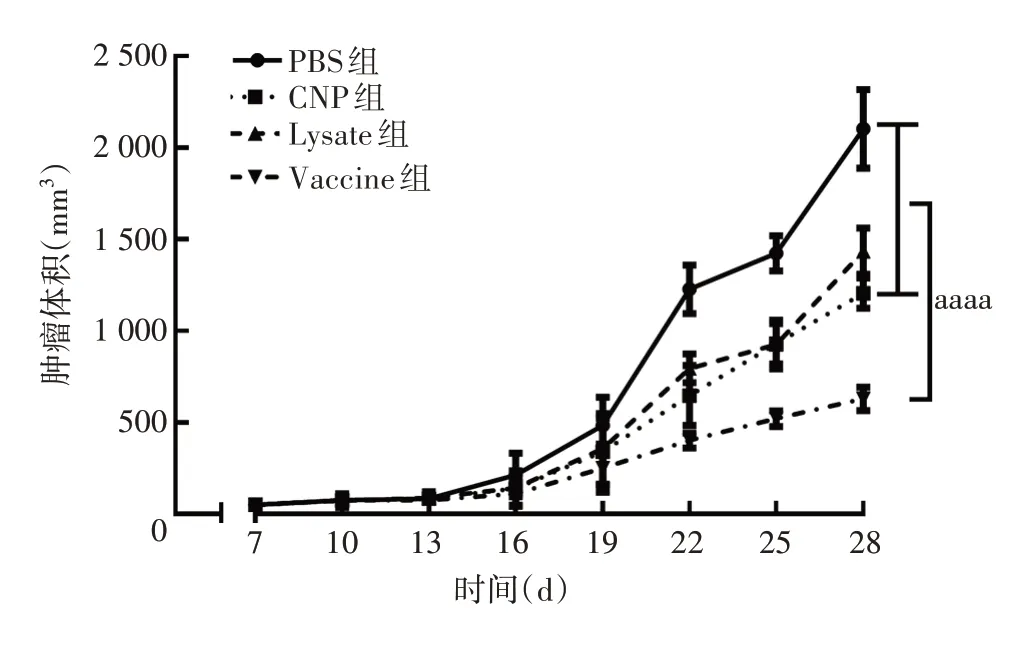
图3 小鼠肿瘤体积生长曲线Fig.3 Growth curve of tumor volume in mice
2.3血清中细胞因子含量 与PBS 组比较,CNP 和Lysate 组小鼠血清中IFNγ 水平升高不显著(t分别为1.689 和0.863 8,P>0.05),但Vaccine 组显著升高(t=7.189,P<0.000 1),且Vaccine组与CNP、Lysate、PBS组比较,差异有统计学意义(t分别为4.436、6.247、7.189,P分别为<0.01、<0.000 1、<0.000 1),表明疫苗免疫可有效激活T细胞免疫应答。CNP和Lysate 组小鼠血清中TNF-α水平与PBS组比较,差异无统计学意义(t分别为0.287 0、1.334,P均>0.05),但Vaccine组高于PBS 组(t= 2.330,P<0.05),表明疫苗免疫具有促进TNF-α表达的免疫调控作用。见图4。

图4 血清中IFNγ(A)和TNF-α(B)含量Fig.4 Contents of IFNγ(A)and TNF-α(B)in serum
2.4肿瘤中CTLs细胞浸润情况 PBS组中分离的黑色素瘤组织中几乎未见棕褐色染色区域,与其相比,CNP和Lysate组出现少量棕褐色染色的CD8+T细胞,而Vaccine 组棕褐色区域明显增加,表明疫苗免疫可有效促进CD8+T 淋巴细胞在黑色素瘤组织中的浸润,改变了黑色素瘤组织中冷肿瘤状态,并有效抑制黑色素瘤生长。见图5。
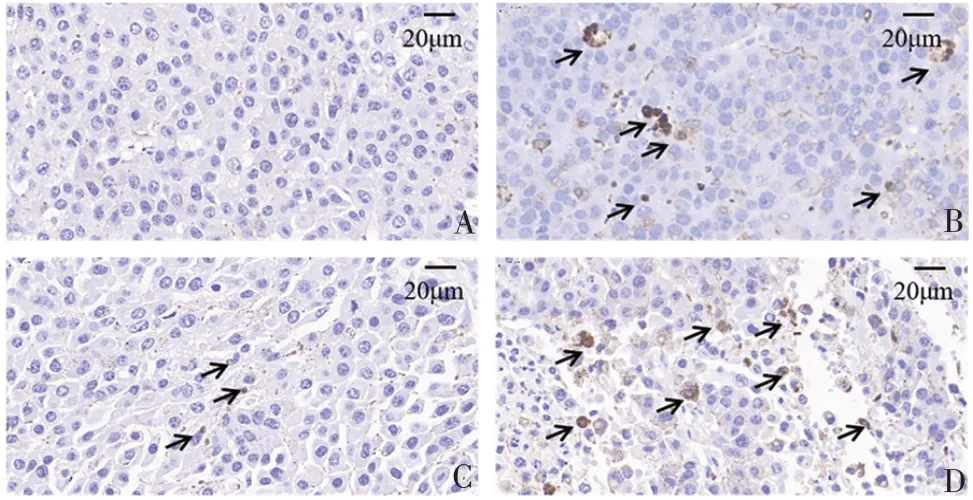
图5 各组小鼠肿瘤内CD8+T 淋巴细胞的浸润情况(标尺:20µm)Fig.5 Infiltration of CD8+ T lymphocytes in tumor tissues of mice in each group(scale:20µm)
3 讨论
肿瘤微环境(tumor microenvironment,TME)是一个复杂的环境,既有肿瘤细胞,又有各种免疫细胞,包括T 细胞、NK 细胞、巨噬细胞和骨髓来源的抑制性细胞等,此外还有各种细胞因子、免疫检查点分子,其中,细胞与细胞分子相互作用影响肿瘤细胞的增殖及迁移[11]。
DCs 作为功能最强的抗原提呈细胞,起到免疫检测前哨作用[12],肿瘤裂解液中含有丰富的抗原,可有效通过病原相关分子模式(pathogen-associated molecular patterns,PAMPs)被DCs 识别,PAMPs 的直接识别是由PRRs 介导的,包括TLRs 和C 型凝集素受体(C-type lectin receptors,CLRs)[13],抗原肽经过加工后与主要组织相容性复合体(major histocompatibility complex,MHC)分子形成异常稳定的复合体。与此同时,DCs趋于成熟,共刺激分子表达增加,包括CD40、CD8 和CD86;功能也发生变化,具备提呈功能,将抗原肽-MHC 复合体呈递给辅助性T 细胞(helper T cells,Th)或杀伤性T细胞(cytotoxic T cells,Tc)[14]。
非甲基化的CpG基序存在于细菌和病毒的DNA,而在脊椎动物基因组中被高度抑制和甲基化,早在上个世纪就有人专门用细菌提取物成功治愈癌症[15],CpG ODN 可模拟细菌DNA,刺激B 细胞、DCs 和巨噬细胞产生细胞因子,进而刺激NK 细胞、T 细胞等[16]。TLR是PRRs的一种,属于跨膜蛋白,而TLR9是胞内蛋白,CpG被内吞后可与细胞内TLR9结合,激活MyD88NFκB信号通路,激发免疫反应。
本研究采用CpG 作为佐剂,用纳米包载后与黑色素瘤细胞系B16F10 的裂解物混合制备成治疗性肿瘤疫苗,分别进行体内外试验评价该款疫苗免疫效果。在体外刺激BMDCs 的试验中,CpG 对DCs 有明显刺激成熟作用,其表面标志物CD80、CD86、MHC-Ⅱ的表达量相较于对照组增加,且IL-6 和IL-12 的分泌量也有很大提高,CpG 被纳米颗粒包载后,对DCs刺激成熟情况也比未纳米化有一定提高,但肿瘤裂解液对BMDCs 的刺激成熟效果并不佳;体内抗黑色素瘤试验中,疫苗免疫接种取得了较好的抗黑色素瘤效果,肿瘤体积明显小于单独使用组和对照组,且疫苗组小鼠血清中IFNγ(P<0.000 1)和TNF-α(P<0.05)含量均高于对照组;治疗后肿瘤中CD8+T 数量增多,表明淋巴细胞浸润肿瘤内,将肿瘤由“冷”转“热”,对其产生了杀伤作用。
但肿瘤微环境复杂,易产生免疫耐受和免疫抑制,CTLs 会出现功能障碍和衰竭[17],因此单一的治疗效果可能不佳,考虑在之后的研究中引入放化疗或其他免疫治疗手段,如免疫检查点抑制剂、小分子抗体等。近年来,以PD-1、PD-L1、CTAL-4为靶点的免疫检查点抑制剂已应用于临床,也有研究表明,IFNγ的分泌与宿主和癌症细胞中PD-1的表达密切相关[18]。
本研究不仅证实了纳米化的CpG 作为佐剂在抗肿瘤方面的有效性,同时肿瘤裂解物获取途径较为便捷,疫苗制作工艺简单,与佐剂联合起到了很好的协同抑瘤作用,为肿瘤免疫治疗提供了参考。
