肺炎球菌菌种复苏用无动物源性固体培养基的筛选
2023-10-20王研研曹欣林浩卿汪辉徐永学刘艳丽李金阳刘建凯
王研研,曹欣,林浩卿,汪辉,徐永学,刘艳丽,李金阳,刘建凯
北京民海生物科技有限公司结合疫苗新技术研究北京市重点实验室,北京102600
肺炎球菌(Streptococcus pneumoniae,Spn)在自然界广泛分布,常寄居在正常人的鼻咽腔中[1-2]。根据Spn的荚膜成分不同,可分为不同的血清型,目前已分离出的Spn 血清型且已经鉴定的不少于90 种[3-5]。Spn引起的疾病为人类常见疾病,主要有脑膜炎、肺炎、败血症和中耳炎等,目前仍为全球关注的热点[6-7]。接种多价Spn 多糖及结合疫苗是目前降低Spn 感染率及耐药率的最经济、有效的手段[1,6]。
Spn的生长对营养物质要求较高,通常在含有血液或血清的培养基中才能很好的生长[7]。在疫苗生产过程中,动物源性材料往往是影响疫苗安全的重要因素,动物源性材料的使用不仅增加了引入外源因子的风险,而且增加了物料控制的难度[8]。世界卫生组织(World Health Organization,WHO)及《欧洲药典》建议在生物制品和药品生产中应尽可能避免使用动物源性材料,而选用替代材料[9]。通常情况下,Spn发酵培养过程中使用的物料备受关注,有较多研究利用植物来源成分替代动物源材料[10-11],而菌种复苏培养过程却往往被忽视。目前,菌种复苏培养与菌种建库基本上均使用传统的羊血固体培养基[7,12-13],尚无无动物源性Spn菌种培养基的研究报道。
本研究旨在筛选一种无动物源性用于Spn 菌种复苏、扩增培养的固体培养基,并分析其用于菌种传代培养的稳定性及生产适用性,为Spn 在建库、培养的整个阶段彻底去除动物源性物料奠定基础。
1 材料与方法
1.1菌株 Spn 1型(菌号:31404)、2型(菌号:31427)、3 型(菌号:31441)、4 型(菌号:31448)、5 型(菌号:31457)、6A型(菌号:31476)、6B型(菌号:31490)、7F型(菌号:31510)、8 型(菌号:31532)、9N 型(菌号:31510)、9V 型(菌号:31547)、10A 型(菌号:31218)、11A型(菌号:31572)、12F型(菌号:31586)、14型(菌号:31608)、15B 型(菌号:31638)、17F 型(菌号:31663)、18C 型(菌号:31688)、19A 型(菌号:31709)、19F 型(菌号:31693)、20 型(菌号:31727)、22F 型(菌号:31244)、23F 型(菌号:31760)、33F 型(菌号:31847),共24 株,均由中国医学细菌保藏管理中心(Center for Medical Culture Collections,CMCC)提供,经中国食品药品检定研究院检定合格。
1.2培养基 配方1系根据10%羊血固体培养基的配方[12-13],将其中的动物源物料羊血更换为氯化血红素;配方2 ~9系根据C+Y培养基[5,12]进行调整,主要是去除C+Y培养基中牛肉膏、胰酪胨等动物源性物料,并根据Spn生长需要调整维生素、氨基酸、无机盐、过氧化氢酶[14-15]或血红素等进行配制。见表1。菌种传代液体培养基和发酵用培养基为常规生产的培养基。
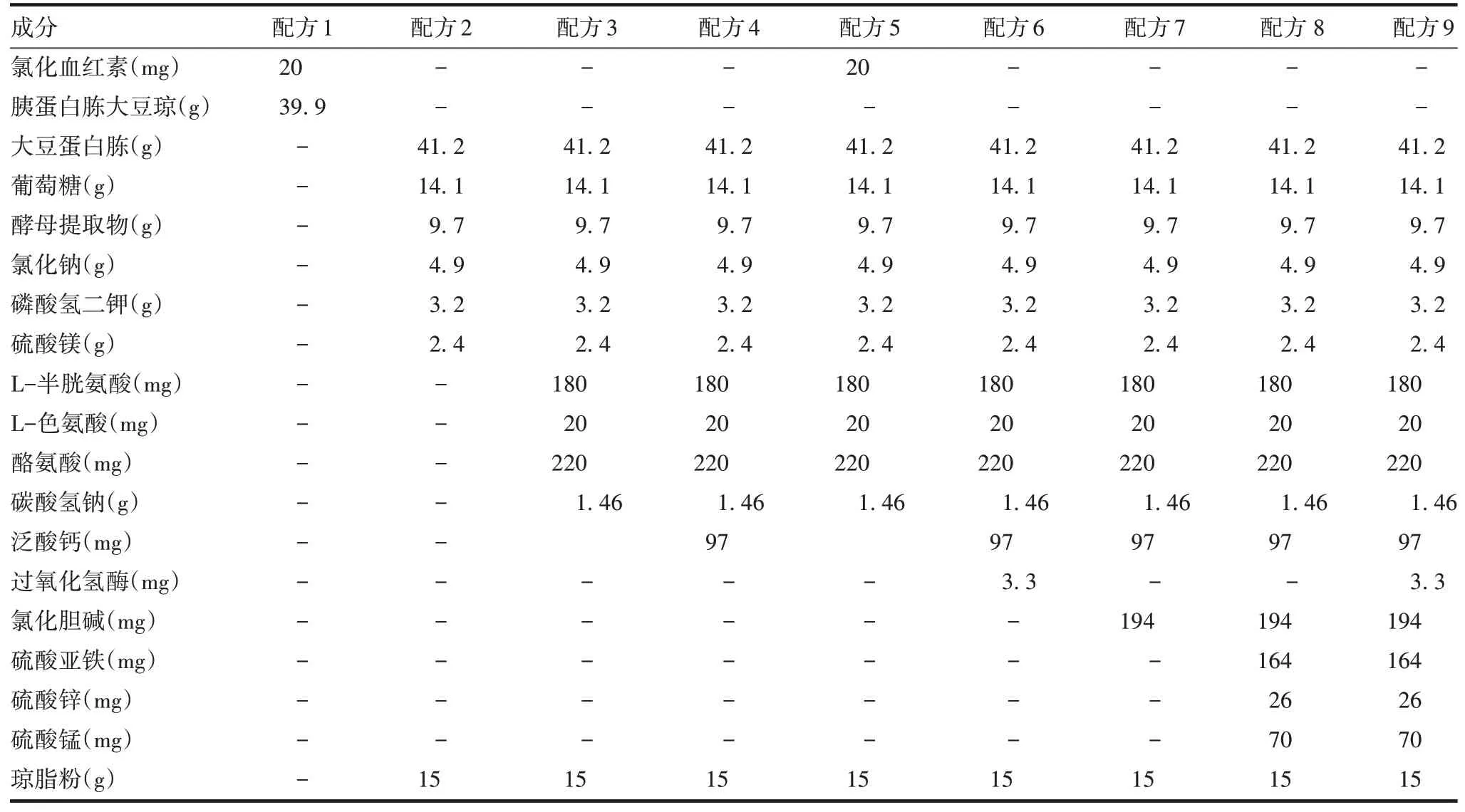
表1 培养基配方Tab.1 Composition of culture media
1.3主要试剂及仪器 大豆蛋白胨购自美国BD 公司;羊血(脱纤维)购自青岛海博生物科技有限公司;四联机械搅拌玻璃发酵罐购自上海百仑生物科技有限公司;超滤系统购自德国Merk Millipore公司。
1.4菌种复苏用固体培养基的筛选
1.4.1初步筛选 取0.5 mL 19F型菌液,分别接种于各配方固体培养基,涂布均匀,每种配方做3个平行,置于37 ℃,10%CO2培养箱中培养。培养结束后,用10 mL生理盐水冲洗菌苔,分光光度计检测菌液A694。取菌液0.5 mL,用生理盐水10倍梯度稀释,各取100 µL稀释菌液接种于羊血固体培养基,置于37 ℃,10%CO2培养箱培养。选择菌落在50 ~300 CFU/平皿进行统计计数。
1.4.2验证 将其他血清型肺炎球菌(除19F 型)一代菌液分别接种于配方9 固体培养基上,培养至9、11、13、15、17、19 h时,用10 mL生理盐水冲洗细胞培养瓶内的菌苔,检测其浓度(A694),对照羊血固体培养基培养至9、11、13 h取样,并取各点菌液稀释涂布进行活菌计数。
1.5传代稳定性检测
根据Spn 荚膜多糖合成机制的不同及其合成基因的同源性分析[16-18],将24 株Spn 分为5 类,每一类中各选取1 个血清型(3、5、9N、19F 和33F)进行传代稳定性试验。
1.5.1菌种检定 将Spn 菌种接种于固体菌种培养基与羊血固体培养基(对照),连续传代培养至15代。用生理盐水冲洗第15 代菌苔,并向菌液中加入体积分数30%的甘油,-70 ℃保存[6];并根据《中国药典》三部(2020 版)各论23 价肺炎球菌多糖疫苗中提供的方法对第15 代菌种进行检定。菌种检定项目包括培养特性、染色镜检、生化反应、胆汁溶菌试验、奥普托欣试验、荚膜肿胀试验。
1.5.2荚膜多糖相关基因测序 10 000×g离心收集第15 代菌体,利用ONT 测序技术进行第3 代全基因组测序。比对各血清型荚膜多糖合成相关的基因序列。
1.6生产适用性试验
选取3、5、9N、19F 和33F 型Spn进行生产适用性试验。
1.6.1发酵 将Spn 菌种接种于固体菌种培养基(01批)与羊血固体培养基(对照,02 批)中,经一代复苏后,分别转种于液体培养基(150 mL)中进行二代培养[7,12],菌浓度(A694)达0.4 ~0.6 后,分别转种至发酵罐(2 500 mL)中进行分批补料发酵培养[19]。
1.6.2多糖纯化 发酵培养结束后,加入0.1%脱氧胆酸钠杀菌;15 000 ×g离心去菌体,上清液经超滤后进行酸沉、醇沉,再经10 倍洗滤后得到精制多糖原液。根据《中国药典》三部(2020 版)通则3429 免疫化学法速率散射比浊法测定多糖含量。参照《中国药典》三部(2020版)相关方法,对多糖原液进行检测,包括固体总量、蛋白质含量(Lorry 法)、核酸含量(分光光度法)、总氮(凯氏定氮法)、总磷(钼酸铵法)、分子大小(CL-4B 凝胶过滤法)、氨基已糖(二氨基苯甲醛显色法)、甲基戊糖(半胱氨酸显色法)。
1.7数据采集与分析 应用Excel 软件对数据进行分析与处理。
2 结果
2.1菌种复苏用固体培养基的筛选
2.1.1初步筛选 配方1 ~9 培养基平均菌液浓度(A694)分别为0.523、0.724、0.633、1.012、0.552、1.178、1.512、1.462 和1.924,配方7、8、9 培养基菌液浓度接近或超过对照菌浓度(1.678)。
配方7、8 培养基的菌浓度最高点均高于对照,配方9 培养基在各时间节点的菌浓度均高于对照。3 种配方培养基的菌浓度达到峰值后,均有下降趋势,Spn 出现自溶现象。配方9 培养基各时间点的活菌数与其菌浓度呈正相关。见图1。因此,用配方9培养基复苏19F 型Spn 时,培养至11 ~15 h,细菌活性较高。
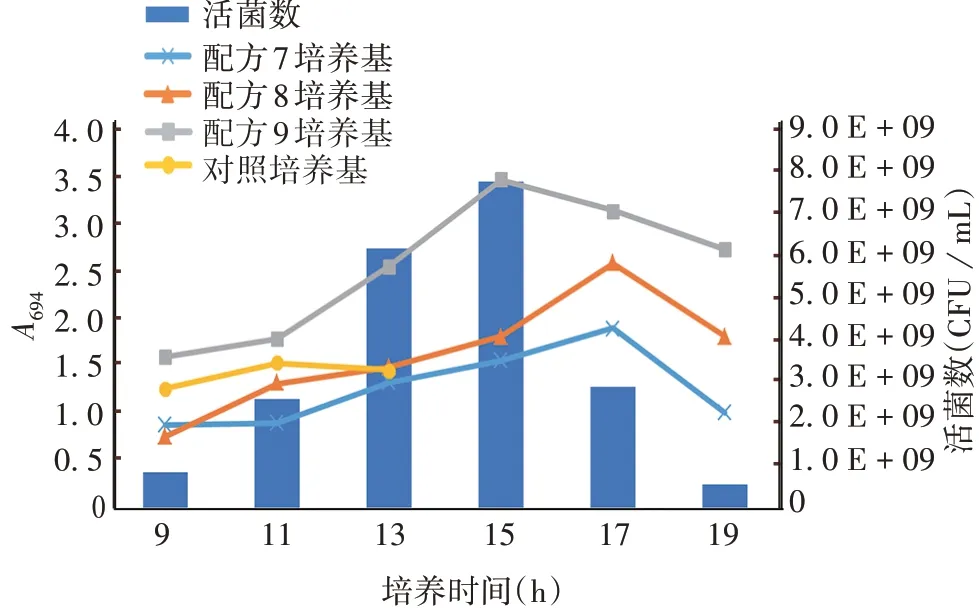
图1 配方7、8、9 培养基菌浓度对比与配方9 培养基活菌计数Fig.1 Comparison of bacterial concentration of formula 7,8,9 and viable count of formula 9
2.1.2验证 不同血清型在各时间点的活菌数量与菌浓度均呈正相关,培养至第11 h时,菌浓度与活菌数量明显增大,培养至第15 h(包括第15 h)后,菌浓度与活菌数量均出现峰值,峰值过后,菌浓度与活菌数量均有所下降。见图2。表明配方9 培养基适合复苏、扩增培养Spn,且培养至11 ~15 h 细菌的活性较高。
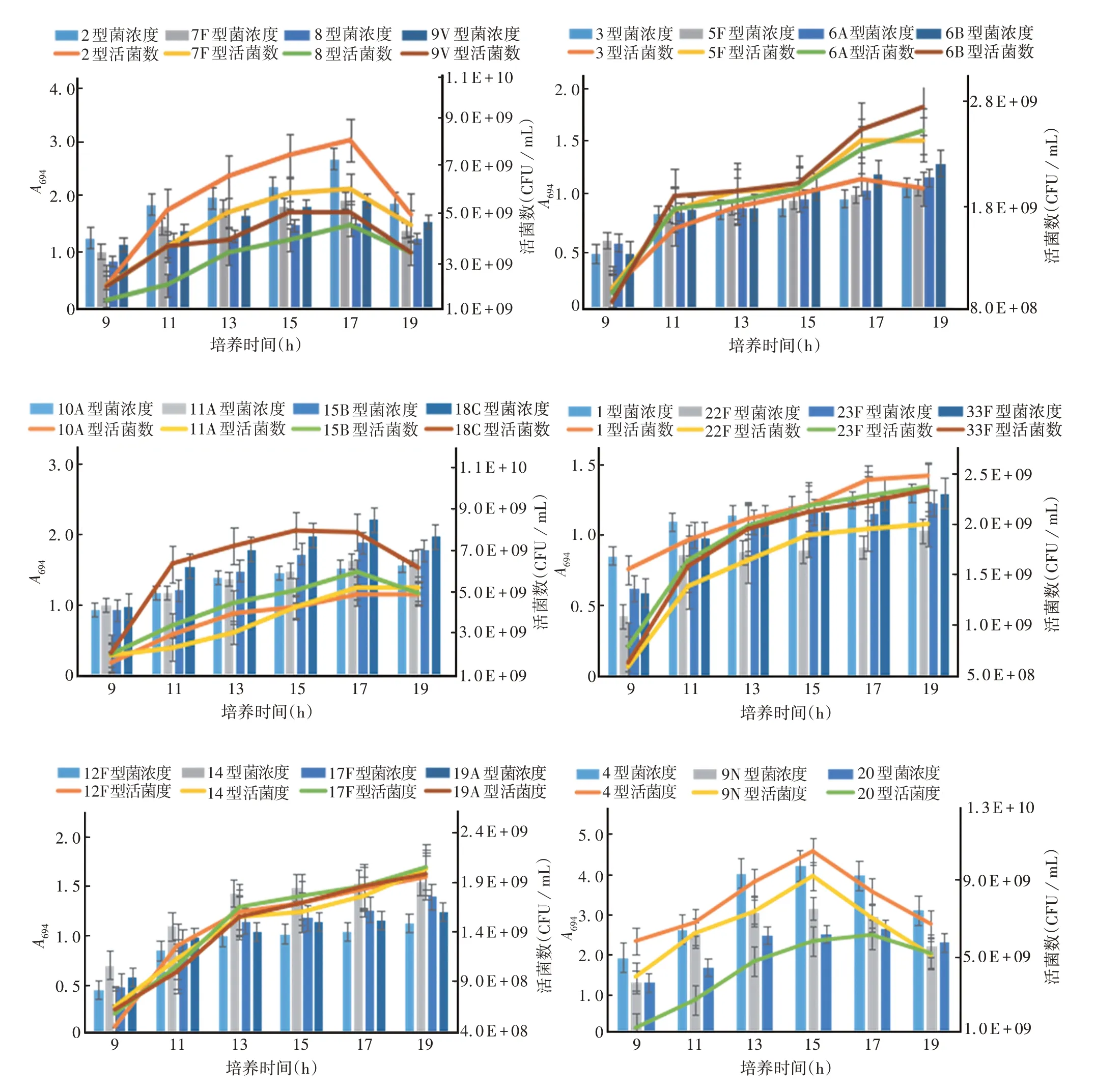
图2 各时间点不同血清型的菌浓度及活菌数量Fig.2 Bacterial concentration and viable count of various serotypes at each time node
2.2传代稳定性
2.2.1菌种检定 固体菌种培养基与羊血固体培养基(对照)传代的各血清型菌种检定结果均合格(培养特性试验均符合规定;染色镜检均为革兰阳性球菌;生化反应葡萄糖、菊糖、棉子糖、蜜二塘均为阳性,山梨醇为阴性;胆汁溶菌试验菌液均变透明;奥普托欣试验除33F 血清型对照试纸抑菌圈直径为16 mm,其余试纸抑菌圈直径均为15 mm;荚膜肿胀试验菌体周围均可见明显无色荚膜),表明固体菌种培养基复苏并传代的菌种对Spn无任何影响。
2.2.2基因序列 固体菌种培养基与羊血固体培养基(对照)传代的3、5、9N、19F、33F 型第15 代Spn 基因测序后,对靶位点基因序列进行对比,相似度均为100%。表明无动物源性固体菌种培养基对Spn的靶位基因序列无影响。
2.3生产适用性
2.3.1分批补料发酵试验 3、5、9N、19F、33F 型Spn分别用固体菌种培养基(01 批)与羊血固体培养基(02 批)复苏后,用相同的发酵培养基与发酵条件进行发酵,同一血清型两发酵生长曲线的迟缓期、对数生长期和稳定期均无明显差异,01 批最高菌浓度略高于02批。见图3。
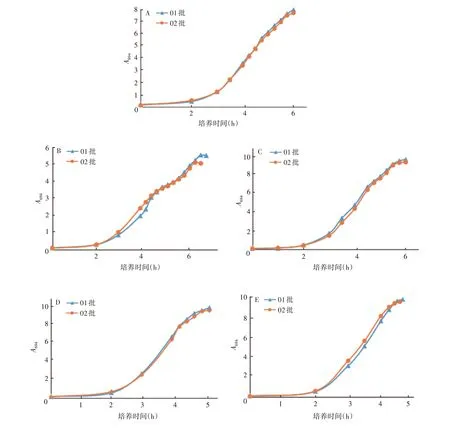
图3 Spn发酵生长曲线Fig.3 Fermentation growth curve of Spn
2.3.2多糖含量及多糖原液检测结果 固体菌种培养基复苏菌种的发酵表达量略高于对照,见表2。3、5、9N、19F、33F 型Spn 的01 批与02 批多糖原液各项检测指标均符合药典标准,见表3。

表2 发酵表达量对比Tab.2 Comparison of fermentation expression
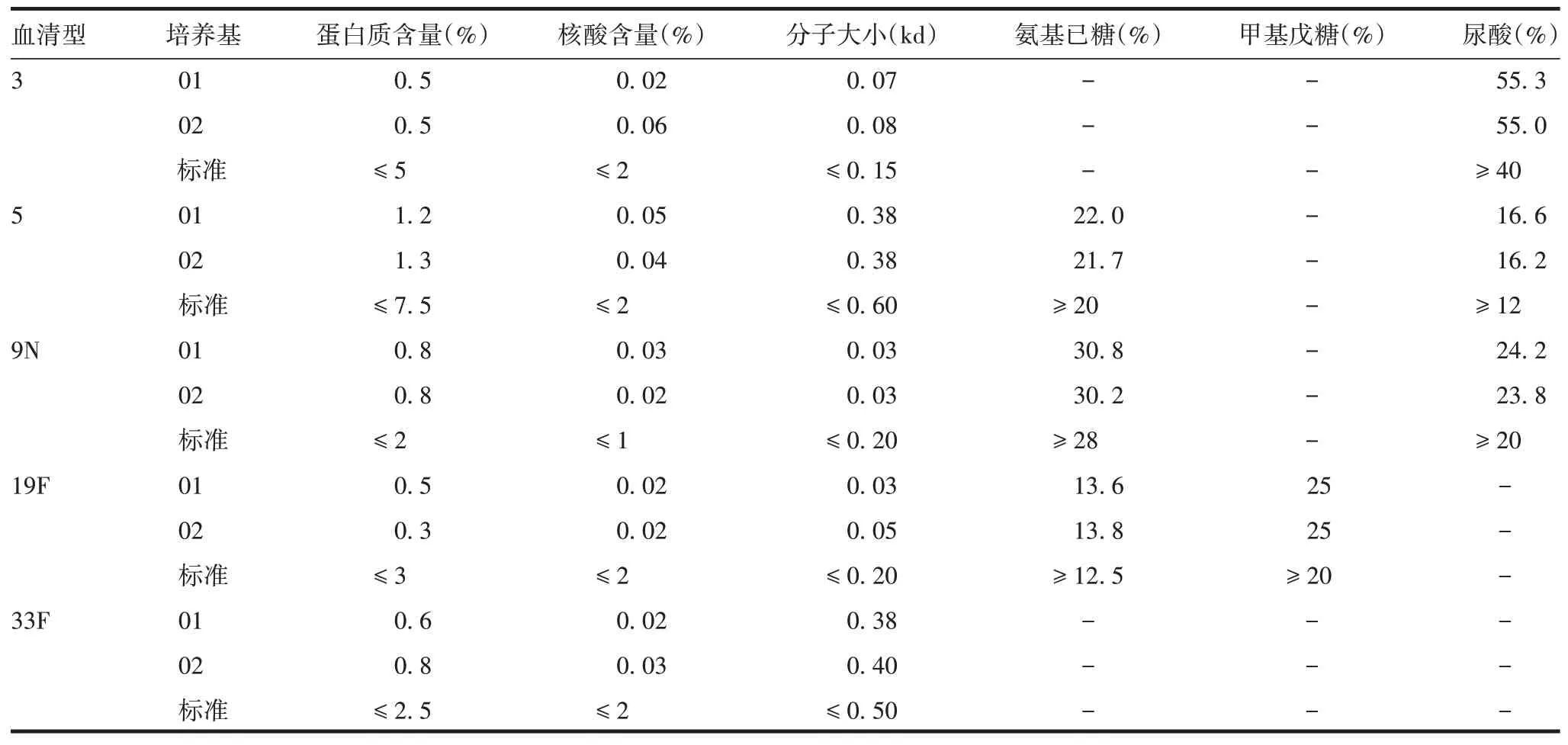
表3 Spn多糖原液检测结果Tab.3 Test results of Spn polysaccharide stock solution
3 讨论
在现有疫苗生产工艺中,培养阶段使用含有动物源成分的物料不仅易引入病毒等外源因子,物料的均一性也难以控制[8]。因此,避免使用含有动物源性的物料可减少其带来的安全隐患,同时也是国际生物制品行业发展的趋势。本研究首先选取19F血清型Spn 对无动物源材料的9 种配方培养基进行初步筛选,再对其他23 个疫苗血清型Spn 进行培养测试验证,并确定了培养至11 ~15 h时,细菌活性较高,从而完成了菌种复苏用固体培养基的筛选。在菌种传代过程中,菌种的培养特性与遗传基因可能会由于培养条件与培养基的不同而发生变化,因此进一步用筛选出的无动物源性固体培养基进了Spn的传代稳定性试验,对第15 代终末代次菌种进行检定与荚膜多糖基因测序,经对比,复苏并传代的菌种与对照无差异。发酵生长曲线可反映Spn 在发酵时的生长情况,迟缓期一般在发酵前的2 h 左右,发酵2 h 以后基本进入对数期,发酵至5 ~6 h 时,进入发酵对数后期或稳定期前期,此时可对发酵液进行杀菌并收获。Spn夹膜多糖作为保护性抗原,安全性和有效性是疫苗产品最重要的两个基本属性,Spn多糖疫苗中蛋白杂质含量、核酸含量是影响疫苗安全性的重要因素之一,而特异糖或特异基团决定疫苗的免疫原性,是保证疫苗有效性的前提条件。在用筛选出的固体培养基培养菌种进行发酵培养后,菌体生长与荚膜多糖产量略有提高,且荚膜多糖相关检定指标均符合《中国药典》三部(2020版)标准。
综上所述,无动物源性物料固体培养基适合复苏Spn 菌种,且可用于工业生产中复苏与扩增Spn。本研究为Spn 在建库、培养的整个阶段彻底去除动物源性物料奠定了基础。
