miR-148a靶向S1PR1抑制弥漫大B细胞淋巴瘤细胞增殖和迁移机制研究
2021-08-18唐懿刘彦麟宋黎
唐懿 刘彦麟 宋黎
漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)属于非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)发病率最高亚型,占NHL的30%~40%,平均发病年龄在60岁左右,男性高于女性,呈B淋巴细胞弥漫性恶性增殖[1,2]。DLBCL在临床上、遗传学、形态学均表现出异质性,目前DLBCL的发病机制还未有统一定论,最新研究表明miRNAs表达水平与其发生发展和预后有关,近年来已经成为研究的热点内容[3]。人微小RNA(microRNA,miRNA)长度为21~24个核苷酸序列,能够与靶基因3’UTR配对,降解或抑制靶基因mRNA翻译,从而调控肿瘤如细胞增殖、凋亡、侵袭、迁移等生理过程[4]。miRNAs在肿瘤中表达失调现象也十分常见。有研究表明,miR-148a低表达与肿瘤发生发展相关,上调miR-148a表达水平能够下调c-myc表达水平,抑制肺癌细胞侵袭转移[5,6]。1型1-磷酸鞘氨醇受体(sphingosine 1-phosphate receptor1,S1PR1)属于1-磷酸鞘氨醇受体家族的G蛋白偶联受体,作为机体内重要的信号传导分子,能够与其配体1-磷酸鞘氨醇(S1P)结合从而调控下游信号通路活性[7]。研究表明,S1PR1能够调控BATF3信号通路来抑制霍奇金淋巴瘤(HL)细胞增殖,发现S1PR1作为一种癌基因,能够上调许多信号通路参与肿瘤的发生发展进程[8,9]。miR-148a和S1PR1均与肿瘤发生发展关系,且在DLBCL中未见相关报道,本研究测定miR-148a mimic转染后OCI-LY19细胞miR-148a、S1PR1及相关通路蛋白表达水平,分析二者对OCI-LY19细胞增殖和迁移的影响。
1 材料与方法
1.1 仪器与试剂 胎牛血清、青链霉素双抗、胰蛋白酶购自美国Hyclone公司;DMEM培养液购自北京索莱宝科技有限公司;MTT试剂购自美国Sigma公司;总RNA提取试剂盒(DP420)购自北京天根生化科技有限公司;兔抗人S1PR1、兔抗人ERK、兔抗人p-ERK、兔抗人STAT3、兔抗人p-STAT3、兔抗人PDGF-A、兔抗人PDGF-B、兔抗人BcL-XL、兔抗人McL-1、兔抗人内参U6、羊兔二抗购自美国Bioworld公司;miR-148a mimic、miR-148a阴性对照序列购自上海生工生物公司;Multiskan FC酶标仪购自美国赛默飞公司;电泳槽和转膜槽购自美国Bio-Rad公司。
1.2 细胞培养、转染 细胞系:人B淋巴HMy2.CIR细胞、弥漫性大B细胞淋巴瘤OCI-LY19细胞均购自中科院细胞库。细胞培养:两种细胞均采用常规培养,培养基中添加1%青链霉素双抗,10%血清,培养条件:5%CO2,相对湿度98%,温度37℃。隔天换液,待细胞密度在80%~90%时胰酶消化传代,收集对数生长期细胞用于后续实验。细胞转染:将OCI-LY19细胞以1×105个/孔的密度接种到24孔板上,待细胞密度在50%左右时弃去培养液,首先将5 μl Lipofectamine TM2000与100 μl DMEM培养液混合均匀,25℃静置20 min,用培养液调整miR-148a mimic、miR-148a阴性对照序列浓度为20 μmol/L,25℃静置20 min,将miR-148a mimic、miR-148a阴性对照、等体积培养基(作为miR-148a空白对照)分别与LipofectamineTM2000混合均匀,25℃静置20 min,加入到含有OCI-LY19细胞的24孔板中。实验分组:(1)对照组;(2)miR-148a阴性对照;(3)miR-148a mimic组。
1.3 RT-qPCR检测OCI-LY19细胞miR-148a表达水平 使用试剂盒提取各组细胞中总RNA,逆转录得到cDNA,采用实时荧光定量PCR仪对miR-148a进行扩增,反应体系共20.0 μl,其中SYBR Mix10.0 μl,cDNA(25 ng/ml)2.0 μl,上下游引物(5 μmol/L)各2.0 μl,ddH2O 4.0 μl。反应条件:94℃预变性300 s,94℃变性30 s,65℃退火60 s,75℃延伸30 s,30个循环后,75℃终末延伸5 min。设置6个复孔,采用2- CT法对miR-148a表达水平进行定量分析。见表1。

表1 miR-148a 和内参U6 引物序列
1.4 蛋白印迹法(Western blotting,WB)测定OCI-LY19细胞S1PR1、ERK、p-ERK、STAT3、p-STAT3、PDGF-A、PDGF-B、BcL-XL、McL-1表达水平 实验分组同“1.2”。使用RIPA法提取并测定各组细胞总蛋白含量,蛋白以50 μg/孔加样,垂直电泳法分离所需目标蛋白,用BIO-RAD法将蛋白转至PVDF膜上,5%脱脂奶粉将结合位点封闭1 h。加入兔抗人S1PR1、兔抗人ERK、兔抗人STAT3、兔抗人p-ERK、兔抗人p-STAT3、兔抗人PDGF-A、兔抗人PDGF-B、BcL-XL、McL-1、兔抗人内参β-Actin(稀释比例均为1∶1 000),4℃孵育过夜,用PBS清洗后加入羊抗兔二抗(1∶1 000),37℃孵育30 min,PBS清洗,显色、曝光。用凝胶成像设备观察。
1.5 MTT法测定OCI-LY19细胞活性 实验分组同“1.2”,将细胞接种到96孔板上,每组设置6个复孔,培养箱培养过夜,弃取培养基,PBS清洗3次,加入不含血清的培养基继续培养。培养48 h后加入25 μl MTT(5 mg/ml)溶液,培养4 h后弃去培养液,加入150 μl DMSO溶液,100 r/min 37℃恒温震荡10 min,测定在490 nm处吸光度(optical density,OD值)。根据公式计算OCI-LY19细胞活性。细胞活性(%)=实验组OD值/对照组OD值×100%。
1.6 划痕实验测定OCI-LY19细胞体外迁移能力 实验分组同“1.2”,将OCI-LY19细胞以5×105个/孔接种到6孔板,培养箱中培养,待细胞密度70%~80%时,用灭菌后的200 μl枪头垂直于孔底,均匀划出细胞划痕,PBS清洗细胞碎片,加入无血清培养液,设置6个复孔,培养48 h后用荧光显微镜观察细胞迁移程度,拍照记录,根据公式计算细胞迁移能力。迁移能力(%)=(初始两侧距离-观察时两侧距离)/初始两侧距离×100%。
1.7 双荧光素酶实验检测miR-148a与S1PR1的靶标关系
1.7.1 荧光素酶报告实验突变型载体的制备:用TargetScan分析S1PR1序列发现,在3’UTR区域有两个miR-148a结合区域。将该区域扩增后与PGEM-T载体相连,筛选目标序列并与pGL4相连,成功构建p-GL4-S1PR1-3’UTR质粒,以此质粒为模板对S1PR1-3’UTR进行定点突变(Del1,Del2),进一步经测序筛选构建p-GL4-S1PR1-3’UTR-Del1、p-GL4-S1PR1-3’UTR-Del2和p-GL4-S1PR1-3’UTR-Del1,Del2质粒。
1.7.2 荧光素酶测试报告实验:将OCI-LY19细胞以1×105个/孔接种到24孔板,培养过夜后,将p-GL4-S1PR1-3’UTR-Del1、p-GL4-S1PR1-3’UTR-Del2和p-GL4-S1PR1-3’UTR-Del1,Del2质粒与miR-148a mimic、miR-148a阴性对照共染,设置6个复孔,转染24 h后,加入100 μl荧光素酶检测试剂,用多功能酶标仪测定吸光度,之后加入Stop&Glo试剂并测定吸光度,荧光素酶的相对活性以前后荧光强度比值表示。

2 结果
2.1 miR-148a mimic转染后OCI-LY19细胞中miR-148a、S1PR1、p-ERK、p-STAT3表达水平 与HMy2.CIR细胞组比较,OCI-LY19细胞对照组miR-148a表达水平显著降低(P>0.05),ERK、STAT3蛋白表达水平无明显变化(P>0.05),S1PR1蛋白表达水平、ERK蛋白磷酸化水平、STAT3蛋白磷酸化水平明显升高,差异有统计学意义(P<0.05)。与对照组、miR-148a阴性对照组比较,miR-148a mimic组miR-148a表达水平显著升高(P<0.05),ERK、STAT3蛋白表达水平无明显变化(P>0.05),S1PR1蛋白表达水平、ERK蛋白磷酸化水平、STAT3蛋白磷酸化水平明显降低(P<0.05)。见表2,图1。
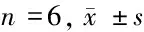
表2 miR-148a 、S1PR1 、p-ERK 、p-STAT3 表达水平

图1 S1PR1、p-ERK、p-STAT3表达水平;A HMy2.CIR细胞组;B 对照组;C miR-148a mimic组;D miR-148a阴性对照组
2.2 miR-148a mimic转染后OCI-LY19细胞活性 与对照组比较,miR-148a mimic组细胞活性显著降低降低(P<0.05),miR-148a阴性对照组细胞活性无明显变化(P>0.05)。见表3。
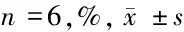
表3 miR-148a mimic 转染后OCI-LY19 细胞活性
2.3 miR-148a mimic转染后OCI-LY19细胞迁移能力 与对照组比较,miR-148a mimic组细胞迁移能力显著降低(P<0.05),miR-148a阴性对照组细胞迁移能力无明显变化(P>0.05)。见表4。
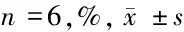
表4 miR-148a mimic 转染后OCI-LY19 细胞迁移能力
2.4 miR-148a mimic转染后OCI-LY19细胞PDGF-A、PDGF-B、BcL-XL、McL-1蛋白表达水平 与对照组比较,miR-148a mimic组PDGF-A、PDGF-B、BcL-XL、McL-1蛋白表达水平显著降低(P<0.05),miR-148a阴性对照组无明显变化(P>0.05)。见表5,图2。
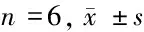
表5 miR-148a mimic 转染后OCI-LY19 细胞PDGF-A 、PDGF-B 、BcL-XL 、McL-1 表达水平
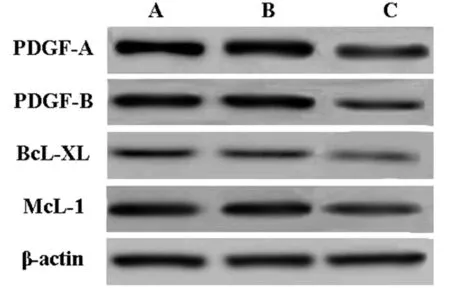
图2 PDGF-A、PDGF-B、BcL-XL、McL-1表达水平;A 对照组;B miR-148a阴性对照组;C miR-148a mimic组
2.5 miR-148a与S1PR1靶标关系 Targetscan分析表明,miR-148a序列3’UTR区存在2个S1PR1结合位点。荧光素酶报告实验显示,与p-GL4-S1PR1-3’UTR组比较,p-GL4-S1PR1-3’UTR+miR-148a mimic组的荧光素酶相对活性显著降升高(P<0.05)。与p-GL4-S1PR1-3’UTR+miR-148a mimic组比较,p-GL4-S1PR1-3’UTR-Del1+miR-148a mimic组、p-GL4-S1PR1-3’UTR-Del2+miR-148a mimic组和p-GL4-S1PR1-3’UTR-Del1,Del2+miR-148a mimic组的荧光素酶相对活性均显著降低(P<0.05)。见表6。
表6 OCI-LY19 细胞荧光素酶的相对活性
3 讨论
DLBCL临床上表现为强侵袭性和中高度恶性,约60%患者可以通过R-CHOP方案治愈,但仍有部分患者耐药,出现病情反复,预后不良[10]。
miR-148a在肿瘤组织或细胞中异常表达及调控细胞增殖、侵袭、迁移的作用受到越来越多研究者的关注,研究发现在食管癌组织中miR-148a表达水平下调,过表达miR-148a能够抑制人食管癌细胞迁移、侵袭[11]。本研究表明,与HMy2.CIR细胞相比,OCI-LY19细胞中miR-148a表达水平显著降低,提示在DLBCL细胞中miR-148a低表达,可能与DLBCL有关。研究表明,miR-148a过表达可以靶向Wnt/β-catenin信号通路,下调VEGF表达水平,抑制血管生成、细胞增殖[12]。徐桂丽等[13]研究表明miR-148a在NSCLC外周血中低表达,HPIP高表达,过表达miR-148a能够下调HPIP表达水平,从而抑制A549细胞增殖。本研究发现,与对照组比较,miR-148a mimic组细胞活性、迁移能力显著降低,而miR-148a阴性对照组无明显变化,提示上调miR-148a表达水平能够抑制OCI-LY19细胞增殖、迁移能力,推测miR-148可能通过调控某种信号通路来抑制OCI-LY19细胞增殖、迁移。
近年S1PR1促进肿瘤发生发展的作用引起研究者们的注意,S1PR1和S1PR3在卵巢癌组织中高表达,且与组织微血管密度(MVD)相关,提示S1PR1和S1PR3可能会成为评价卵巢癌预后新指标,并为其治疗提供新靶点[14]。本研究发现,与HMy2.CIR细胞相比,OCI-LY19细胞中S1PR1蛋白表达水平显著升高,提示在DLBCL细胞中S1PR1高表达,可能促进DLBCL发生发展进程。Weichand等[15]研究表明S1PR1能够调控NLRP3/IL-1β信号通路靶向肿瘤巨噬细胞促进肿瘤淋巴转移,浸润小鼠乳腺肿瘤中S1PR1的遗传缺失可防止肺转移和肿瘤淋巴管生成。随后研究表明,上调S1PR1表达水平可调节RhoA活化以加速VE-钙粘蛋白磷酸化,导致EDV增加和乳腺癌中VM减少,提示S1PR1可为乳腺癌患者的抗血管生成治疗提供新的思路[16]。本研究表明,与对照组比较,miR-148a mimic组S1PR1表达水平显著降低,提示上调miR-148a表达水平可抑制S1PR1表达,可能通过此通路抑制OCI-LY19细胞增殖、迁移。TargetScan数据库预测显示miR-148a序列3’UTR区存在2个S1PR1结合位点,双荧光素酶实验证实S1PR1是miR-148a作用靶点,说明miR-148a能够调控S1PR1表达抑制OCI-LY19细胞增殖、迁移,但是具体通过调控哪种信号通路还有待进一步。
S1PR1高表达能够激活ERK1/2信号通路,从而促进NSCLC细胞增殖和侵袭以及体内肿瘤生长,此外下调S1PR1表达水平能够抑制STAT3活性并在体外和体内抑制乳腺癌细胞的生长[17]。ERK活化后,可进一步调控c-jun,c-fos,AP-1,NF-κb等转录因子的激活,从而参与癌症的发生发展;STAT3能够调控大部分癌基因的表达,是重要的癌基因和转录因子[18]。PDGF-A、PDGF-B作为p-ERK的下游靶基因,在肿瘤中PDGF-A、PDGF-B高表达,可持续高水平地促进肿瘤细胞增殖、迁移,参与癌症发生发展。BcL-XL和McL-1是STAT3下游靶基因,能够抑制细胞凋亡,在大部分肿瘤中高表达。本研究发现,与对照组相比,miR-148a mimic组ERK蛋白磷酸化水平、STAT3蛋白磷酸化水平、PDGF-A、PDGF-B、BcL-XL、McL-1表达水平显著降低,提示miR-148a高表达,可能通过下调S1PR1表达水平进一步调控ERK/STAT3信号通路下调PDGF-A、PDGF-B、BcL-XL、McL-1表达水平,从而抑制OCI-LY19细胞增殖、迁移。
综上所述,miR-148a在弥漫大B细胞淋巴瘤细胞中低表达,上调miR-148a表达水平能够下调S1PR1表达,可能通过ERK/STAT3信号通路来抑制弥漫大B细胞淋巴瘤细胞增殖和迁移。但miR-148a在制弥漫大B细胞淋巴瘤的发生发展进程中的表达情况仍需进一步研究。
