外泌体来源的miR-1246对食管鳞状细胞癌转移和自噬的影响
2023-10-20彭美兰王璐刘丽丽闫振鹏阎婷
彭美兰,王璐,刘丽丽,闫振鹏,阎婷
山西医科大学转化医学研究中心,山西太原030001
中国是食管癌高发国家之一,发病率在我国癌症中列第6 位,死亡率列第4 位,均高于全球平均水平[1-2]。在肿瘤的发生发展中具有重要作用,包括内皮细胞、免疫细胞、成纤维细胞及各种生物活性物质,与肿瘤的发生、发展、转移等密切相关[3-5]。外泌体是直径为30~150 nm 的脂质双层膜囊泡,几乎所有活细胞均能分泌外泌体[6-7]。肿瘤微环境中富含肿瘤细胞及间质细胞分泌的外泌体,肿瘤外泌体在细胞间发挥通讯作用,可能通过外泌体提供的自分泌信号调控肿瘤的局部生长[8-9]。自噬是存在于真核细胞中高度保守的生物代谢过程,可降解细胞质中的蛋白和受损的细胞器等物质,维持细胞稳态[10-11]。SQSTM1/P62 是选择性自噬的底物,也是重要调节物,在某些肿瘤类型中,自噬具有关键的促肿瘤作用,对于支持肿瘤生长非常重要[12-13]。
微小核糖核酸(microRNA,miRNA)是长度为17~25 个核苷酸的小型非编码RNA,转录后可调节目标mRNA 的表达[14-15]。miRNA 通过与特定mRNA 的3'UTR 区结合,导致mRNA 的翻译抑制或降解[16]。外泌体在体内的稳定性极好,广泛分布于各种体液,是miRNA 理想的转运体[17-18]。研究发现,外泌体miRNA 是细胞间的重要通讯分子,可作为许多肿瘤的诊断标志物及治疗靶点,与肿瘤的转移、自噬等密切相关[17,19]。本研究通过对食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)细胞外泌体和正常食管上皮细胞外泌体进行miRNA 测序分析,筛选出差异基因miR-1246,并探究miR-1246 对ESCC 细胞迁移和自噬的影响,为后续其作用机制的深入研究奠定基础。
1 材料与方法
1.1组织样本 ESCC组织和癌旁组织均源自山西省肿瘤医院155 例食管癌患者,所有患者均通过病理学检查和影像学检查确诊为ESCC。本研究通过山西医科大学伦理委员会的伦理审批(文件号:山西医科大学伦理委员会201301 号),患者及家属均知情同意。
1.2细胞及基因序列 人ESCC 细胞株KYSE150、KYSE450、TE9 和正常食管上皮细胞系Het-1A 均购自中国科学院上海生命科学研究院细胞资源中心,由山西医科大学转化医学中心食管癌发病机理及转化研究中心重点实验室保存;人宫颈癌细胞株HeLa细胞购自中国科学院典型培养物保藏委员会细胞库;miR-1246 mimic 及其阴性对照(miR-1246 mimic NC)、miR-1246 inhibitor 及其阴性对照(miR-1246 inhibitor NC)、micrOFF inhibitor NC(5FAM)序列均购自广州锐博生物科技有限公司。
1.3主要试剂及仪器 RPMI1640基础培养液、DMEM基础培养液及胰酶均购自山西赛奥生物科技有限公司;外泌体提取试剂盒(KGPE001-10)购自江苏凯基生物技术股份有限公司;Lipofectamine 2000 转染试剂(11668-019)购自美国Invitrogen 公司;RNAiso plus试剂(9109)、反转录试剂盒PrimeScript™RT Master Mix 及TB Green®Premix Ex Taq™Ⅱ试剂均购自日本TaKaRa公司;小鼠抗GAPDH单克隆抗体(60004-1-Ig)购自美国Proteintech 公司;兔抗TSG101 单克隆抗体(ab125011)及兔抗Calnexin 多克隆抗体(ab22595)均购自美国Abcam 公司;兔抗SQSTM1/p62 多克隆抗体(5114S)购自美国Cell Signaling 公司;HRP 标记的羊抗兔IgG(BA1054)及山羊抗小鼠IgG(BA1050)均购自武汉博士德生物工程有限公司;ECL 显影液购自美国Perkinelmer 公司;纳米粒径分析仪器购自厦门福流生物科技有限公司。
1.4细胞培养 ESCC 细胞系KYSE150、KYSE450 和TE9用含10%FBS、1%青-链霉素的RPMI1640培养液,Het-1A 和HeLa 细胞用含10% FBS、1%青-链霉素的DMEM 培养液,均于37 ℃,5%CO2培养箱中培养。
1.5外泌体提取及鉴定 KYSE150细胞融合度达50%时,弃培养液,PBS 洗涤2 次,加入新鲜RPMI1640,37 ℃,5%CO2培养箱中培养48 h;收集细胞培养液,300 ×g离心10 min;收集上清,2 000×g离心10 min;收集上清,10 000×g离心30 min;收集上清,用外泌体提取试剂盒提取外泌体。电镜下观察外泌体形态,纳米粒径分析仪检测外泌体粒径。
1.6外泌体标志物的检测 采用Western blot法。BCA法测定KYSE150 细胞来源外泌体(1.5 项制备,经PBS 洗脱)及HeLa 细胞总蛋白(细胞裂解液提取)的蛋白质浓度。分别取两种蛋白样品,经10% SDSPAGE 分离后,转移至PVDF 膜上,用5%脱脂奶粉于室温封闭1 h;分别加入小鼠抗GAPDH 单克隆抗体(1∶10 000稀释)、兔抗TSG101单克隆抗体(1∶1 000稀释)、兔抗Calnexin 多克隆抗体(1∶1 000 稀释),4 ℃孵育过夜;TBST 洗涤3 次,加入HRP 标记的羊抗兔或羊抗小鼠IgG(1∶5 000 稀释),室温孵育1 h;TBST洗涤3次,ECL法显影。
1.7ESCC细胞与正常食管上皮细胞外泌体中miRNA的差异分析 按1.5 项方法提取KYSE150、KYSE450和Het-1A 细胞外泌体,送深圳华大基因股份有限公司进行RNA测序,分析Het-1A与KYSE150及Het-1A与KYSE450外泌体中的差异表达miRNA。
1.8差异表达miRNA的KEGG Pathway富集分析 于深圳华大基因股份有限公司Dr.TOM多组学数据挖掘系统中对差异表达miRNA进行KEGG Pathway富集分析。
1.9miR-1246在ESCC 肿瘤组织及癌旁组织中表达水平的检测 将155例ESCC 患者的癌组织和癌旁组织送至深圳华大基因股份有限公司进行转录组测序[20],并对测序结果进行分析。
1.10细胞转染 KYSE150细胞融合度达60%时,在Lipofectamine2000转染试剂的介导下转染miR-1246mimic及miR-1246 mimic NC,转染终浓度均为50 nmol/L。按上述方法将miR-1246 inhibitor及miR-1246 inhibitor NC、micrOFF inhibitor NC(5FAM)转染TE9细胞,转染终浓度均为100 nmol/L。转染48 h后进行后续试验。
1.11miR-1246对ESCC细胞迁移影响的检测
1.11.1过表达miR-1246 采用实时荧光定量PCR法检测转染miR-1246 mimic 及miR-1246 mimic NC 的KYSE150细胞中miR-1246的表达水平。根据NCBI中登录的人miR-1246(100302142)及GAPDH序列(2597),经Primer 3 Input在线工具设计PCR特异性扩增引物,miR-1246正向引物:5'-AATGGATTTTTGGAGCAGG-3',反向引物:5'-GTCGTATCCAGTGCAATTG-3';GAPDH正向引物:5'-CAACGACCACTTTGTCAAGCTC-3',反向引物:5'-GGTCTACATGGCAACTGTGAGG-3'。引物由生工生物工程(上海)股份有限公司合成。用RNAiso plus 试剂提取细胞总RNA,反转录试剂盒PrimeScript™RT Master Mix 反转录合成cDNA,以其为模板进行PCR 扩增。PCR 扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40 个循环;72 ℃再延伸10 min,4 ℃保存。采用Transwell 小室试验检测过表达miR-1246 对ESCC 细胞迁移影响。将上述两组细胞经0.05%胰酶消化,300 ×g离心3 min,取沉淀,PBS 洗涤1 次,用新鲜RPMI1640重悬,计数,将5×104~1×105个细胞接种至小室中,小室上方加入200µL 新鲜的RPMI1640,下方加入600µL 含20% FBS 的RPMI1640 基础培养液,于37 ℃,5%CO2培养箱中孵育36 h;并去小室上方细胞,用4%多聚甲醛固定小室下方细胞20 min;用0.4%结晶紫染色30 min。置显微镜观察并拍摄。
1.11.2抑制表达miR-1246 采用荧光标记法检测miR-1246 inhibitor NC在TE9细胞中的转染效率。采用Transwell小室试验检测抑制表达miR-1246对ESCC细胞迁移影响,方法同1.11.1项。
1.12miR-1246 对食管鳞癌细胞自噬影响的检测取1.11 项中的KYSE150 及TE9 细胞,Western blot 法检测细胞中SQSTM1/p62 蛋白含量,其中一抗为兔抗SQSTM1/p62 多克隆抗体(1∶1 000 稀释),方法同1.6 项,ECL 法显影,应用Image J 1.6.0 软件进行分析。
1.13统计学分析 应用GraphPad Prism 8.0.2 软件进行统计学分析,所有数据采用均值± 标准差(x ± s)表示,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1外泌体的鉴定 电镜下观察可见,KYSE150 细胞来源的外泌体形状完整、近似球形囊泡样结构,外形符合典型的外泌体特征,见图1。粒径为50 ~80 nm,大小符合典型的外泌体特征,见图2。外泌体标志物TSG101 蛋白(相对分子质量约45 000)呈阳性,Calnexin 蛋白(相对分子质量约75 000)呈阴性,见图3。上述结果表明,提取的外泌体质量合格,可用于后续试验。
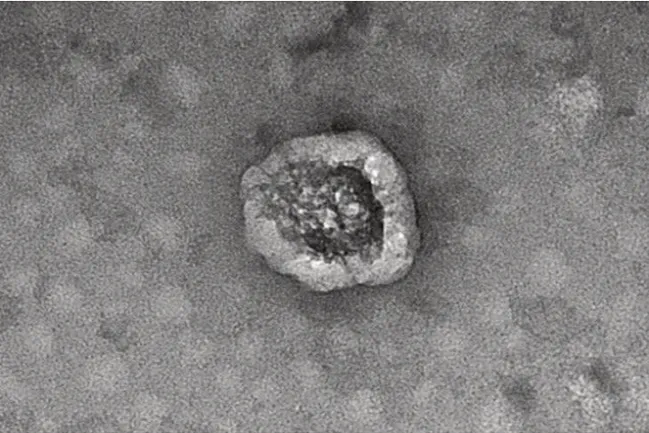
图1 外泌体形态的镜下观察(×40)Fig. 1 Morphology observation of exosomes under electron microscopy(×40)
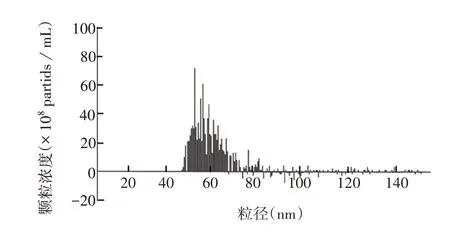
图2 外泌体粒径的分析图Fig.2 Size analysis of exosomes
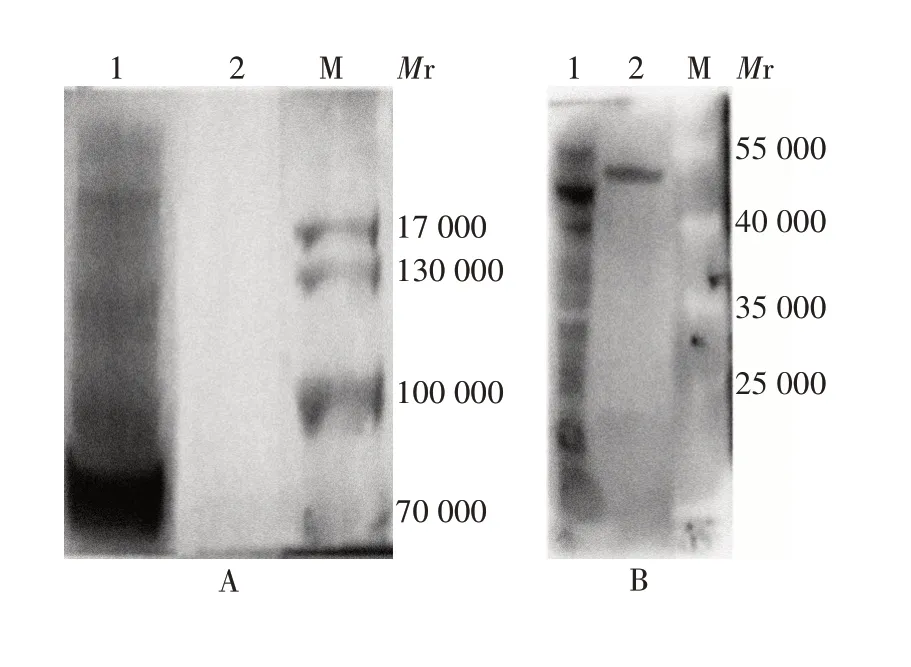
图3 Western blot 法检测外泌体标志物Calnexin(A)及TSG101蛋白(B)的表达情况Fig. 3 Western blot analysis of exosome marker proteins Calnexin(A)and TSG101(B)
2.2ESCC细胞与正常食管上皮细胞外泌体中miRNA的差异分析 Het-1A与KYSE150及Het-1A与KYSE450的差异表达miRNA 分别为105 及112 个,其中59 个为共同差异表达miRNA,上调的差异基因miRNA 共39 个。miR-1246 在Het-1A 外泌体中低表达,在KYSE450 和KYSE150 外泌体中均高表达,提示miR-1246在ESCC细胞外泌体中显著上调。见表1。
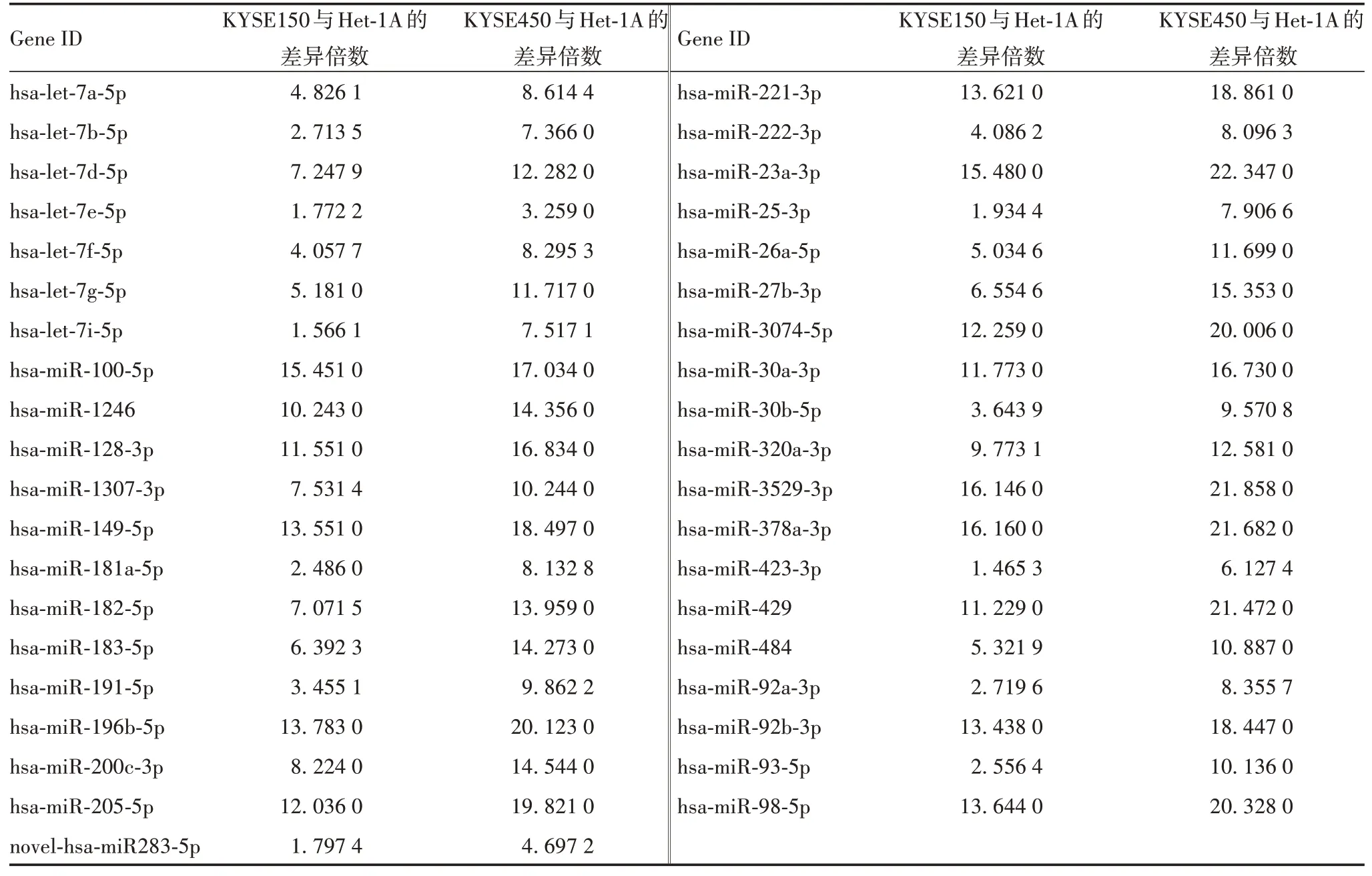
表1 Het-1A与KYSE150及Het-1A与KYSE450共表达miRNA的差异倍数Tab.1 Difference multiple of co-differentially expressed miRNA up-regulated in Het-1A and KYSE150,Het-1A and KYSE450
2.3差异表达miRNA的KEGG Pathway富集分析差异表达miRNA主要富集在自噬代谢通路上,见图4。
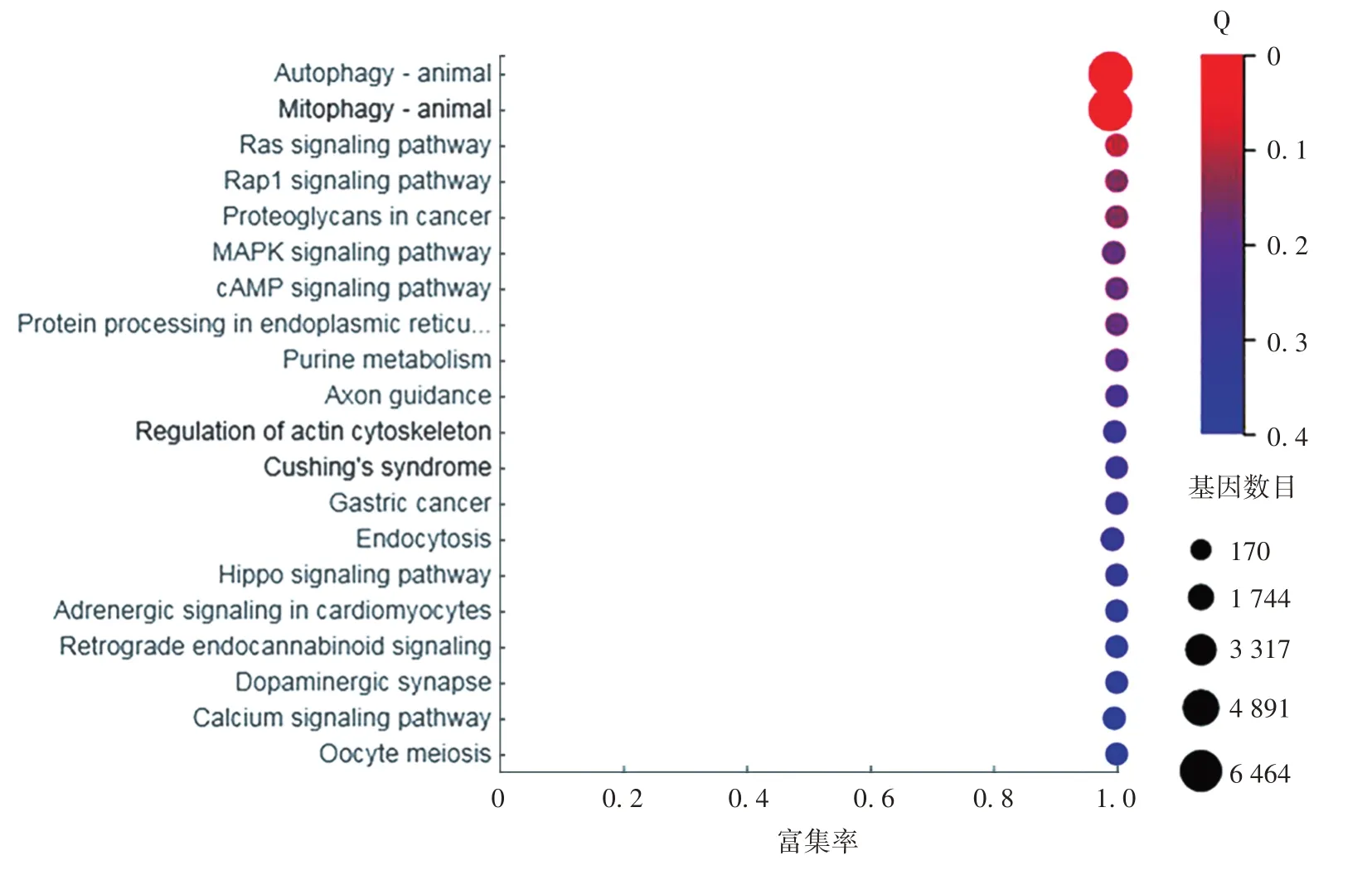
图4 差异表达miRNA的KEGG Pathway富集图Fig.4 KEGG Pathway enrichment analysis of differentially expressed miRNAs
2.4miR-1246在ESCC 肿瘤组织及癌旁组织中的表达水平 miR-1246在肿瘤组织中高表达(36.27),而在癌旁组织中表达较低(7.55),且两者差异有统计学意义(t=6.299,P<0.000 1)。大部分患者肿瘤组织中miR-1246表达量与癌旁组织的比值>1,见图5。表明miR-1246在ESCC肿瘤组织中普遍高表达。
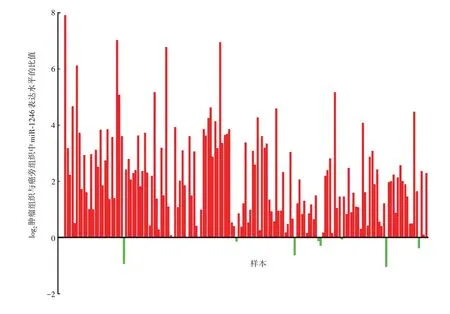
图5 miR-1246在ESCC患者肿瘤组织与癌旁组织中表达水平的比值Fig.5 Relative expression levels of miR-1246 in tumor tissues and paracancer tissues of patients with ESCC
2.5miR-1246对ESCC细胞迁移的影响
2.5.1过表达miR-1246 转染miR-1246 mimic及miR-1246 mimic NC序列的KYSE150细胞中miR-1246的相对表达量分别为1.00 和1.72,两者差异有统计学意义(t= 7.558,P<0.05);细胞迁移数量分别为169和115 个,前者明显少于后者(t=4.119,P<0.05),见图6。表明过表达miR-1246可促进KYSE150细胞迁移。
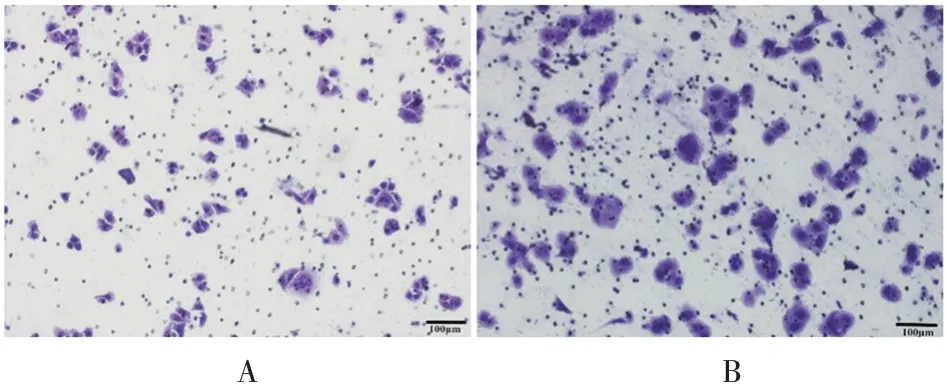
图6 转染miR-1246 mimic NC(A)及miR-1246 mimic(B)后KYSE150细胞的迁移情况(标尺:100µm)Fig. 6 Migration of KYSE150 cells after transfection with miR1246 mimic NC(A)and miR-1246 mimic(B)(scale:100µm)
2.5.2抑制表达miR-1246 miR-1246 inhibitor NC 在TE9 细胞中的转染效率达90%,见图7。转染miR-1246 inhibitor及miR-1246 inhibitor NC 的TE9细胞迁移数量分别为41和112个,前者显著少于后者(t=9.067,P<0.01),见图8。表明抑制表达miR-1246 可降低TE9细胞的迁移能力。
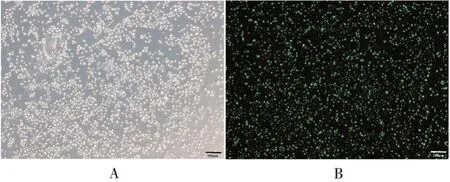
图7 miR-1246 inhibitor NC 在TE9 细胞中转染情况的镜下观察(标尺:200µm)Fig.7 Microscopic observation of transfection efficiency of miR-1246 inhibitor NC in TE9 cells(scale:200µm)
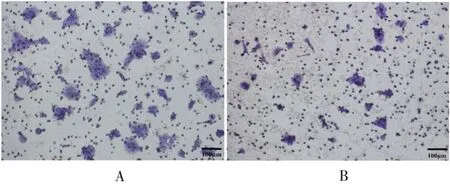
图8 转染miR-1246 inhibitor(A)及miR-1246 inhibitor NC(B)后TE9细胞的迁移情况(标尺:100µm)Fig.8 Migration of TE9 cells after transfection with miR-1246 inhibitor(A)and miR-1246 inhibitor NC(B)(scale:100µm)
2.6miR-1246对食管鳞癌细胞自噬的影响
2.6.1过表达miR-1246 转染miR-1246 mimic 及miR-1246 mimic NC 的KYSE150 细胞自噬标志物SQSTM1/p62 的相对表达水平分别为0.65 和1.00,前者显著低于后者(t= 48.150,P<0.001),见图9。表明过表达miR-1246可促进食管癌细胞自噬。
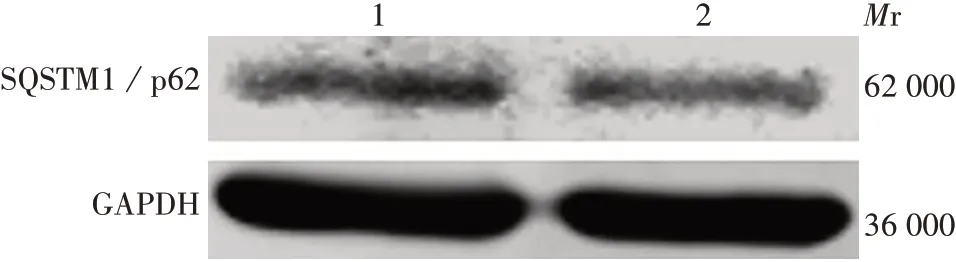
图9 过表达miR-1246对KYSE150细胞中SQSTM1/p62蛋白表达水平的影响Fig. 9 Effect of overexpression of miR-1246 on the expression level of SQSTM1/p62 protein in KYSE150 cells
2.6.2抑制表达miR-1246 转染miR-1246 inhibitor及miR-1246 inhibitor NC 的TE9 细胞中自噬标志物SQSTM1/p62 的相对表达水平分别为2.38 和1.00,前者显著高于后者(t=51.270,P<0.001),见图10。表明抑制表达miR-1246可抑制食管癌细胞自噬。
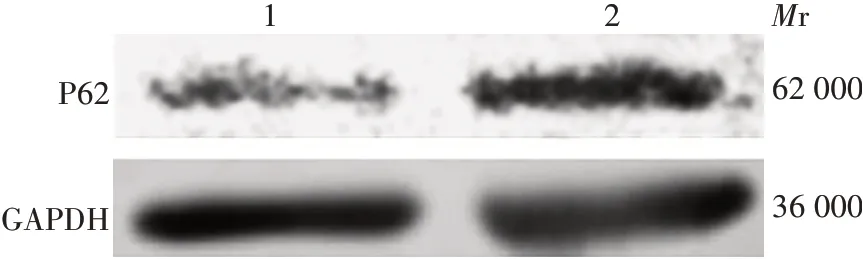
图10 抑制表达miR-1246 对TE9 细胞中SQSTM1/p62蛋白表达水平的影响Fig.10 Effect of miR-1246 inhibition on SQSTM1/p62 protein expression in TE9 cells
3 讨论
食管癌是高度恶性的消化道肿瘤之一,具有高侵袭性[21]。由于食管癌患者早期无明显症状,很难早期发现,确诊时多数为晚期且发生转移,患者5 年生存率较低[22-23]。有研究表明,在食管癌中,细胞可通过摄取肿瘤来源的外泌体改变其基因表达和表型,导致细胞周期发生变化并加速细胞的迁移活动[24]。本研究对提取的外泌体进行鉴定及RNA 测序,结果显示,miR-1246在ESCC细胞外泌体中显著上调。本研究还发现,miR-1246 在食管鳞癌肿瘤组织中普遍高表达。有文献报道,miR-1246可作为ESCC的新型诊断和预后生物标志物[25],这对于早期检测原发性ESCC 及转移,降低疾病的发病率和死亡率具有重要意义。另有研究发现,miR-1246 与上皮间质转化(epithelial-mesenchymal transition,EMT)相关,可促进肺癌的转移[26]。本研究结果表明,过表达miR-1246 可促进KYSE150 细胞迁移。推测miR-1246 可能通过EMT相关通路促进食管鳞癌的转移。
肿瘤细胞的自噬能够维持线粒体功能,减少DNA损伤,增强癌细胞对压力的抵抗力,进而促进肿瘤的代谢和生长[27]。本研究结果表明,外泌体差异miRNA主要富集在自噬代谢通路上,可促进ESCC自噬的发生,但其作用机制尚未明确。有研究在TargetScan 数据库中预测miR-1246 靶基因,结果发现,BCL2 为miR-1246 的候选靶基因,BCL2 是一种抗自噬蛋白,通过与内质网处的自噬蛋白Beclin 1的BH3结构域直接相互作用,抑制细胞自噬[28]。因此,推测在miR-1246促进ESCC 自噬过程中,BCL2 可能是miR-1246潜在的抑制靶点,但尚需进一步研究确证。
外泌体miRNA的包裹和释放均具有选择性[18,29],是通过特有的分选机制进入外泌体[18],如在健康供体的血清外泌体中,miR-21 的水平低于胶质母细胞瘤患者[30]。研究发现,miR-105 由转移性BC 细胞特异性表达和分泌,可通过外泌体分泌转移至内皮细胞,从而发挥促进肿瘤转移的作用[31]。因此,在食管癌中miR-1246 是否存在外泌体中含量远高于肿瘤组织的现象,是否通过特殊分选机制被特异性包裹进入外泌体,值得深入研究。通过这种机制,肿瘤细胞选择性释放miR-1246,成为肿瘤微环境中的组成部分,从而反向促进食管癌细胞自噬和转移。但在该过程中,外泌体是否通过影响中间受体细胞促进食管癌细胞转移,需要进一步探讨。
综上所述,miR-1246可促进ESCC细胞的自噬和转移,为基于外泌体组成的食管癌肿瘤微环境的研究奠定了基础。
