中药单体对黄嘌呤氧化酶的抑制作用
2023-06-04于媛芳赵启文
于媛芳,赵启文,李 振
(临沂大学 医学院,山东 临沂 276000)
0 引言
痛风是一种代谢性疾病,危害严重,近年来患病率呈上升趋势。其主要病因分为两类,即尿酸排泄减少及尿酸生成增多所致。而高尿酸又与多种疾病密切相关,治疗痛风、预防痛风复发的重要措施为降低血尿酸水平[1]。尿酸生成过程中的关键是酶黄嘌呤氧化酶(Xanthine oxidase,XOD)[2],其主要存在于哺乳动物的乳汁和肝脏中。人体内,黄嘌呤氧化酶(XOD)的主要作用是作为催化剂催化次黄嘌呤,通过氧化作用转化为黄嘌呤,最终转化生成尿酸。当XOD活性较高时,尿酸在血液中含量增多,高于正常值,临床表现为高尿酸血症,并随着尿酸盐的不断沉积引发痛风。
目前临床上,别嘌呤醇是主要的XOD抑制剂,但其存在严重的毒副作用,约2%的患者对此药物过敏,3%~10%的患者在治疗过程中会出现不良反应,这限制了其临床应用[3]。本研究选取12种中药单体进行体外实验,挑选出在体外具有较强抑制率的中药单体并进行小鼠体内实验,筛选出在体外体内均有高抑制率的单体,以期为抗痛风药物的开发提供理论依据。
1 实验耗材及仪器
1.1 试药
KH2PO4、K2HPO4·3H2O、EDTA-2Na、黄嘌呤(Xanthine,XA)、黄嘌呤氧化酶(Xanthine oxidase,XOD)、别嘌醇(Allopμrinol)、木犀草素、紫草素、异绿原酸A、鞣花酸、没食子酸、木犀草苷、原花青素、秦皮素、槲皮苷、丹酚酸B、金丝桃苷、槲皮素。
1.2 仪器
电子天平(万分之一)、数控超声波清洗器、容量瓶、酶标仪、移液枪、96孔板。
2 实验方法
2.1 溶液配制
缓冲液的配制:精密称取KH2PO40.478 0 g、K2HPO4·3H2O 3.473 0 g及EDTA-2Na10.00 mg,置于250 mL容量瓶中用蒸馏水定容即得。
黄嘌呤底物的配制:精密称取1.825 mg黄嘌呤,加入缓冲液,定至25.00 mL,超声溶解即得。黄嘌呤溶液需要现用现配,以确保研究结果的准确性。
XOD溶液的配制:取XOD(规格9 Μ/mg)精密称取0.001 9 mg,用150.00 mL缓冲液稀释,制备5 Μ/mL黄嘌呤氧化酶溶液。
中药单体溶液的配制:用万分之一天平精密称取0.005 0 g各中药单体,选用合适的溶剂,分别配制100.00、50.00、25.00 μg/mL中药单体溶液。
2.2 加样
反应体系总体积为200 μL,反应时先加缓冲液,加入药物和XOD,37 ℃孵育10 min,孵育完毕后再加入黄嘌呤,立刻启动酶标仪进行吸光度检测。
2.3 计算公式

3 实验结果
3.1 木犀草素对XOD的影响
木犀草素对黄嘌呤氧化酶的抑制作用随着浓度的增加抑制率逐渐加强,当浓度为100 μg/mL时,抑制率达到74.48%,明显高于别嘌醇40.13%;IC50为59.52 μg/mL,明显低于别嘌醇108.69 μg/mL。实验结果与郝悦等(2019)采用改良的HPLC法测定木犀草素对黄嘌呤氧化酶抑制率结果一致[3]。木犀草素能够影响XOD活性中心的形成,进而使酶的催化活性降低[5]。

图1 木犀草素对XOD抑制率的影响Fig.1 Effect of luteolin on the inhibitory rate of XOD
3.2 金丝桃苷对XOD的影响
金丝桃苷的抑制作用较弱且变化趋势不明显,最高抑制率为13.79%。与王敏等(2022)报道的金丝桃苷IC50值为(162.059±2.291)μmol/L的结果差异较大[6]。
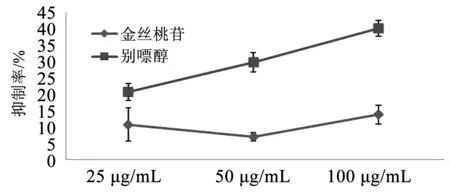
图2 金丝桃苷对XOD抑制率的影响Fig.2 Effect of hyperin on the inhibitory rate of XOD
3.3 没食子酸对XOD的影响
没食子酸浓度25~100 μg/mL,最高抑制率可达21.24%。没食子酸浓度分别为5、10、15、25、50 μmol/L时,其抑制率为15%~20%,与报道结果吻合[7]。但随着没食子酸浓度的增加,对黄嘌呤氧化酶的抑制作用下降。
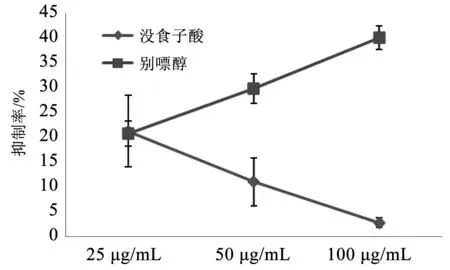
图3 没食子酸对黄嘌呤氧化酶抑制率的影响Fig.3 Effect of gallic acid on the inhibition rate of Xanthine oxidase
3.4 秦皮素对XOD的影响
秦皮素浓度分别为25、50、100 μg/mL时,最高抑制率为8.81%,随着浓度的升高,抑制作用减弱。
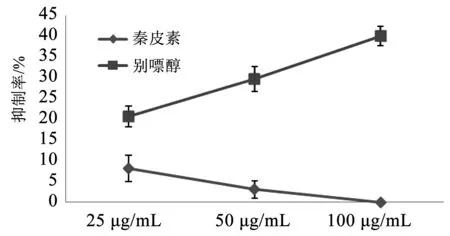
图4 秦皮素对XOD抑制率的影响Fig.4 Effect of aesculin on the inhibitory rate of XOD
3.5 异绿原酸A对XOD的影响
异绿原酸A浓度分别为25、50、100 μg/mL时,最高抑制率为13.15%,且浓度越高,抑制作用越低。
3.6 槲皮素对XOD的影响
槲皮素具有较强的抑制作用,随着药物浓度的升高,抑制率不断增强,当浓度为100 μg/mL时,抑制率为50.45%;IC50为94.34 μg/mL,抑制作用优于别嘌醇,与郝悦等(2019)报道结果基本一致[3]。槲皮素通过氢键结合到XOD活性中心的钼原子周围,阻碍了底物黄嘌呤进入XOD活性中心,从而抑制了XOD对黄嘌呤的催化活性[8]。
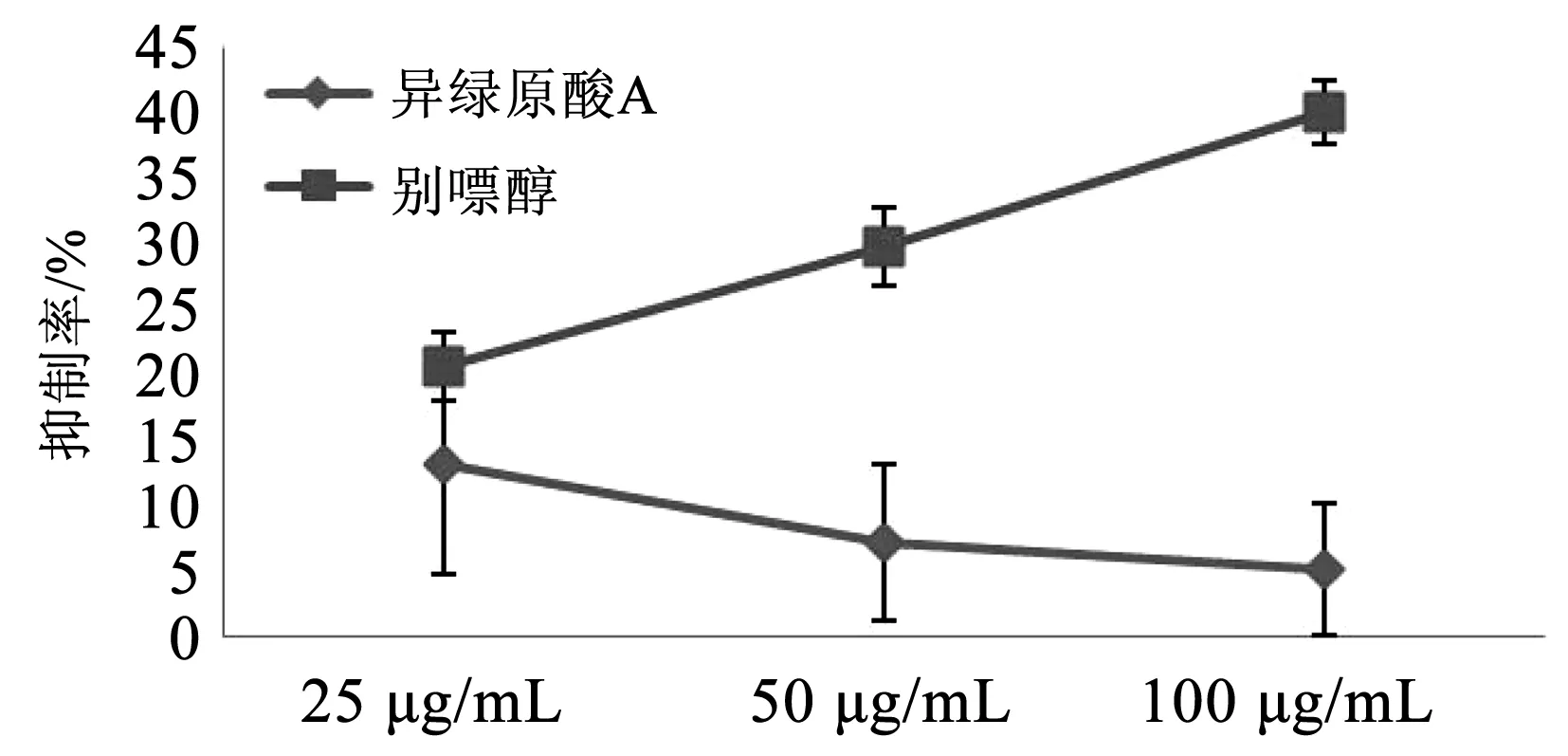
图5 异绿原酸A对XOD抑制率的影响Fig.5 Effect of isochlorogenic acid A on the inhibitory rate of XOD

图6 槲皮素对XOD抑制率的影响Fig.6 Effect of quercetin on the inhibitory rate of XOD
3.7 紫草素对XOD的影响
紫草素对黄嘌呤氧化酶的抑制作用很弱,当浓度为100 μg/mL时,抑制率为9.23%,远低于别嘌醇。
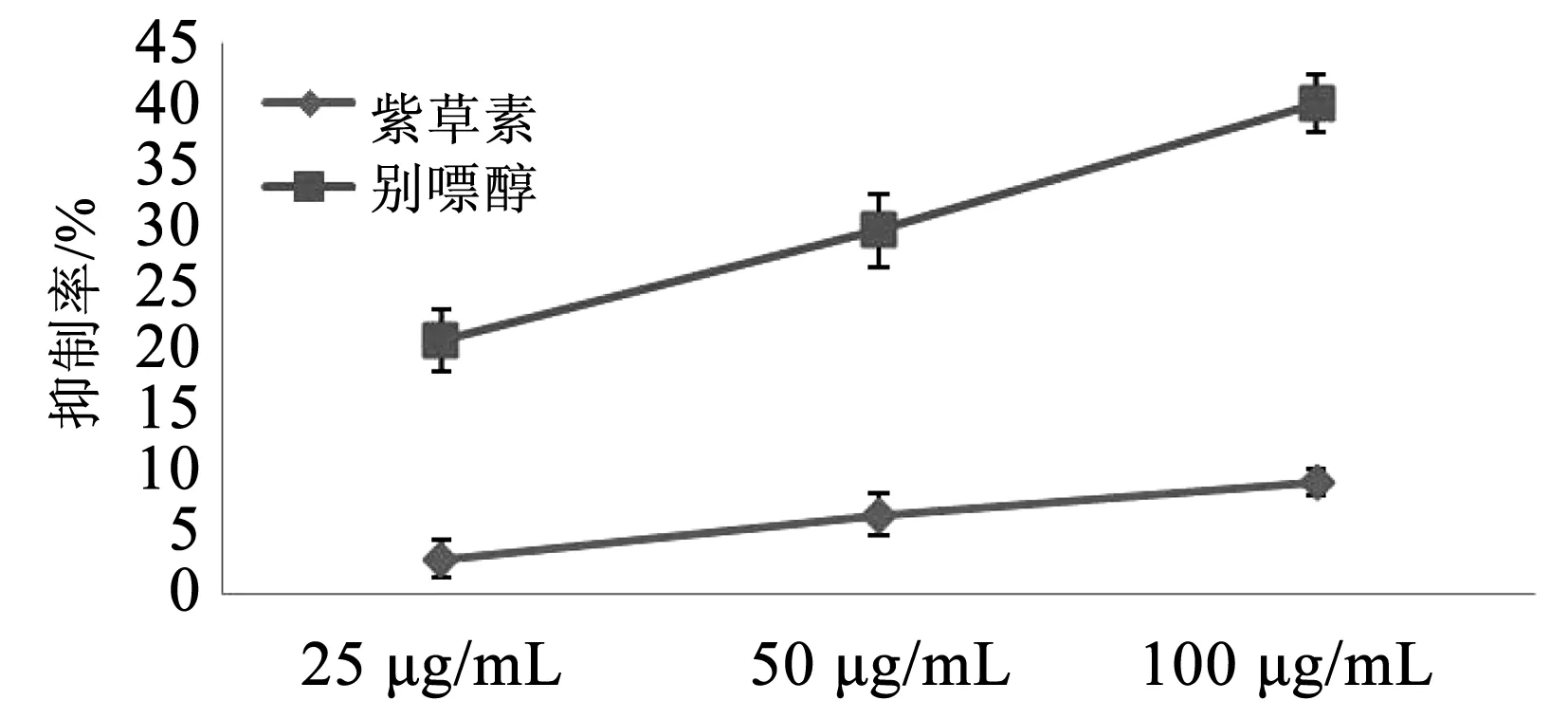
图7 紫草素对黄嘌呤氧化酶的抑制率Fig.7 Inhibition rate of xanthine oxidase by shikonin
3.8 原花青素对黄嘌呤氧化酶的影响
原花青素对黄嘌呤氧化酶的抑制作用极弱,最高抑制率为4.21%。

图8 原花青素对XOD抑制率的影响Fig.8 Effect of proanthocyanidin on the inhibition rate of XOD
3.9 槲皮苷对XOD的影响
槲皮苷的抑制作用随着浓度的升高抑制率不断增强,最高抑制率为32.41%,抑制作用较为明显,IC50为135.14 μg/mL。槲皮苷类属于黄酮类物质,对黄嘌呤氧化酶活性的抑制作用较强[9]。

图9 槲皮苷对XOD抑制率的影响Fig.9 Effect of proanthocyanidin on the inhibition rate of XOD
3.10 木犀草苷对XOD的影响
木犀草苷的抑制作用随着浓度的升高抑制率不断增强,当浓度为100 μg/mL时,抑制率为32.35%,抑制作用较别嘌醇弱,IC50为156.25 μg/mL。

图10 木犀草苷对XOD的抑制率的影响Fig.10 Effect of luteolin on the inhibitory rate of XOD
3.11 丹酚酸B对XOD的影响
丹酚酸B对黄嘌呤氧化酶的抑制作用较弱,当浓度为100 μg/mL时,抑制率为7.67%,抑制作用远低于别嘌醇。
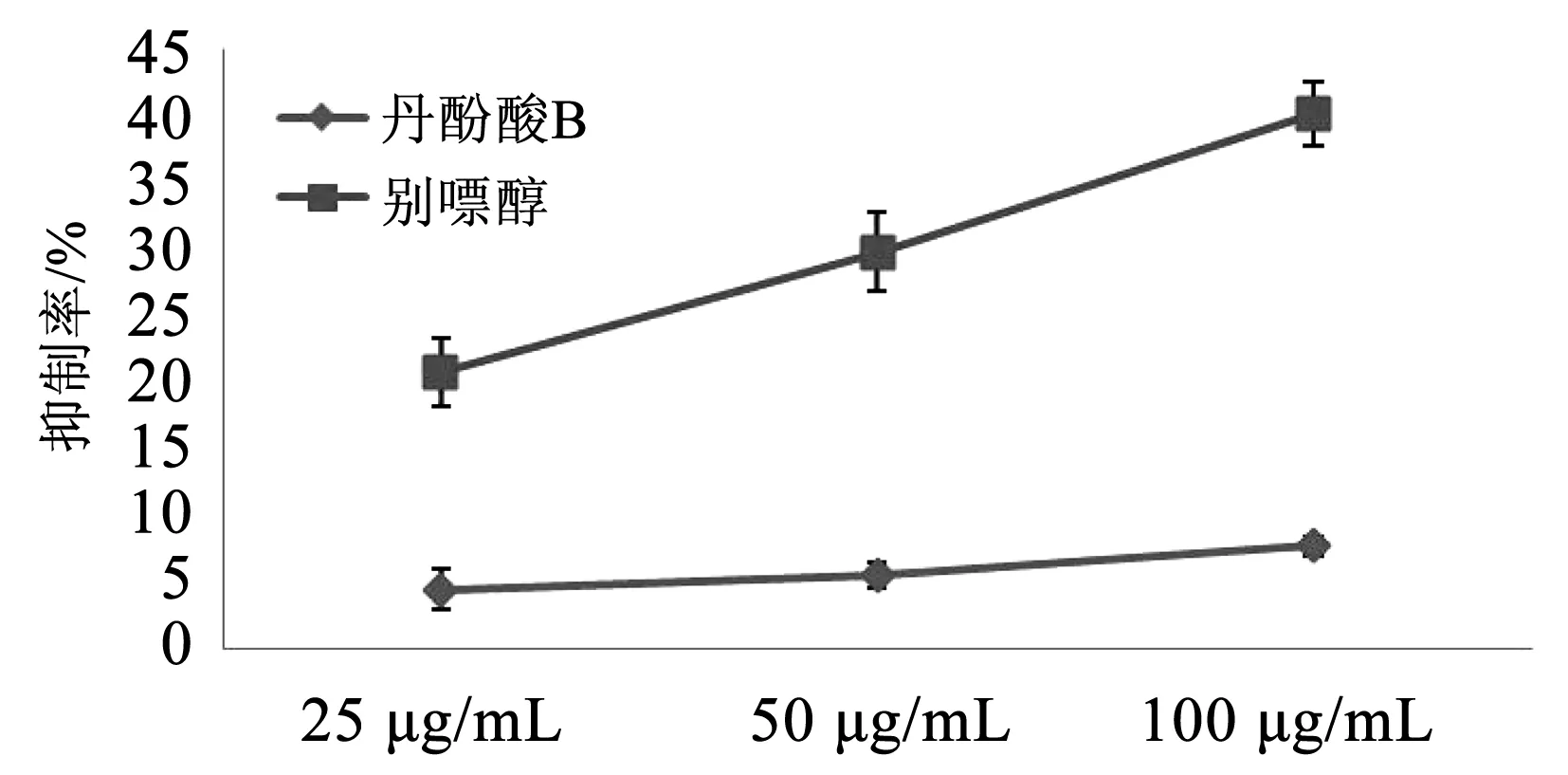
图11 丹酚酸B对XOD抑制率的影响Fig.11 Effect of salvianolic acid B on the inhibitory rate of XOD
3.12 鞣花酸对XOD的影响
鞣花酸的抑制率随着浓度的升高抑制率增加,当浓度为100.00 μg/mL时,抑制率为35.30%,IC50为125 μg/mL,但作用效果低于别嘌醇。

图12 鞣花酸对XOD抑制率的影响Fig.12 Effect of ellagic acid on the inhibitory rate of XOD
4 结论
研究结果表明,木犀草素、木犀草苷、槲皮素、槲皮苷、鞣花酸、别嘌醇的浓度为100 μg/mL时,对黄嘌呤氧化酶抑制率分别为74.48%、32.35%、50.45%、32.41%、35.30%、40.13%,IC50分别为59.52、156.25、94.34、135.14、125.00、108.69 μg/mL。木犀草素、槲皮素对XOD抑制作用较强,高于别嘌醇,可作为XOD抑制剂进一步探讨其在体内降尿酸、抗痛风的效果及作用机制。
