抗磷脂酰肌醇蛋白聚糖3抗体定点偶联药物的制备及其抗肿瘤活性评价
2023-10-20孙召朋沈明月唐昭娜袁灿王欣彭秀娥王翠惠希武刘伯宁姚兵
孙召朋,沈明月,唐昭娜,袁灿,王欣,彭秀娥,王翠,惠希武,刘伯宁,姚兵
1.石药集团巨石生物制药有限公司,河北石家庄 050000;2.石药集团新型药物制剂与辅料国家重点实验室,河北石家庄050000
肝癌是一种常见的恶性肿瘤,乙型肝炎病毒感染是导致肝癌的一个重要因素,我国乙型肝炎病毒感染患者基数大,导致我国肝癌的发病率和死亡率形势尤为严峻[1-3]。磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)蛋白是硫酸乙酰肝素糖蛋白(heparan sulfate proteoglycan,HSPG)家族中的一员,是一类分布在细胞膜表面的蛋白聚糖,其通过糖基磷脂酰肌醇(glycosyl phosphatidyl inositol,GPI)锚定在细胞外膜上[4]。GPC3蛋白在成人组织中不表达或低表达,在肝癌组织中特异性高表达,可作为肝癌治疗的靶点[5-6]。
抗体偶联药物(antibody-drug conjugate,ADC)兼具传统小分子化疗的杀伤效应及抗体药物的肿瘤靶向性[7-8],在临床应用中体现了较好的安全性、有效性以及更宽的治疗窗,成为肿瘤靶向治疗领域的研究热点和重要的发展方向[9-11]。定点偶联技术因其化学剂量比可控、同质性更强等优势得到了更大的发展[12-13]。
本研究通过杂交瘤技术制备结合好、内吞快的抗GPC3 单克隆抗体,并通过定点偶联技术将海兔毒素衍生物MMAE(monomethyl auristatin E)偶联至抗体重链,获得抗体药物比(antibody drug ratio,DAR)为2的药物分子,为GPC3免疫疗法靶向实体瘤奠定基础。
1 材料与方法
1.1细胞及质粒 HEK293细胞购自南京科佰生物科技有限公司;CHO K1细胞购自赛百慷(上海)生物技术股份有限公司;小鼠骨髓瘤细胞SP2/0-Ag14、肝癌细胞Hep3b、HepG2 和pcDNA3.1 表达载体由石药集团巨石生物制药有限公司保存;大肠埃希菌TOP10感受态细胞购自天根生化科技(北京)有限公司。
1.2实验动物 SPF 级BALB/c 小鼠3 只,雌性,6 ~8 周龄,体质量20 ~30 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-006。本实验均以科研为目的对BALB/c小鼠进行养殖和使用,相关程序均根据实验动物评估和认证协会(AAALAC)的指导。
1.3主要试剂及仪器 质粒小提试剂盒购自天根生化科技(北京)有限公司;LND1002 购自联宁(苏州)生物制药有限公司;mTgase 酶由石药集团巨石生物制药有限公司生产,Luria-Bertani 培养基由该实验室配制;ProteinA 亲和层析柱5 mL MabSelect Sure 购自美国GE Healthcare 公司;Ribi 免疫佐剂购自美国Ribi Immnuochem Res-earch Inc;HRP 标记的山羊抗人IgG、HRP 标记的山羊抗鼠IgG、Alexa Fluor 488 标记的羊抗人IgG、Alexa Fluor 488 标记的羊抗鼠IgG均购自北京Solarbio 科技有限公司;原研抗体GC33购自瑞士Roche Holding AG 公司;重组人GPC3 抗原购自中国ACRO Biosystems公司。
1.4抗原基因构建及稳定细胞系制备 从NCBI 数据库调取GPC3 的mRNA 序列(NM_004484.4)和氨基酸序列(NP_004475.1),将全长GPC3基因克隆至pcDNA3.1 表达载体,转化至大肠埃希菌TOP10 感受态细胞进行扩增,用无菌Luria-Bertani培养基,于37 ℃,220 r/min 培养16 ~24 h,离心收集菌体,用质粒小提试剂盒提取质粒,测序无误后分别电转染HEK293和CHO K1 细胞,使用遗传霉素硫酸盐加压筛选,获得高表达GPC3的稳定细胞系单克隆。HEK293-GPC3用于小鼠免疫,CHO K1-GPC3(4E1 克隆)用于筛选检测。DNA合成及测序由南京金斯瑞生物科技有限公司完成。
1.5动物免疫 将1×107个HEK293-GPC3细胞与Ribi佐剂混匀并乳化,经小鼠四肢内侧各皮下注射25µL,共100 µL,腹腔注射100 µL,共注射3 次,间隔7 d;第28 天经尾静脉采血;第28 和35 天各加强免疫1次:将5×106个HEK293-GPC3细胞与等体积PBS 混匀,经小鼠四肢内侧各皮下注射25µL,共100µL,腹腔注射100 µL;第38 天无菌环境中取小鼠脾脏,分离淋巴细胞。
1.6杂交瘤细胞制备及筛选 将小鼠脾脏淋巴细胞与小鼠骨髓瘤细胞SP2/0-Ag14 通过电融合方式进行融合,融合后的细胞静置10 min 后移入HAT 筛选培养基,37 ℃培养1 h;接种于96孔板,2×104个/孔,7 d后用Medium E 培养基培养,2 d后进行检测:用重组人GPC3抗原包被96孔板,1µg/孔,2 ℃孵育过夜;加入杂交瘤融合上清,100µL/孔,再加入HRP标记的山羊抗鼠IgG(1∶10 000 稀释),通过ELISA 检测挑选A450值高于2.0 的克隆孔进行流式细胞荧光分选技术(fluorescence activated cell sorter,FACS)筛选:将CHO K1-GPC3细胞加入96孔板,2×105个/孔,加入杂交瘤上清,50µL/孔,再加入Alexa Fluor 488标记的羊抗鼠IgG(1∶10 000 稀释),通过流式细胞仪读取荧光强度,挑取荧光强度最高的10 株进行亚克隆,将亚克隆筛选到的阳性克隆分别命名为4-22E10-G7、1-15C8-2H6、66B6-1A6、1E7-1D4、16C8-8E6,测序由南京金斯瑞生物科技有限公司完成。将筛选到的5 个克隆可变区与人IgG1 恒定区构建嵌合抗体,通过HEK293 瞬转表达,利用ProteinA 亲和层析柱纯化抗体。
1.7嵌合抗体结合活性的检测
1.7.1蛋白水平结合活性 采用ELISA法。用重组人GPC3抗原包被96孔板,1µg/孔,2 ℃孵育过夜;PBST洗涤3次,加入10倍梯度稀释的嵌合抗体,浓度分别为100、10、1、0.1、0.01、0.001 和0.000 1 nmol/L,37 ℃孵育1 h;PBST 洗3 次,加入HRP 标记的山羊抗人IgG(1∶10 000 稀释),37 ℃孵育1 h;PBST 洗涤3次,避光条件下加入TMB 底物溶液显色,避光孵育15 min;加入2 mol/L 硫酸终止反应,用酶标仪测定450 nm 波长处的吸光度值(A450)。试验重复2 次,计算平均值。
1.7.2细胞水平结合活性 采用FACS 法。将对数生长期的高表达GPC3稳转株4E1克隆及GPC3抗原高表达肝癌细胞株Hep3b、HepG2 计数后调整细胞密度为2×105个/mL,接种于96孔板,100µL/孔,加入待测抗体,每个嵌合抗体设2个复孔,4 ℃孵育2 h;离心收集细胞,PBS洗涤3次,加入Alexa Fluor 488标记的羊抗人IgG(1∶10 000稀释),4 ℃孵育1 h;离心,PBS洗涤3次,用100µL PBS重悬细胞,FACS读数检测。试验重复2次,计算平均值。
1.8嵌合抗体内吞的检测 收集4E1细胞,用DMEM完全培养基重悬,轻柔吹打至单细胞悬液,采用台盼蓝染色法鉴定细胞活力并进行细胞计数。调整细胞密度为1×106个/mL,加入96孔板,100µL/孔,再加入待测抗体,每个嵌合抗体设2 个复孔,分别于4和37 ℃孵育3、6、24和48 h;离心收集细胞,用PBS洗涤3 次,加入Alexa Fluor 488 标记的羊抗人IgG(1∶10 000 稀释),4 ℃孵育1 h;离心收集细胞,用PBS 洗涤3 次后,用100 µL PBS 重悬,FACS 分别检测4 与37 ℃细胞表面GPC3,并按下式计算内吞率。
1.9ADC 的制备 将LND1002 25 µL/10 mg 抗体(LND1002 用DMSO 溶解为20 mmol/L)、10 × 反应缓冲液、16C8-8E6 抗体、mTgase 酶、H2O 按顺序用蠕动泵转入有弹性的乙烯-醋酸乙烯酯一次性反应袋中,反应袋密封混匀后置30 ~37 ℃反应48 ~168 h。mTgase 酶可识别抗体重链第295 位谷氨酰胺作为反应底物与LND1002 形成异肽键,反应过程每24 h取样,采用反相高效液相色谱(reversed phase-high performance liquid chromatography,RP-HPLC)分析偶联反应修饰率,当偶联反应修饰率达95%时,结束反应,使用ProteinA 亲和层析柱纯化ADCs,采用RPHPLC 检测DAR 值,尺寸排阻高效液相色谱(size exclusion chromatography-high performance liquid chromatography,SEC-HPLC)分析纯度。
1.10ADC 对肿瘤细胞增殖活性影响的检测 将对数生长期的GPC3高表达的肝癌细胞Hep3b和HepG2经胰蛋白酶消化后,制成单细胞悬液,采用台盼蓝染色法鉴定细胞活力并进行细胞计数。调整细胞密度为1 × 105个/mL,加入96 孔黑色平底细胞培养板,100 µL/孔,再加入稀释好的梯度浓度的供试品,20µL/孔,置于37 ℃,5%CO2细胞培养箱中孵育(66±3)h;加入刃天青钠溶液(0.03%),20µL/孔,37 ℃作用3 ~4 h,酶标仪550/610 nm 波长处读取吸光度值。试验同时设无药对照组和无细胞空白对照组,按下式计算细胞存活率。利用Prism 或同类作图软件作图,拟合出参考标准品和样品的半数抑制浓度(IC50)。
1.11统计学分析 利用GraphPadPrism 9 处理实验数据,两组间差异性比较采用Student's t检验,以P<0.05为差异有统计学意义。
2 结果
2.1嵌合抗体的结合活性
2.1.1蛋白水平结合活性 ELISA 检测结果表明,4-22E10-G7、1-15C8-2H6、66B6-1A6、16C8-8E6 嵌合抗体及原研抗体GC33 的EC50分别为(2.12 ± 0.11)、(1.23±0.08)、(421±13)、(2.51±0.09)和(4.54±0.21)ng/mL,16C8-8E6嵌合抗体与原研抗体GC33的结合活性差异无统计学意义(t=3.08,P=0.10)。
2.1.2细胞水平结合活性 FACS检测结果表明,16C8-8E6嵌合抗体对4E1、Hep3b、HepG2的结合能力明显优于其他嵌合抗体,且结合活性为原研抗体GC33的2 ~10 倍,差异有统计学意义(t分别为14.9、13.0 和12.9,P=0.025),见表1。
表1 不同克隆FACS亲和力分析(荧光强度,±s,n=2)Tab.1 Affinity analysis of different clones by FACS(fluorescence intensity,±s,n=2)

表1 不同克隆FACS亲和力分析(荧光强度,±s,n=2)Tab.1 Affinity analysis of different clones by FACS(fluorescence intensity,±s,n=2)
注:a表示与GC33抗体比较,P <0.05。
?
2.2嵌合抗体的内吞率 16C8-8E6 内吞最快,3 h 内吞率为45.6%,6 h 为54.2%,24 h 为68.9%,48 h 达73.9%;GC33 次之,各时间点其内吞率均低于16C8-8E6,48 h内吞率仅为66.2%;其他克隆内吞较差,48 h内吞率均低于60%。见图1。因此选择16C8-8E6(简称8E6)制备ADC。
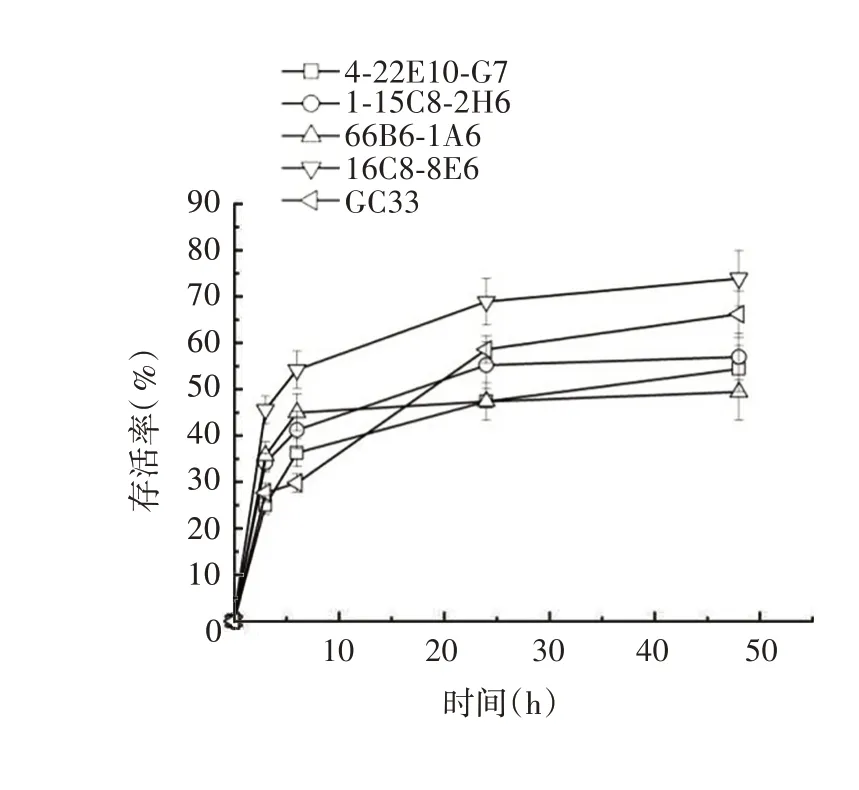
图1 不同克隆的内吞率Fig.1 Endocytosis rates of different clones
2.3ADC 结构及表征 制备的ADC 结构见图2;修饰率达95%,见图3;ADC 的DAR 值为2.04,见图4;SEC-HPLC纯度为98.2%,见图5。

图2 anti-GPC3-ADC结构示意图Fig.2 Schematic structure of anti-GPC3-ADC
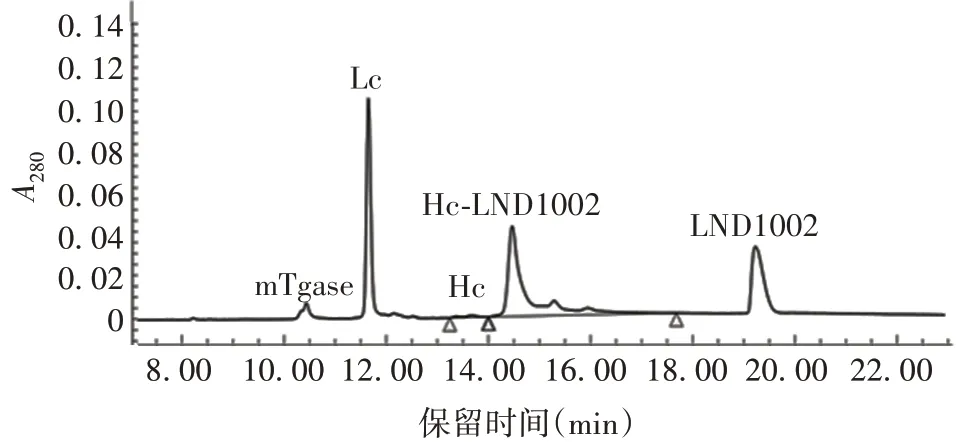
图3 RP-HPLC修饰率分析Fig.3 Analysis of modification rate by RP-HPLC
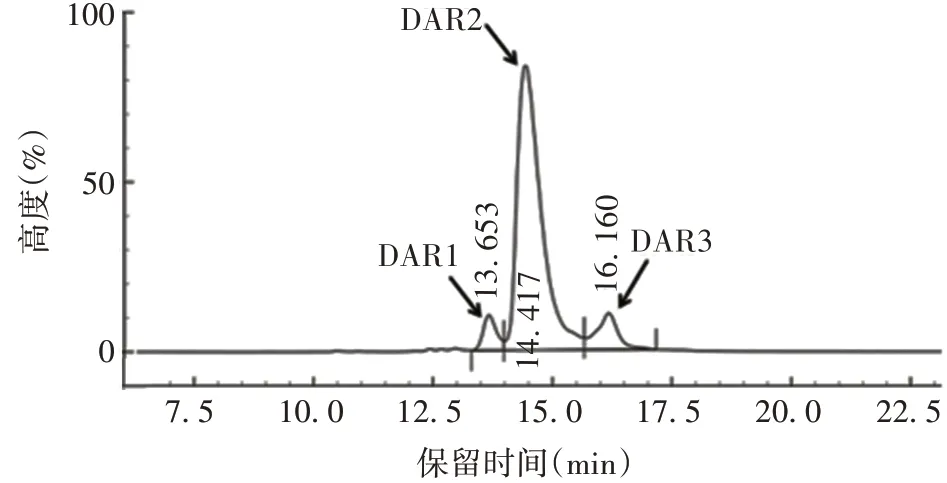
图4 RP-HPLC DAR值分布分析Fig.4 Analysis of DAR value distribution by RP-HPLC
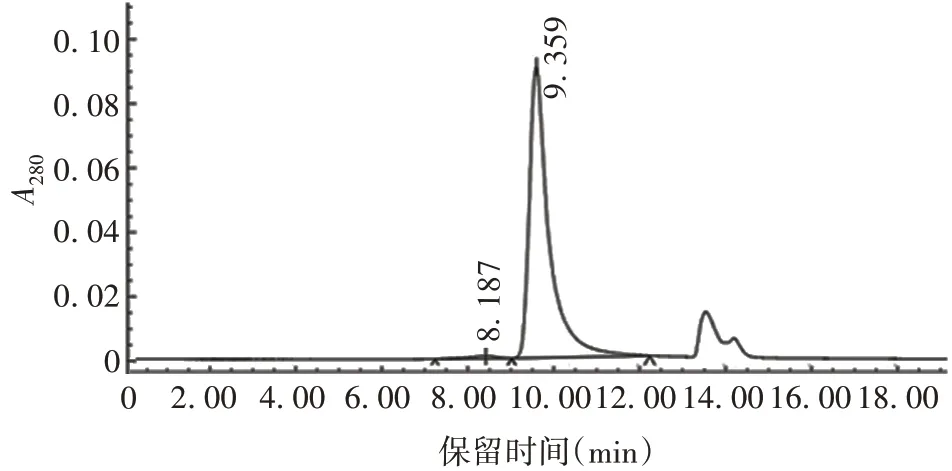
图5 SEC-HPLC纯度分析Fig.5 Purity analysis by SEC-HPLC
2.48E6 ADC 对肿瘤细胞增殖活性的影响 8E6-ADC 和GC33-ADC 对肝癌细胞HepG2 和Hep3b 的增殖抑制作用均不明显,可能由于这两种细胞对MMAE不敏感。见图6。
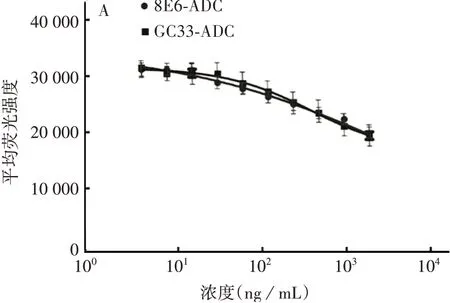
图6 8E6-ADC 和GC33-ADC 对HepG2(A)和Hep3b(B)细胞的增殖抑制作用Fig.6 Inhibitory effects of 8E6-ADC and GC33-ADC on proliferation of HepG2(A)and Hep3b(B)cells
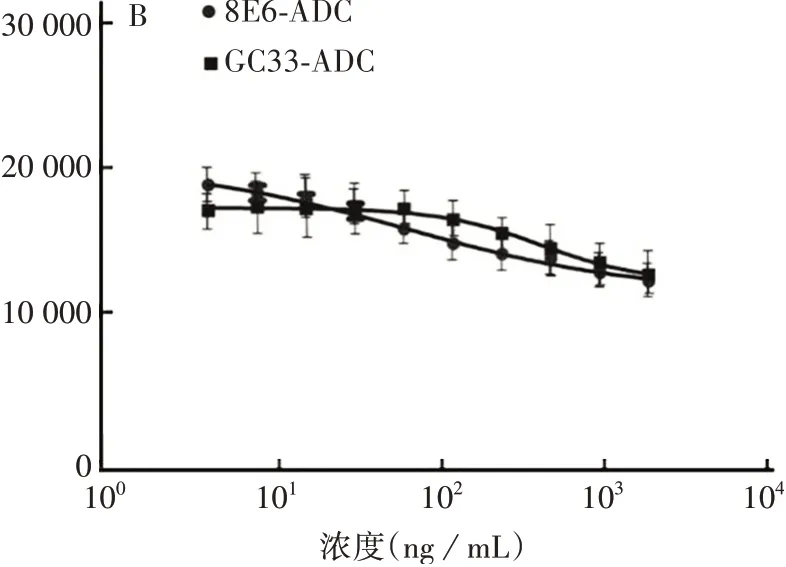
续图6 8E6-ADC 和GC33-ADC 对HepG2(A)和Hep3b(B)细胞的增殖抑制作用Fig.6(Continued)Inhibitory effects of 8E6-ADC and GC33-ADC on proliferation of HepG2(A)and Hep3b(B)cells
3 讨论
GPC3 是一种癌胚抗原,核心蛋白由40 KD 的N-端和30 KD 的C-端两部分组成,具有14 个半胱氨酸的保守序列,可在分子内形成二硫键,GPC3 蛋白C-端近细胞膜的区域含有两条硫酸类肝素(heparin sulfate,HS)聚糖链,正常组织中几乎未见GPC3 表达,但在70%~80%的肝细胞癌中表达,GPC3 参与细胞增殖、分化、迁移和凋亡。基于GPC3 结构和功能特点,其被认为是肝癌治疗的理想靶点。目前全球有多个靶向GPC3的药物处于临床研究阶段,药物形式为单抗、双抗、CAR-T疗法,但尚无ADC药物的开发。进展最快的是罗氏公司旗下中外制药株式会社开发的Codrituzumab 单抗,靶向GPC3 的C-端524 ~563位氨基酸之间肽段,主要通过抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytoto-xicity,ADCC)发挥抗肿瘤药效,临床前实验表明可抑制肝癌裸鼠种瘤的生长,但Ⅱ期临床结果显示,GC33 与安慰剂相比,并未明显提升晚期肝细胞癌患者的总生存率和无进展生存期。ADC 药物以抗体靶向作用和小分子杀伤作用在肿瘤治疗中展现优势,因此开发以GPC3 为靶点的ADC 药物可填补临床治疗的空白。
本研究通过杂交瘤技术获得抗GPC3单抗16C8-8E6,试验结果显示,在结合和内吞率方面,16C8-8E6抗体优于原研抗体GC33,提示16C8-8E6抗体的研究可为阐述抗GPC3 ADC 的机制奠定基础,也为肝细胞癌的治疗提供新的方式。筛选获得的单抗经蛋白水平检测(ELISA),均有较好的结合(如1-15C-2H6),但细胞水平检测(FACS)却很差,由于表达纯化的蛋白与细胞膜上表达的蛋白在构象上的差异,ADC 药物是作用于患者肿瘤细胞,细胞水平的结果更接近真实情况,因此选择在细胞水平结合较好的16C8-8E6 作为后续ADC 制备的候选抗体。与目前上市药物采用的化学偶联方法不同,本研究采用位点特异性酶法偶联MMAE,该方法能够有效避免传统化学偶联带来的小分子毒素结合位置和数量不可控、稳定性低以及不均一等问题。
本研究构建的靶向GPC3 的ADC 药物16C8-8E6 ADC 对GPC3 阳性的肝癌细胞Hep3b 和HepG2 抑制生长效果不佳,可能是由于HepG2 和Hep3b 细胞对MMAE 不敏感所致。FU 等[14]的研究也支持了该结果,FU 团队通过对9 000 个化合物进行筛选,显示微管抑制剂对肝癌细胞的杀伤效果较差,DNA 抑制剂PBD有较好的杀伤效果[14],但PBD毒性太强,考虑到该靶点是靶向肝癌细胞,可能会引起更严重的肝毒性[15-16]。因此,靶向GPC3 的抗体药物可尝试偶联大分子蛋白毒素或小分子免疫激动剂来平衡其药效和安全性。本研究验证了ADC形式的药物对肝细胞癌可起到杀伤作用,为以GPC3 为靶点的ADC 药物的研究奠定了基础。
