抗生素联合抗程序性细胞死亡蛋白1抗体治疗在H22肝癌小鼠模型中的抗肿瘤作用
2023-10-20刘莉邓向亮韩亮叶昊
刘莉,邓向亮,韩亮,叶昊
1.广东药科大学中药学院,广东广州 510006;2.广东药科大学中医学院及附属第二医院,广东云浮 527300;3.广东省光与健康工程技术研究中心,广东广州510006
2020 年全球发生了1 930 万新癌症病例和近1 000万癌症死亡病例,严重威胁人们的生命健康[1]。其中原发性肝癌是我国第四大常见恶性肿瘤,也是我国第二大肿瘤死因,导致中国的癌症负担不断增加[2]。免疫检查点单克隆抗体治疗肿瘤是通过激活T 细胞杀死癌细胞,目前已成为肿瘤治疗的重大突破[3],但其价格昂贵[4],不同癌症有效性不同,存在耐药性。其应用的局限性为:不同癌症有效性不同,存在耐药性,价格昂贵,可导致肺结核、肠炎、垂体损伤等不良反应[4-5]。合理的联合免疫治疗可能是提高临床抗肿瘤疗效的解决方案。研究证实,联合治疗比单独化疗具有更长的总生存期,可改善免疫检查点单克隆抗体治疗出现的不良反应[6]。研究证实,肠道菌群的改变可抑制肿瘤生长及重新编程肿瘤微环境,从而增加抗程序性细胞死亡蛋白1(programmed cell death protein 1,PD1)抗体的耐药性[7-8]。一方面,抗生素(antibiotic,ATB)会影响肠道中微生物的多样性,导致生态失调和免疫力受损,并与癌症患者的不良生存率有关[9-10];另一方面,ATB 又可预防小鼠肝脏肿瘤[11]。对于ATB 矛盾的作用,进一步分析ATB 分类是联合治疗肿瘤的重要前提。研究证实,口服广谱和窄谱ATB 在癌症治疗上存在显著差异[12]。广谱ATB 的使用不利于接受免疫检查点抑制剂治疗的患者的预后[13],而窄谱ATB 联合免疫疗法治疗肝癌的作用目前尚不明确。
头孢菌素类ATB 会干扰细菌细胞壁合成,导致感染性微生物的分解。头孢曲松钠属于头孢菌素类第三代半合成ATB,仅通过肠胃外途径给药,且具有穿越血脑屏障的能力,在调节肠道微生物群和免疫力方面发挥关键作用[14]。头孢曲松钠对大肠埃希菌、肺炎杆菌、吲哚阳性变形杆菌、流感杆菌、沙雷杆菌、脑膜炎球菌、淋球菌有强大杀菌作用,其主要活性与革兰阴性细菌有关,还能够对抗对第一代和第二代头孢菌素耐药的革兰阴性杆菌。随着耐药性和不良反应的增加,头孢曲松钠的使用具有了局限性[15]。属于窄谱抗菌药物的林可霉素可有效治疗大多数厌氧菌和革兰阳性球菌感染,在临床经常与其他药物联合配伍使用,并且其抗菌性能够减少因杂菌引发的肠道菌群的失调[16]。因此,两种ATB 联合使用既可缓解头孢曲松钠产生的细菌耐药性,也可抵抗混合感染中对两者敏感性低或无敏感性的细菌。
本研究选择头孢曲松钠和克林霉素联合抗PD1抗体免疫疗法治疗小鼠肝癌,研究窄谱ATB 对H22移植瘤的影响,为提高免疫治疗效果提供有效的方法和参考依据。
1 材料与方法
1.1实验动物 SPF 级BALB/c小鼠(雄性,3 ~4周龄,体质量18 ~20 g)、SPF 级KM 小鼠(雌性,3 周龄,体质量18 g)购自辽宁长生生物科技有限公司。实验动物生产许可证号:SYXK(粤)2017-0125,动物合格证号:99410100013479。所有动物均在温度(20±2)℃、相对湿度36%的屏障环境中饲养,可自由进食、饮水。本实验均以科研为目的进行小鼠的养殖和使用,并经广东药科大学实验动物伦理委员会审理批准,按科技部《关于善待实验动物的指导性意见》、《广东省实验动物管理条例》等相关规定(国科发财字[2006]398号、广东省第十一届人民代表大会常务委员会公告[41号])进行。
1.2细胞 小鼠肝癌H22细胞由广州中医药大学提供,在RPMI-1640 培养基中,37 ℃,5%CO2条件下培养至80%密度时,进行后续试验。
1.3主要试剂及仪器 RPMI1640 培养基购自美国Gibco公司;InVivoMab 抗小鼠PD1(CD279)购自美国Bioxcell 公司,批号:BE0273;IL-2、IL-10、IFNγ ELISA试剂盒购自欣博盛生物科技有限公司,批号:BA-120H、AF5105、DF6045;伊红和苏木精染料购自北京兰杰柯科技有限公司;头孢曲松钠和盐酸林可霉素购自上海麦克林生化科技有限公司;DAB 显色试剂盒购自北京中山金桥生物科技有限公司,批号:9017;兔抗鼠特异性单抗APC-cy7-CD3、APC-CD8购自美国Biolegend(San Diego)公司,批号:100235、 100712;兔抗鼠特异性单抗PE-CD69购自广州誉德生物科技有限公司,批号:12-0691-81;兔抗鼠特异性单抗CD3和CD8 购自美国Affinity Biosciences 公司;HRP 标记的山羊抗兔IgG(批号:A0208)购自上海碧云天生物技术有限公司;流式细胞仪(FACS CantoⅡ型)、FlowJo软件购自美国BD 公司;Image J 购自美国NIH 公司;GraphPad Prism 8.0.1购自美国San Diego公司。
1.4小鼠肿瘤模型的建立及分组、给药 为提高移植瘤活性,进行KM 小鼠腹水造模试验。取KM 小鼠,腹腔注射0.1 mL H22细胞悬液(2 × 107个/mL)制备腹水细胞,10 d 后,抽取腹水5 mL,用PBS 离心(200×g,5 min)洗涤2 次,将细胞重悬于培养基中,计数并调整细胞浓度为2×107个/mL。将BALB/c小鼠分为5 组,每组8 只:正常(Normal)组、模型(Model)组、抗PD1(PD1)组、头孢曲松纳+盐酸林可霉素(ATB)组、抗PD1 联合ATB(PD1+ATB)组。除Normal组小鼠外,其余小鼠均腋下接种0.1 mL H22细胞(2×107个/mL),建立H22荷瘤小鼠模型。ATB 使用时间和剂量与治疗肿瘤疗效密切相关,因此采取短期在免疫治疗中使用ATB[17-18]。于建模后肿瘤大小超过100 mm3,第8 和13 天分别腹腔注射抗PD1单抗,250 µg/只,免疫治疗同时灌胃头孢曲松钠(100 mg/kg)加盐酸林可霉素(200 mg/kg)7 d,Normal组灌胃生理盐水,0.2 mL/只。观察小鼠状态。
1.5联合给药对肿瘤生长和脾指数影响的检测 肿瘤移植成功后,每隔2 d用游标卡尺测量小鼠肿瘤的长短径,计算肿瘤体积,并绘制曲线。第1 ~15天记录小鼠自然死亡和存活情况。第15 天后,颈椎脱臼处死小鼠,分离肿瘤和脾脏组织称重,按下式计算脾脏指数。
1.6联合给药对IL-2、IFNγ、IL-10 细胞因子分泌水平影响的检测 颈椎脱臼处死小鼠时,经小鼠眼眶后采血分离血清,采用ELISA 法检测血清中IL-2、IFNγ、IL-10 细胞因子分泌水平,具体操作按试剂盒说明书进行。
1.7联合给药对CD3+、CD8+T 细胞比例影响的检测
采用流式细胞术。取小鼠肠系膜淋巴结,经PBS 研磨过滤后,加入兔抗鼠特异性单抗(APC-cy7-CD3 和APC-CD8)染色30 min;PBS洗涤2次,置0.2 mL缓冲液重悬溶液后,上流式细胞仪检测CD69、CD3和CD8比例。同种型对照[Normal 组淋巴细胞中分别单染(CD3、CD8),设为阴性对照(Control)组]。利用FlowJo软件分析阳性细胞比例。
1.8联合给药对组织病理学及CD3和CD8蛋白表达影响的检测 将小鼠肿瘤包埋在4%多聚甲醛中并石蜡切片,HE 染色进行形态学观察。采用免疫组化(immunohistochemistry,IHC)法,将石蜡切片常规脱蜡,高温抗原修复20 min 后,3% H2O2和10% BSA 37 ℃孵育;切片与兔抗鼠特异性单抗CD3 和CD8 4 ℃过夜复温;加入HRP 标记的山羊抗兔IgG 孵育1 h;加入DAB显色试剂作用3 ~5 min;Olympus光学显微镜下扫描观察玻片,检测CD3 和CD8 蛋白的表达。采用Image J 软件分析阳性面积比例,确定相对蛋白表达量。
1.9统计学分析 使用GraphPad Prism 8.0.1 软件进行统计学分析。所有数据均以平均值±SEM表示,并重复进行至少3 次独立试验。肿瘤体积组间比较采用双因素方差分析,其他组间采用单因素方差分析、t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1联合给药对肿瘤生长和脾指数的影响 联合治疗16 d 后,3 个治疗组小鼠均存活,且肿瘤生长速度均比Model 组慢。PD1 + ATB 组肿瘤体积低于PD1组(t=1.266,P=0.032 4),且肿瘤重量与PD1 组差异较大(t=1.136,P<0.000 1)。见图1。表明PD1+ATB 联合治疗可有效抑制肝癌异种移植小鼠肿瘤生长,并较PD1单独治疗效果更好。与Normal组相比,Model 组小鼠脾脏明显增大(t= 5.804,P= 0.002);与Model 组相比,PD1+ATB 组脾脏指数更显著低于PD1组(t=2.636,P=0.048 5)。见图2。表明PD1+ATB 联合治疗可缓解炎症引起的脾脏肿大,可有效调节免疫器官,促进免疫活性提高。
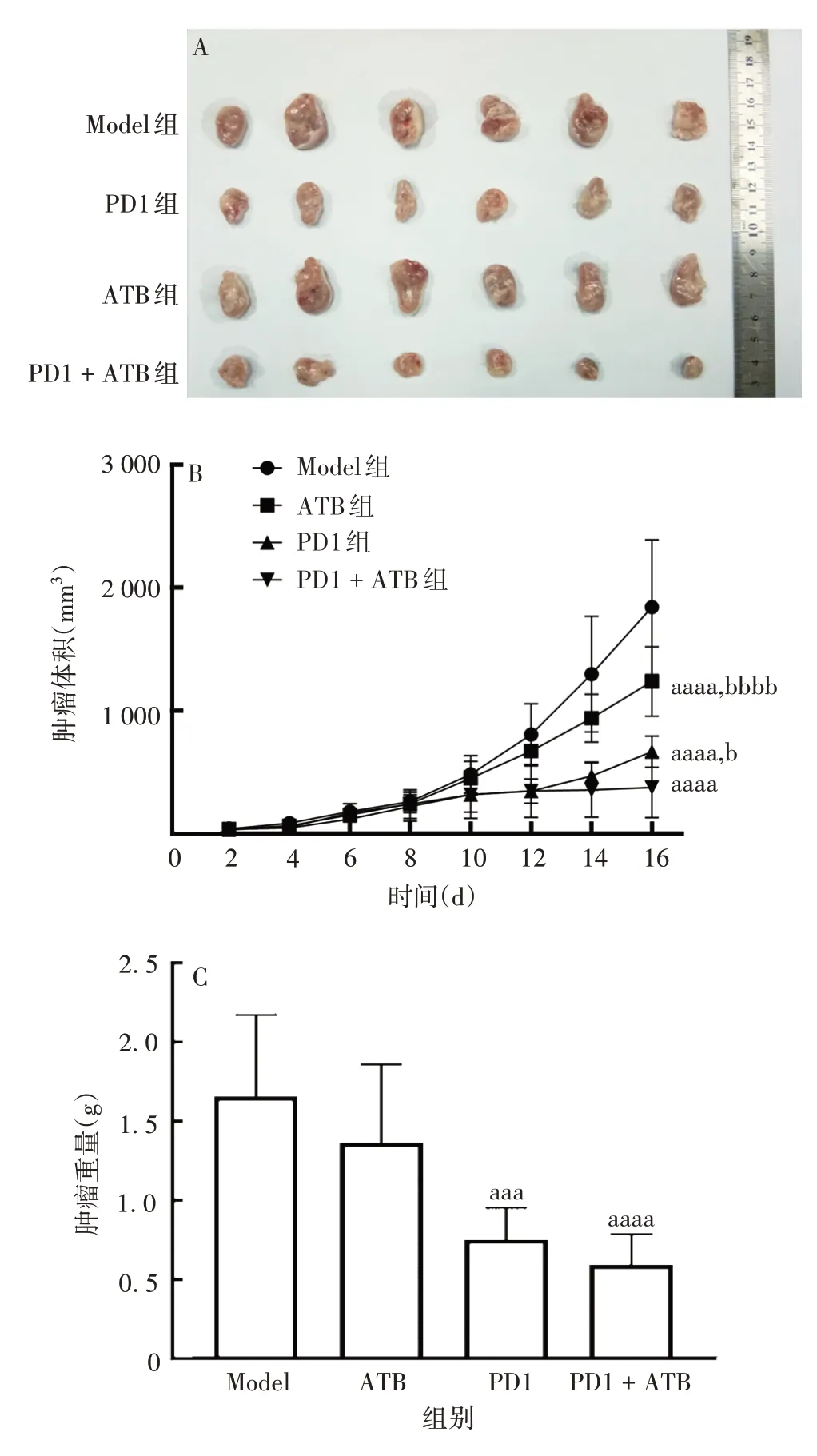
图1 联合给药对小鼠肿瘤生长的影响Fig.1 Effect of combined administration on tumor growth in mice

图2 联合给药对小鼠脾脏指数的影响Fig.2 Effect of combined administration on mouse spleen index
2.2联合给药对IL-2、IL-10、IFNγ 细胞因子分泌水平的影响 与Normal 组相比,Model 组IL-2、IL-10 和IFNγ 水平显著降低(t分别为8.489、3.18、3.015,P分别为0.002 2、0.042、0.019 8);与Model 组相比,PD1+ATB 组IL-2、IL-10、IFNγ 和分泌水平显著升高(t分别为3.326、7.573、5.282,P均<0.05),且IL-2、IL-10水平显著高于PD1组(t分别为0.520 2、0.577 5,P分别为0.006 9、0.005 8)。见图3。表明PD1+ATB联合治疗可促进免疫调节细胞因子的释放,并激活肝癌异种移植小鼠的免疫反应。
2.3联合给药对CD3+、CD8+T 细胞比例的影响 与Normal 组相比,Model 组小鼠肠系膜淋巴结组织中CD3+、CD8+T细胞比例降低(t分别为7.814、5.571,P分别为0.006 4、0.009 5);与Model组相比,PD1+ATB组CD3+、CD8+T 细胞比例显著增加(t分别为5.079、2.848,P分别为0.022 3、0.010 9)。见图4 和图5。表明PD1+ATB 联合治疗增加了淋巴结中T 淋巴细胞数量,并激活了肝癌异种移植小鼠的免疫反应,显著改善了皮下移植肿瘤的免疫微环境。

注:与Normal组相比,a表示P <0.05,aa表示P <0.01;与Model组相比,b 表示P <0.05,bb 表示P <0.01;cc 表示与PD1+ATB 组相比,P <0.01。n=6(单因素方差分析)。

图5 联合给药对小鼠肠系膜淋巴结组织中CD3+(A)、CD8+(B)T细胞比例的影响Fig.5 Effect of combined administration on proportions of CD3+(A)and CD8+(B)T cells in mesenteric lymph nodes of mice
2.4联合给药对组织病理学的影响 与Model 组相比,PD1+ATB 组HE 染色表现为肿瘤内浸润的T 细胞显著增加,胞浆染色信号增强,细胞核数量增多,而PD1 组肿瘤内浸润的T 细胞较少。见图6。表明PD1+ATB联合治疗可促进肿瘤细胞坏死,调节免疫功能。
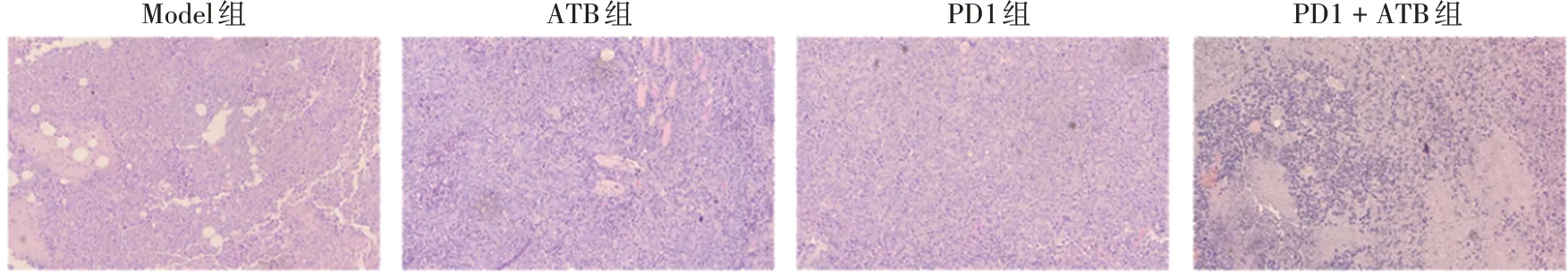
图6 联合给药对组织病理学的影响(HE,×200)Fig.6 Effect of combined administration on histopathology(HE staining,×200)
2.5联合给药对CD3、CD8蛋白表达的影响 与Model组相比,PD1+ATB组肿瘤组织中CD3、CD8蛋白表达水平显著升高(t分别为7.95、3.211,P分别为0.000 1、0.011 4),且显著高于PD1组(t分别为4.494、3.211,P分别为0.011 4、0.047 4)。见图7 和图8。表明PD1 + ATB 组肿瘤组织中CD3+和CD8+T 细胞浸润水平较高,激活T 细胞功能强于PD1 组,与流式细胞仪检测结果一致。
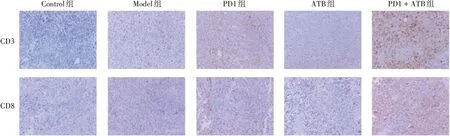
图7 IHC法检测联合给药对肿瘤CD3、CD8表达水平的影响(×200)Fig.7 Analysis of effect of combined administration on expression levels of CD3 and CD8 in tumor by IHC assay(×200)
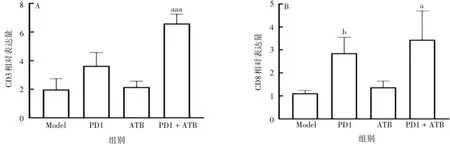
图8 联合给药对肿瘤组织CD3(A)、CD8(B)表达的水平影响Fig.8 Effect of combined administration on expression levels of CD3(A)and CD8(B)in tumor tissue
3 讨 论
使用抗PD1 抗体作为有效的一线癌症免疫疗法是人类抗癌的里程碑。但约2/3 的患者对单独免疫治疗无反应,迫切需要新策略来增强抗癌免疫力[19]。联合治疗能够预测生物标志物,支持免疫治疗敏感性、分类多样性和特定肠道细菌类群丰度之间的联系,这些物种复合物具有内在的免疫调节特性,从而可最大限度地发挥抗PD1 抗体耐药性的临床益处[20-21]。随着肠道微生物对免疫反应和癌症的影响逐渐受到关注,ATB 已成为癌症免疫治疗的潜在生物标志物之一。ATB 与抗PD1 抗体联合免疫治疗的最优组合策略是目前以抗PD1 抗体抑制剂为基础的肿瘤免疫治疗亟待解决的热点问题。研究发现,ATB 对肿瘤治疗效果不同,其主要影响因素包含ATB 分类、给药剂量、给药时间等[17-18]。窄谱和广谱ATB 对癌症治疗效果差异明显,其中ATB 分类可能是其重要的影响因素[12]。
因此,本研究模拟了H22肝癌细胞接种BALB/c小鼠,为减少肠道中的大部分细菌,选择头孢曲松钠和盐酸林可霉素作为窄谱ATB治疗。排除其他影响试验的因素,选择短期口服ATB,同时进行抗PD1 抗体免疫治疗。结果显示,PD1+ATB组小鼠皮下移植瘤体积明显小于其他干预组。研究表明,肿瘤免疫治疗的有限疗效是缺乏足够数量的肿瘤浸润淋巴细胞或T 细胞,这些细胞无法通过各种因素进入肿瘤微环境[22]。本研究的肿瘤组织切片HE 染色和IHC 法检测结果发现,抗PD1 抗体结合ATB 的使用有助于提高肿瘤组织CD3+和CD8+T 细胞浸润水平,促进肿瘤组织坏死范围的扩大(P<0.05)。ATB 与抗PD1抗体联合治疗的抗肿瘤机制与免疫功能的调节有关。正常情况下,淋巴结或脾脏中的免疫系统会对外来抗原作出反应,并促进抗原特异性T细胞增殖。淋巴细胞是机体免疫反应功能的重要细胞成分,是几乎所有免疫功能的主要执行者。为了确定联合治疗对免疫系统的影响,本研究使用流式细胞仪分析了肠系膜淋巴结中T 细胞的比例。结果显示,ATB 与抗PD1 抗体联合治疗可促进CD3+和CD8+T 细胞增加(P<0.05)。抗PD1 抗体分子与配体细胞程序性死亡-配体1(programmed cell death-ligand 1,PDL1)和细胞程序性死亡-配体2(PDL2)结合会传导抑制信号并减少T 细胞增殖,使癌细胞能够逃避免疫监视和破坏[23]。抗PD1/PDL1单抗药物通过阻断其表达结合,使T 细胞能够正常杀死肿瘤细胞[24]。但其具有不良反应和有效率低的局限性[5]。有研究发现,ATB影响免疫细胞因子并调节免疫功能[25-26]。如IL-2 不仅可诱导T 淋巴细胞增殖,还诱导可能具有抗肿瘤潜力的NK 细胞群的扩增。本研究血清ELISA 检测结果显示,ATB 与抗PD1抗体联合治疗可提高IL-2、IL-10和IFNγ细胞因子分泌水平(P<0.05)。
综上所述,ATB 与抗PD1 抗体联合治疗是通过提高肿瘤组织T细胞浸润水平,增加免疫调节细胞因子IL-2、IL-10、IFNγ和T淋巴细胞数量,激活T细胞免疫功能来持续激活免疫系统,抑制肿瘤。窄谱ATB可能通过改善免疫功能来促进抗PD1 抗体对肿瘤的治疗。目前ATB如何消除或调节癌症患者免疫抑制的具体机制尚不完全清楚,有必要对其进行前瞻性研究来确定肿瘤特异性微生物特征,以利于肿瘤的早期诊断和后续治疗。
