乳酸菌产抑菌物质抑制金黄色葡萄球菌作用机理研究
2022-12-30杜琨
杜琨
(武警工程大学装备管理与保障学院,西安 710086)
0 引言
金黄色葡萄球菌是一种致病菌,可引起人类和动物化脓感染,也可造成人类食物的中毒[1]。金黄色葡萄球菌在自然界中无处不在,空气、水、灰尘及人和动物的排泄物中都可找到,食品受其污染的机会很多。因此,研究乳酸菌产抑菌物质对金黄色葡萄球菌的抑制或杀灭,对控制食品中金黄色葡萄球菌的污染、保障食品安全和消费者身体健康意义深远。
本研究采用生长曲线测定、呼吸代谢抑制试验、电导率、可溶性总糖测定、细胞壁的变化、蛋白含量和电镜观察等针对性的试验方法,研究乳酸菌产抑菌物质对金黄色葡萄球菌的抗菌作用,为有效地的合理应用提供理论依据[2-5]。
1 材料与方法
1.1 实验材料
乳酸菌产抑菌物质:由本实验室从高原酸奶中分离得出的乳酸菌,经添加营养物质、发酵优化、分离、纯化和冷冻干燥等制成的乳酸菌产抑菌物质冻干粉。检测指示菌:金黄色葡萄球菌(Staphylococcus aureus),由陕西师范大学食品营养与工程学院微生物实验室提供。
1.2 培养基
发酵液效价检测培养基:牛肉膏1%,蛋白胨1%,NaCl 0.5%,pH=7.0。
1.3 仪器与设备
TQHZ-2002A恒温振荡培养箱,太仓市华美生化仪器厂;GHP-250恒温培养箱,扬州市三发电子有限公司;SB-3S-1无菌操作台,上海博迅实业有限公司;XY280B不锈钢蒸汽消毒器,上海三申医疗器械有限公司;GL-20G-Ⅱ冷冻离心机,上海安亭仪器设备有限公司;GHP-250智能光照培养箱,扬州市三发电子有限公司;DT1000型电子天平,常熟市衡器厂;紫外分光光度计,北京瑞利分析仪器公司;JPB-607型便携式溶解氧分析仪,上海精密科学仪器有限公司;H-600透射电子显微镜,日本HITACHI公司;TM-1000扫描电子显微镜,日本HITACHI公司;Bio-Rad680型酶标仪,美国伯乐公司;EC400电导率仪,美国extech。
1.4 实验方法
1.4.1 乳酸菌产抑菌物质抑菌活性测定方法
采用滤纸片琼脂平板扩散法[6-7]。
1.4.2 乳酸菌产抑菌物质最小抑菌浓度(MIC)的测定
用二倍稀释法将100 mg/mL的乳酸菌产抑菌物质溶液进行稀释,吸取2 mL乳酸菌产抑菌物质溶液和18 mL融化的培养基同时放入灭菌的培养皿,调整pH值为2.5,充分混匀,使乳酸菌产抑菌物质最终浓度为100 mg/mL~0.79 mg/mL 8个梯度。待冷却后,用接种针划线在培养基上涂上生长量为106CFU/mL的金黄色葡萄球菌菌液,用无菌水作空白对照组,每个浓度作3个重复。观察菌体的生长情况,培养皿中无菌生长的,此皿的乳酸菌产抑菌物质浓度即为其MIC值。
1.4.3 乳酸菌产抑菌物质对金黄色葡萄球菌生长曲线的影响
将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌菌液作为指示菌悬液。向其中加入MIC浓度的乳酸菌产抑菌物质,每隔3 h取样,然后用紫外可见分光光度计在650 nm下测定OD值,连续测定36 h,以时间为横坐标,抑菌圈直径和OD值为纵坐标,分别绘制对照组和加药组的生长曲线和抑菌情况。
1.4.4 乳酸菌产抑菌物质对金黄色葡萄球菌呼吸代谢的抑制试验[8]
(1)金黄色葡萄球菌菌悬浮液的制备。将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。将菌悬液用4 000 rpm离心10 min,倒掉上清液,用生理盐水洗涤2次,再用生理盐水将菌稀释成1 g/100 mL的悬浮液。
(2)呼吸速率的测定。呼吸速率是指单位时间、单位质量微生物的耗氧量。根据菌体悬浮液中溶氧量的变化,可以求出菌体呼吸速率。
典型抑制剂及乳酸菌产抑菌物质呼吸速率的测定:在反应杯中加入pH7.2、浓度为0.l mol/L的磷酸盐缓冲溶液18 mL,1%的葡萄糖溶液2 mL,1%菌体悬浮液5 mL。露空搅拌5 min后开始测定菌体悬浮液中的溶氧量,测定时要保证整个系统处于密封状态。用微注射器分别加入3种典型抑制剂碘乙酸、丙二酸和磷酸钠,使其终浓度为0.5 mg/mL,乳酸菌产抑菌物质的终浓度为3.13 mg/mL,以不加抑制剂组为对照。每组做3个平行实验,取平均值。
(3)抑制率的计算。根据测得的呼吸速率,按照下列计算公式求出典型抑制剂及乳酸菌产抑菌物质对金黄色葡萄球菌呼吸的抑制率。其中IR表示抑制率,R0为不添加典型抑制剂时实验装置中金黄色葡萄球菌呼吸速率,R为添加典型抑制剂时各个实验装置中金黄色葡萄球菌呼吸速率。
IR(%)=(R0-R)/R×100%
(4)叠加率的计算。根据典型呼吸抑制剂加入前、后金黄色葡萄球菌的呼吸速率,用下列公式计算叠加率。其中RR表示叠加率,R0为添加高原乳酸菌素时实验装置中金黄色葡萄球菌呼吸速率,R为添加高原乳酸菌素和典型抑制剂时各个实验装置中金黄色葡萄球菌呼吸速率。
RR(%)=(R0-R)/R×100%
1.4.5 乳酸菌产抑菌物质对金黄色葡萄球菌培养液电导率的影响
参照Lee H.J的方法[9],将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。向其中加入0、MIC、3MIC浓度的乳酸菌产抑菌物质,用EC400电导率仪测定0、1、2、4、8 h时培养液的电导率值。
1.4.6 乳酸菌产抑菌物质对金黄色葡萄球菌可溶性总糖的影响
参照钱红[10]的方法,将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。向其中加入MIC和3MIC的乳酸菌产抑菌物质,分别在0、1、2、4、6、8、10、12 h时取1 mL混合液离心(10 000 r/min,2 min),取上清液稀释5倍后,取50 μmol/g·min于离心管中,加入200 μmol/g·min蒽酮试剂,在冰浴中冷却5 min,然后在沸水浴中煮沸10 min,室温放置10 min,用酶标仪测定其在620 nm处的吸光值;以标准葡萄糖溶液作标准曲线;以无菌水替代乳酸菌产抑菌物质作为空白对照。平行实验3次。
1.4.7 乳酸菌产抑菌物质对金黄色葡萄球菌细胞壁的影响
将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。向其中加入MIC和3MIC浓度的乳酸菌产抑菌物质,用蒸馏水代替乳酸菌产抑菌物质作为对照组,分别在0、1、2、4、6、8、10、12时取样,3 500 r/min离心10 min,取上清液采用Malamy等[11]的方法测定碱性磷酸酶的含量(AKP)。
1.4.8 乳酸菌产抑菌物质对金黄色葡萄球菌培养液蛋白含量的影响
将金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌培养液作为指示菌悬液。向其中加入MIC浓度和3MIC浓度的乳酸菌产抑菌物质,每隔2 h取样,用比色皿在分光光度计上测定各样品在595 nm处的吸光值A595,记录数据,根据标准曲线计算蛋白质含量。同时将正常培养的金黄色葡萄球菌用蒸馏水和脱脂奶粉调节成同蛋白质含量的溶液设为对照,蛋白质含量按照Bradlford[12]的方法进行,实验重复3次。
1.4.9原子力显微镜观测
将生长到对数期的金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌转接于液体培养基中,向其中加入MIC和3MIC浓度的乳酸菌产抑菌物质,置于摇床中培养(37℃,130 r/min),取对照组和不同处理的菌悬液5 μL,涂布到新剥离的云母片上,用2.5%的戊二醛固定10 min,无菌水漂洗3次,待水分自然风干后,用AFM进行观察,图像均在Tapping模式下获得,探针为Si3N4(微悬臂长:200 μm,弹性系数0.12 N/m),原子力显微镜图像的形态学特征均采用原子力显微镜附带的软件进行平滑处理与数据分析,以未加乳酸菌产抑菌物质的菌悬液为空白对照[13-14]。
1.4.10 乳酸菌产抑菌物质对金黄色葡萄球菌外观结构的影响
参照Sitohy等[15]的方法,将生长到对数期的金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌转接于液体培养基中,向其中加入MIC和3MIC浓度的乳酸菌产抑菌物质,置于摇床中培养(37℃,130 r/min),取对照组和不同时间处理的菌悬液5 mL,离心收集菌体,用2.5%的戊二醛固定后,先用0.01 mol/L的磷酸盐缓冲液(pH7.2)洗涤3次,每次10 min;然后依次用30%、50%、60%、70%、80%、90%和100%的乙醇梯度脱水各1次,每次10 min;再用无水乙醇脱水2次,每次10 min;然后依次用50%、70%、90%和100%乙酸异戊酯逐级置换乙醇,每次置换2 min;将样品放入超临界干燥器内干燥,最后经镀膜和喷金,置于TM-1000扫描电子显微镜下观察,拍照。
1.4.11 乳酸菌产抑菌物质对金黄色葡萄球菌超微结构的影响
将生长到对数期的金黄色葡萄球菌接种到牛肉膏蛋白胨液体培养液中振荡培养,血球计数板计数,取生长量为106CFU/mL的金黄色葡萄球菌转接于液体培养基中,向其中加入MIC和3MIC浓度的乳酸菌产抑菌物质,置于摇床中培养(37℃,130 r/min),取对照组和不同处理的菌悬液5 mL,离心收集菌体,用2.5%的戊二醛固定后,用0.01 mol/L的磷酸盐缓冲液(pH7.2)洗涤3次,每次10 min;然后依次用30%、50%、70%、80%、90%、95%和100%的乙醇梯度脱水各1次,每次10 min;再用无水乙醇脱水2次,每次10 min;Epon812定向包埋,用超薄切片机进行超薄切片,厚度50 nm左右;用醋酸铀-柠檬酸铅双染色各30 min,再用蒸馏水冲洗,37℃烘干,用H-600透射电子显微镜观察、拍照[16]。
2 结果与分析
2.1 乳酸菌产抑菌物质最小抑菌浓度(MIC)的测定结果
由表1可以看出,当乳酸菌产抑菌物质的浓度为3.13 mg/mL时,金黄色葡萄球菌不能生长,而当乳酸菌产抑菌物质的浓度为1.57 mg/mL时,金黄色葡萄球菌生长,因而乳酸菌产抑菌物质对金黄色葡萄球菌的MIC为3.13 mg/mL。

表1 乳酸菌产抑菌物质最小抑菌浓度(MIC)的测定
2.2 乳酸菌产抑菌物质对金黄色葡萄球菌生长曲线的影响
从图1可以看出,对照组从3 h开始进入对数生长期,18~24 h进入细菌稳定生长期,27 h进入衰亡期。而加入MIC浓度乳酸菌产抑菌物质后,其生长曲线发生明显改变,金黄色葡萄球菌的生长受到抑制,菌体的生长一直处于较低的水平,未出现菌体大量生长的对数期。说明乳酸菌产抑菌物质能够抑制金黄色葡萄球菌对数生长期的菌体分裂。

图1 乳酸菌产抑菌物质对金黄色葡萄球菌生长曲线的影响
2.3 乳酸菌产抑菌物质对金黄色葡萄球菌呼吸代谢的抑制试验
(1)乳酸菌产抑菌物质对金黄色葡萄球菌呼吸速率的影响。加入乳酸菌产抑菌物质及3种典型呼吸抑制剂后对金黄色葡萄球菌呼吸的抑制结果见表2。

表2 典型抑制剂及乳酸菌产抑菌物质对菌体的抑制率
由表3中可以看出,乳酸菌产抑菌物质与3种典型抑制剂相同,都对金黄色葡萄球菌的呼吸代谢有抑制作用。

表3 乳酸菌产抑菌物质与典型抑制剂的叠加率
(2)乳酸菌产抑菌物质与典型抑制剂间的叠加作用。由表3中可以看出,乳酸菌产抑菌物质与丙二酸的叠加率最小,与磷酸钠的叠加率最大,这表明乳酸菌产抑菌物质主要通过抑制三羧酸循环途径起作用。但乳酸菌产抑菌物质究竟对三羧酸循环中的哪一部位起抑制作用,还有待进一步研究。
2.4 乳酸菌产抑菌物质对金黄色葡萄球菌培养液电导率的影响
从图2中可以看出,向金黄色葡萄球菌培养液中加入乳酸菌产抑菌物质后,随着时间的延长,培养液电导率明显增加;还可以看出在0~1 h内,乳酸菌产抑菌物质的加入量对金黄色葡萄球菌培养液的电导率影响不大,可以排除乳酸菌产抑菌物质自身对金黄色葡萄球菌培养液电导率的影响,当乳酸菌产抑菌物质加入2 h以后,对照组的金黄色葡萄球菌培养液电导率变化不大,而乳酸菌产抑菌物质加入量为MIC和3MIC的金黄色葡萄球菌培养液电导率显著增大,说明金黄色葡萄球菌细胞破裂,细胞内大量带电荷物质外渗,引起培养液电导率增高。同时高原乳酸菌素加入量为MIC和3MIC的金黄色葡萄球菌培养液电导率对比,变化不大。

图2 乳酸菌产抑菌物质对金黄色葡萄球菌电导率的影响
2.5 乳酸菌产抑菌物质对金黄色葡萄球菌细胞壁的影响
从图3中可以看出,乳酸菌产抑菌物质作用于金黄色葡萄球菌约2 h时,细胞外渗出的碱性磷酸酶的量开始增多,约8 h时乳酸菌产抑菌物质作用的金黄色葡萄球菌的菌悬液中碱性磷酸酶量达到最大值,随后趋于平稳,和对照组比较,经乳酸菌产抑菌物质处理的金黄色葡萄球菌的菌悬液中碱性磷酸酶量大大增加,说明乳酸菌产抑菌物质对金黄色葡萄球菌的细胞壁有很强的破坏作用。

图3 乳酸菌产抑菌物质对胞外碱性磷酸酶含量的影响
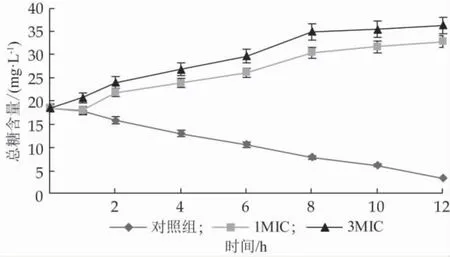
2.6 乳酸菌产抑菌物质对金黄色葡萄球菌培养液糖含量的影响
由图4可以看出,添加乳酸菌产抑菌物质后,培养液中的总糖浓度随作用时间延长逐渐上升,到8 h时糖含量增速变缓,说明乳酸菌产抑菌物质的加入破坏了菌体细胞膜结构,胞内糖类物质渗漏到胞外。
2.7 乳酸菌产抑菌物质对金黄色葡萄球菌培养液蛋白质含量的影响
由图5中可以看出,乳酸菌产抑菌物质对金黄色葡萄球菌的细胞膜渗漏具有显著的影响,并随着时间的延长,金黄色葡萄球菌培养液蛋白质含量增加显著。测定数据显示,添加1MIC乳酸菌产抑菌物质12 h的金黄色葡萄球菌培养液中蛋白质浓度为164.87 μg/mL,添加3MIC乳酸菌产抑菌物质12 h的金黄色葡萄球菌培养液中蛋白质浓度为187.32 μg/mL,而未加乳酸菌产抑菌物质处理的对照培养液中蛋白浓度仅为80.23 μg/mL。排除乳酸菌产抑菌物质自身蛋白的影响后可以推断,乳酸菌产抑菌物质的加入使金黄色葡萄球菌细胞破裂,细胞质外泄,细胞质中大量的蛋白质进入培养液中,从而引起培养液中蛋白质含量的提高。(MIC乳酸菌产抑菌物质溶液蛋白质含量为:6.25 μg/mL)。

图5 乳酸菌产抑菌物质对培养液中蛋白质含量的影响
2.8 原子力显微镜观测
图6可清晰的看到未经处理的金黄色葡萄球菌的结构呈规则球形,形态饱满,表面光滑平坦,直径约为1 μm。图7为乳酸菌产抑菌物质作用3 h时的金黄色葡萄球菌AFM图,从图中可以看出,菌体细胞膨胀,细菌细胞外壁被破坏的数量越来越多,但没有发现金黄色葡萄球菌破裂的细胞。图8为乳酸菌产抑菌物质作用9 h的金黄色葡萄球菌AFM图,从图中可以看出,大量细胞破损,胞内物质大量外泄,有的细胞已经死亡。

图6 对照组金黄色葡萄球菌正常细胞表面状态图

图8 乳酸菌产抑菌物质作用9 h金黄色葡萄球菌细胞表面状态图
2.9 乳酸菌产抑菌物质对金黄色葡萄球菌的外观结构的影响
扫描电镜下观察,图9对照组金黄色葡萄球菌细胞壁表面光滑、圆润,呈球状,细胞与细胞间界限分明,细胞排列呈明显的葡萄串状,与胡静等报道一致[30]。图10经乳酸菌产抑菌物质作用3 h,金黄色葡萄球菌的排列变得松散,有的已经不能聚集成葡萄状,表明金黄色葡萄球菌的不定向分裂受到抑制。图11经乳酸菌产抑菌物质作用9 h,大部分金黄色葡萄球菌严重扭曲变形,干瘪、皱缩,表面粗糙,有的菌体表面有明显的凹陷、囊泡状或不规则的突起结构。有的细胞泄露物在细胞周围聚集,黏结成团块状,说明菌体细胞已被破坏。

图9 对照组金黄色葡萄球菌形态结构图

图10 作用3 h金黄色葡萄球菌形态结构图

图11 作用9 h金黄色葡萄球菌形态结构图
2.10 乳酸菌产抑菌物质对金黄色葡萄球菌超微结构的影响
由图12看出,透射电镜下正常的金黄色葡萄球菌细胞壁与细胞膜完整,结构紧密,细胞膜紧贴细胞壁,基本无空隙存在,胞质均匀,核区明显。由图12看出,经乳酸菌产抑菌物质作用3 h,菌体有些变形、溶胀,位于细胞膜区出现一些小的空泡。由图14看出,乳酸菌产抑菌物质作用9 h后,细胞质固缩,导致细胞壁与细胞膜间空隙明显增宽,质壁分离,细胞壁疏松出现皱折,部分细胞壁与隔膜模糊不清,细胞质内出现许多空腔。

图12 对照组金黄色葡萄球菌超微结构图

图13 作用3 h金黄色葡萄球菌超微结构图
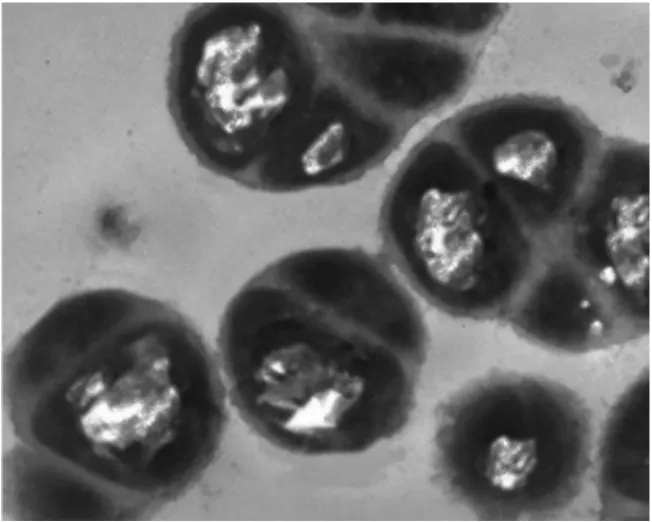
图14 作用9 h金黄色葡萄球菌超微结构图
3 结论
本文以金黄色葡萄球菌为待测菌株,通过一系列生化实验证实了乳酸菌产抑菌物质能够有效抑制金黄色葡萄球菌的生长繁殖,并初步揭示了相应的抑菌机制。从细菌生长曲线的对比结果可以看出,乳酸菌产抑菌物质能够抑制金黄色葡萄球菌对数生长期的菌体分裂。细胞呼吸抑制试验结果表明乳酸菌产抑菌物质对金黄色葡萄球菌的呼吸代谢有抑制作用,抑制方式主要是通过抑制TCA途径起作用。通过乳酸菌产抑菌物质添加前后的对比研究表明,乳酸菌产抑菌物质能明显改变金黄色葡萄球菌的电导率、糖含量、蛋白质含量和碱性磷酸酶的含量,这是由于乳酸菌产抑菌物质改变了金黄色葡萄球菌细胞膜的通透性,造成胞内物质大量外泄,且随时间的延长菌体外漏程度进一步增强。此外,乳酸菌产抑菌物质还能引发金黄色葡萄球菌菌体结构发生改变。原子力显微镜观察到用乳酸菌产抑菌物质处理的金黄色葡萄球菌菌体失去正常形态,大量细胞破损,胞内物质大量外泄,部分细胞发生死亡。透射电镜和扫描电镜的观察结果表明金黄色葡萄球菌随乳酸菌产抑菌物质作用时间的延长,菌体逐渐出现皱缩现象,胞质逐渐减少,细胞膜逐渐缺失,菌体出现死亡现象。综上所述,乳酸菌产抑菌物质的抑菌机理是破坏细胞膜和抑制生物大分子的合成,使菌体细胞膜受损,表面形成孔洞,造成菌体细胞内容物的外泄从而导致细胞死亡。
