母乳与婴儿肠道微生物的影响因素及其微生物关系研究进展
2022-12-30王凯丽刘明璞孙立娜任静
王凯丽,刘明璞,孙立娜,任静
(1,东北农业大学食品学院,哈尔滨 150030;2.东北林业大学生命学院,哈尔滨 150040)
0 引言
最初,母乳被认为是无菌的,后面随着研究的深入与技术的进步,证明母乳中不仅含有细菌还有真菌、病毒、噬菌体等生物[1]。此外,母乳中还含有乳糖、蛋白质、脂肪、低聚糖等营养物质,微量营养素,免疫活性物质,生长因子等诸多成分,可以为婴儿提供营养,有利于婴儿的发育与成长[2-4]。关于母乳中微生物来源的问题,尚未有证据证实,目前有“外部细菌逆转移”和“肠道-乳房转移”这两种假说[5]。Lackey等的研究发现厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)在母乳微生物区系组成中占绝大多数,葡萄球菌(Staphylococcus)和链球菌(Streptococcus)为核心属[6]。母乳中的各种成分都随着时间不断变化[4],就母乳中的细菌来说,其数量、种类都会受到各种因素的影响包括哺乳期、分娩方式、胎龄、抗生素、母亲健康情况、地理位置等[1,5],Moossavi等的研究还指出母乳微生物也会受到婴儿性别的影响[7],但目前相关研究结果数据较少,还需要进一步的研究。
几十年来,人们一直认为新生儿出生时是无菌的,但最近的研究证据表明,他们在子宫内发育过程中接触到的胎盘、胎粪中会存在各种细菌,因而新生儿出生前就会被微生物定居,包括细菌、真菌、病毒等,不同的菌种定居在身体的不同部位[8-10]。肠道微生物区系中丰富的成员在维持人类健康方面起着至关重要的作用,它们帮助分解食物组分,使其分解产生宿主无法获得的营养物质,促进宿主细胞分化,保护宿主免受病原体侵袭,及刺激或调节免疫系统[11]。Yang等的研究发现,婴儿肠道微生物区系主要由Firmicutes、Proteobacteria、Actinobacteria、Bacteroidetes组成,其中Firmicutes与Proteobacteria是优势门[12],肠杆菌科(Enterobacter)、肠球菌科(Enterococcus)、Streptococcus、乳杆菌科(Lactobacillus)、类杆菌科(Bacteroides)等为常见的菌[8,13-14],双歧杆菌(Bifidobacterium)是优势菌,在生命早期的一定时期内其相对丰度呈上升趋势[15]。婴儿肠道微生物区系的组成也会受到多种因素的影响,常见的有围产期抗生素、分娩方式、喂养方式等,这些影响因素能够使婴儿肠道微生物的组成存在明显和长期的差异[10,12]。
母乳是新生儿出生后至前几个月成长发育的黄金标准营养食物,世界卫生组织建议在生命的前6个月全母乳喂养[1,16]。母乳是婴儿微生物区系组装的最早来源之一,生命早期肠道微生物区系的发育影响免疫系统的成熟、营养吸收以及避免病原体定植[14,17-18]。故鼓励及倡导纯母乳喂养,本文就对母乳与婴儿肠道微生物的影响因素以及母乳微生物和婴儿肠道菌群之间的关系进行系统的研究,考察母乳微生物对婴儿肠道菌群的影响,分析母乳微生物和婴儿肠道菌群之间的关系。
1 母乳中微生物的影响因素
1.1 地理位置、环境
地理位置、环境会影响母乳中的微生物,不同地理位置、环境的母乳样品的核心属相同,但细菌的种类及数量存在着差异。Lackey等通过细菌16S rRNA基因的V1-V3区域测序技术对11个不同国际地点的母乳与婴儿粪便的研究发现,相同地区的母乳细菌组成比不同地区的相似性更大,相同地区中有时也存在不同的核心类群[6]。Kumar等的研究也有类似结论,不同国家的母乳微生物群组成存在显著差异[19]。Mansoureh等对健康伊朗母亲母乳乳酸杆菌(Lactobacillus)潜在益生菌的研究结果表明,与城市母亲相比,农村母亲的log10 Lactobacillus计数中位数高于城市母亲[20]。但是黄卫强对我国4个地区母乳中微生物多样性的研究发现,4个地区检测到的属的总数不同,但是母乳中的优势菌属不受地理位置影响,4个地区的母乳菌属α、β多样性分析存在一定的差异但是不明显,由此可见,地理位置对母乳中微生物多样性并无明显影响[21]。故地理位置及环境因素会使母乳微生物区系产生差异,但差异显著与否还需要进一步的研究。
1.2 泌乳阶段
不同泌乳阶段母乳微生物区系不同,分为初乳(怀孕后期和新生儿出生后4~5 d的乳汁)、过渡乳(新生儿出生后6~10 d的乳汁)和成熟乳(产后11 d到9个 月 的 乳 汁)3个 阶 段,Enterobacter、Bifidobacterium、Staphylococcus受影响较大。在泌乳的不同阶段,母乳微生物区系的组成发生了实质性的变化[5]。Raul等对3个不同时间点的母乳微生物群落进行研究发现,初乳样品中魏氏杆菌(Weisella)、明串珠菌(Leuconostoc)最常见,两者均属于Lactobacillus,其次是Staphylococcus、Streptococcus和乳球菌(Lactococcus),而1个月和6个月的母乳样品中Lactobacillus仍然是最丰富的,但韦永氏球菌属(Veillonella)、纤毛菌属(Leptotrichia)和普氏菌属(Prevoella)显著增加,通过3个不同时间点(初乳、分娩后1个月和6个月)的乳样的稀疏曲线分析发现当序列以97%的序列一致性(确定物种边界的一致值)聚集时,OTU>1 000个,当以95%的一致性聚集时,OTU>800个,当以90%的一致性聚集时,OTU>400个,初乳中的OTU均高于1个月和6个月的母乳中的OTU,初乳比成熟乳具有更高的微生物多样性[22]。同样研究表明泌乳阶段不同,母乳中微生物的数量及多样性不同,初乳中的细菌多与皮肤、产道菌群相关,多样性高;过渡乳、成熟乳中的细菌多与婴儿口腔菌群相关,多样性随泌乳时间的延长不断降低[23]。此外,在不同的泌乳阶段,有一些菌存在特殊的变化。Chen等通过分子方法(Illumina MiSeq测序)对台湾健康母亲母乳微生物的研究发现,初乳和过渡乳中Staphylococcus、Streptococcus和罗氏菌(Rothia)的比例和分布相似,此外,初乳中的Enterobacter(相对丰度为10%)比过渡乳中的Enterobacter(相对丰度为1%)含量高,相反,过渡乳含有约8%的Enterococcus,初乳中其含量约为0.5%[24]。黄卫强利用荧光定量PCR技术对母乳中常见菌属进行定量分析,结果显示成熟乳样品中Enterobacter、Bifidobacterium的含量极显著高于初乳样品(P<0.001),成熟乳样品中Staphylococcus的含量显著高于初乳样品(P<0.01)[21]。Khodayar-Pardo等的研究发现,在整个哺乳期,Bifidobacterium和Enterococcus的数量都在增加,Lactobacillus和Staphylococcus的数量在不同泌乳阶段也呈上升趋势,结果表明,泌乳阶段对Bifidobacterium和Enterococcus的影响较大[25]。李小娟和Mansoureh等的研究均发现从初乳到成熟乳,Lactobacillus的数量呈上升趋势[20,26]。综合以上研究结果,在不同的泌乳阶段,初乳比过渡乳和成熟乳具有更高的微生物多样性,而成熟乳中微生物种类数目高于初乳。
1.3 分娩方式
分娩方式也会影响母乳中的微生物,阴道分娩的母乳与剖腹产的母乳在细菌分类组成上有显著差异,与剖腹产的母乳相比,阴道分娩的母乳中细菌多样性、丰度及均匀程度更高[21-22]。Hermansson等的研究发现,利用冗余判别分析(RDA)发现分娩方式对母乳的微生物成分有独立的影响,剖腹产分娩与母乳微生物多样性和丰富度降低有关,在阴道分娩的母亲的母乳中检测到的16个细菌家族在剖腹产的母亲的母乳中未发现[27]。Toscano等的研究表明,阴道分娩的母乳中细菌多样性和丰度更高,经阴道分娩的母乳中,Streptococcus和嗜血杆菌(Haemophilus)含量较高,而盐单胞菌(Halomonas)、Prevoella、假单胞菌(Pseudomonas)和Staphylococcus的丰度较低[28]。但Khodayar-Pardo等对足月婴儿组不同分娩方式下的母乳微生物区系研究发现,在初乳和过渡乳中,剖腹产的母乳比阴道分娩的母乳总细菌浓度更高,但在成熟乳样中检测到相似的细菌浓度,初乳样本更多的是Streptococcus,阴道分娩更明显(P=0.026),Bifidobacterium在初乳(P=0.026)和过渡乳(P>0.05)中的检出率也高于剖腹产[25]。综合以上研究结果,不同的分娩方式,阴道分娩的母乳中微生物多样性及丰度均高于剖腹产,而剖腹产的母乳中微生物数目比阴道分娩方式生产的高。
1.4 孕妇身体健康情况
孕妇的身体情况对于母乳菌群也会产生一定的影响,包括妊娠时间、母体身体质量指数(BMI)、孕妇年龄等因素。Khodayar-Pardo等的研究表明初乳、过渡乳和成熟乳中的Bifidobacterium含量与胎龄之间存在直接相关性,在哺乳期的所有阶段,足月婴儿组的Bifidobacterium计数均显著高于早产儿[25]。母体BMI也会影响母乳微生物群组成,Raul等对阴道分娩的母亲的母乳样本进行分析发现,母体BMI越高,初乳中Lactobacillus数量越多,同样,在前6个月的母乳中,母体BMI越高,Staphylococcus数量越多、Bifidobacterium数量越少[22]。刘婉欣研究分析中发现,母体BMI、年龄与母乳菌群的相关性均呈现出显著差异:孕前或足月儿的母体BMI,对克雷伯氏菌属(Klebsiella),伯杰菌属(Bergeyella),霍氏真杆菌(Eubacterium hallii)等与脂质代谢相关菌,体现出显著相关性[29]。Kumar等的研究显示超过98%的女性母乳中Firmicutes与母体BMI呈正相关[19]。Moossavi等对母乳微生物区系的研究发现母体BMI与Proteobacteria多样性呈负相关,与Firmicutes多样性呈正相关,母体特应性和多胎与较高的Actinobacteria丰富度相关[30]。母体BMI与饮食有关,母体脂肪的摄入量会影响母乳中的脂肪酸、进而影响特定的细菌组成,如Firmicutes与n-3脂肪酸含量呈正相关、Klebsiella与短链脂肪酸代谢密切相关[19,21]。还有研究发现,母体年龄也会对菌群有一定影响,Proteobacteria与母体年龄呈现负相关差异,而疣微菌门(Verrucomicrobia),AKK菌(Akkermansia)与母体年龄呈现正相关[29]。
泌乳阶段、分娩方式、孕妇健康情况对母乳菌群的影响如图1所示。
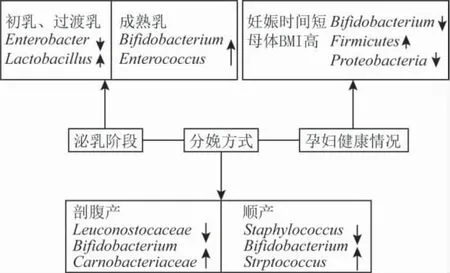
图1 母乳菌群影响因素[19-20,22,24-26,28,30]
2 婴儿肠道微生物的影响因素
2.1 泌乳阶段
泌乳阶段同样对于婴儿肠道微生物有一定的影响,Kuang等通过评价样本区系内α多样性来估计粪便微生物群落的丰富度和均匀度发现,新生儿的样本区系内α多样性显著低于2个月大的婴儿,样本区系内α多样性随着婴幼儿年龄的增加而增加[13]。Yang等对婴儿出生时、出生后42 d、3个月和6个月的粪便进行分析发现细菌丰度和α多样性随年龄显著增加,狭义梭状芽孢杆菌1(Clostridium sensu stricto 1)和大肠杆菌-志贺氏菌(Escherichia-Shigella)在出生时富集,而Bacteroides和Escherichia-Shigella在42 d和3个月的时间段内占优势,此外还发现了8种不同的肠型,包括Bacteroides、柯林斯菌(Collinsella)、Bifidobacterium、Escherichia-Shigella、Streptococcus、消化杆菌(Peptoclostridium)、丹毒杆菌(Erysipelatoclostridium)和瘤胃球菌群(Ruminococcus),这些肠型在6个月期间更为丰富[31]。而Pannaraj和Backhed等人的研究发现母乳喂养组的α多样性在3月龄前无明显变化,但在6月龄后显著增加,粪便细菌多样性随着年龄的增长而增加,这表明随着时间的推移,婴儿肠道微生物群落会变得更加复杂[32-33]。
2.2 分娩方式
不同分娩方式的婴儿肠道微生物区系菌群结构不同,特别是Bifidobacterium和Lactobacillus的数量和组成[34]。未分类肠杆菌科(Unclassified Enterobacter)和Bifidobacterium是两种分娩方式中的常见属,阴道分娩婴儿的优势属有Streptococcus、Bacteroides,而剖腹产婴儿则是Enterococcus、Clostridium,且阴道分娩婴儿的Bifidobacterium多样性更高[12]。Kuang等的研究发现经阴道分娩的婴儿(新生儿和2月龄)粪便微生物区系中Bacteroides、副杆菌(Parabacteroides)和巨型单胞菌(Megamonas)显著富集,剖腹产婴儿粪便中Prevoella、Streptococcus和Clostridium显著富集[13]。Nagpal等研究发现,与阴道分娩婴儿相比,剖腹产婴儿定植Lactobacillus和Lactobacillus亚群的几率要低得多,阴道分娩组胎粪中共检出7个Lactobacillus亚群/种,而剖腹产组仅检出加色乳杆菌亚群(Lactobacillus gasseri subgroup)和短链乳杆菌亚群(Lactobacillus brevis)2个成员,对Lactobacillus的随访分析显示,与阴道分娩婴儿相比,剖腹产婴儿在出生前6个月的不同时间点Lactobacillus和几个亚群及种的检出率仍然显著或不显著地低,但这些差异在3岁时趋于消失[8]。Mitchell等研究发现大多数剖腹产(计划剖腹产与紧急剖腹产)出生的婴儿,出生后的第一周肠道菌群中并无Bacteroides明显存在,33/35(94%)的计划剖腹产与紧急剖腹产出生的婴儿在出生的第一周内有可检测到的Bacteroides(≥0.1%)水平,在第2周,剖腹产(计划剖腹产与紧急剖腹产)出生的婴儿比顺产出生的婴儿肠道Bacteroides菌群检出率更低,此外还发现计划剖腹产与紧急剖腹产出生婴儿的微生物区系没有显著差异[35]。Stewart等的研究也发现阴道分娩婴儿中Bacteroides(尤其是脆弱类杆菌(Bacteroides fragilis))的水平较高[36],其原因推测与婴儿通过阴道分娩有关,与剖腹产婴儿相比,阴道分娩婴儿接触母体阴道肠道的时间更长,而Bacteroides主要存在于人体肠道及生殖道中,不同分娩方式的婴儿接触细菌来源不同[36-37]。Rodríguez等和Gabriel等的研究发现阴道分娩的婴儿被母体阴道和粪便细菌定植,包括Lactobacillus和Bifidobacterium,通过剖腹产出生的婴儿不会直接接触母体微生物,而母体皮肤和医院环境相关的微生物有可能在其肠道定植[38-39]。
2.3 早产儿与正常周龄婴儿
胎龄也是影响婴儿肠道微生物组成的因素之一,通过对早产婴儿1月龄粪便样本中的微生物分析发现,早产婴儿的肠道微生物区系的形成时间晚于足月产婴儿,早产婴儿微生物区系多样性低,含有比例较多的Proteobacteria、Enterobacter、Staphylococcus、Enterococcus和 梭菌(Clostridium),Bifidobacterium和Bacteroidetes数量较少,Bifidobacterium的定植率较低且延迟[40-42]。阴道分娩足月出生的婴儿,变形杆菌(Proteobacteria)等兼性厌氧微生物群逐渐被Bifidobacterium和Clostridium等厌氧菌所取代[43]。La Rosa等对于58名早产儿的研究发现,在与生命日相关的多维标度图中,芽孢杆菌(Bacillus)作为主要菌株在最早的样本中被发现,Clostridium在较大婴儿的粪便中数量最多,在33~36周孕后年龄区间的样本中也最丰富,婴儿粪便中Bacillus慢慢减少,Clostridium慢慢增加,生命天数与Bacillus比例的减少和Clostridium比例的增加显著相关,而γ-保护性细菌在出生后不久就会蓬勃发展,并随着婴儿年龄的增长保持丰富[44]。
2.4 母体使用抗生素、益生菌等
孕妇使用抗生素、益生菌也会影响到婴儿的肠道微生物,Zimmermann等的研究发现与未接触GBS(B组链球菌)、IAP(产中抗生素预防)的婴儿相比,接触GBS及IAP的婴儿细菌多样性较低,Actinobacteria(特别是Bifidobacterium)的相对丰度较低,肠道微生物区系中Proteobacteria的相对丰度较大[45]。Kumbhare等的文章中提出在分娩期间未接触产中抗生素的母亲所生的婴儿中,Streptococcus、双菌科(Gemellaceae)和Lactobacillus的含量很高,在分娩期间接触抗生素的婴儿中,发现Proteobacteria很多,此外抗生素治疗后,大多数婴儿肠道样本中Bifidobacterium和Veillonella的相对丰富度降低[46]。越来越多的数据表明Proteobacteria可能是疾病微生物的特征菌株,主要与代谢紊乱和炎症性肠病相关,证明Proteobacteria可能具有促炎症特性,这应该就是在分娩期间接触抗生素的婴儿Proteobacteria丰富的原因[47]。Sanz的文章中提到在围产期和哺乳期使用益生菌,有利于婴儿肠道内潜在有益细菌的定植,母亲在分娩前4周和产后3周服用鼠李糖乳杆菌(L.rhamnosus GG)可引起新生儿Bifidobacterium转移和初始建立的特异性改变,母亲服用L.rhamnosus GG的婴儿有更高含量的短双歧杆菌(Bifidobacterium Breve)和更低含量的青春双歧杆菌(Bifidobacterium adolescentis)[48]。孕妇在妊娠期间、哺乳期使用抗生素或服用益生菌都会对婴儿的肠道微生物产生一定的影响。
2.5 配方奶粉喂养与母乳喂养
Gritz等研究发现婴儿的肠道微生物区系是一个高度动态的群落,在生命的第一天开始逐步和持续形成的,营养(母乳喂养与配方奶喂养)是其构成的最相关的驱动因素[49]。喂养方式影响着婴儿肠道微生物群落的发展,与配方奶粉喂养的婴儿相比,纯母乳喂养的婴儿肠道菌群多样性较低但是细菌的数量较高[1,18]。Ho等对7项微生物组研究(来自684名婴儿的1 825份粪便样本)进行分析,发现在出生的前6个月,非纯母乳喂养组的肠道细菌多样性、Bacteroides和Firmicutes的相对丰度以及与碳水化合物代谢相关的预测微生物途径始终高于纯母乳喂养组[50]。但Yang等对于6周前婴儿肠道微生物的研究发现,母乳喂养组婴儿肠道微生物丰度明显高于奶粉喂养婴儿及母乳、奶粉混合喂养婴儿,不同喂养方式的婴儿粪便微生物区系最丰富的是Unclassified Enterobacter,其次是Bifidobacterium,母乳喂养婴儿这两种细菌的丰度明显高于其他喂养方式,此外不同喂养方式下的婴儿肠道微生物含量不同,母乳喂养组Streptococcus含量较高,奶粉喂养组Enterococcus较多,而混合喂养组婴儿Enterococcus较多[12]。不同喂养方式对于婴儿肠道微生物区系的影响还需要进一步的研究。
3 母乳微生物与婴儿肠道微生物之间的关系
母乳中含有复杂的细菌群落,可能对婴儿肠道微生物区系的建立产生直接影响[30]。Jost等的研究发现新生儿肠道微生物区系的建立是肠道成熟、代谢和免疫规划的关键阶段,也是影响短期和长期健康状态的关键阶段,母乳有益地影响了这一过程,因为它能够依据婴儿不同年龄阶段营养和生物活性成分的需求而发生动态变化,并向新生儿肠道提供共生母体细菌,其中包括Lactobacillus以及Bifidobacterium等专性厌氧菌,Bifidobacterium可能来源于母体肠道,是母婴沟通的一种新形式。此外,母乳中含有广泛的低聚糖,可以促进特定细菌群体的生长和活性,特别是Bifidobacterium和Bacteroides。对兼性厌氧菌如Staphylococcus、Streptococcus以及更重要的肠道相关专性厌氧菌如Bifidobacterium、Bacteroides等种群水平的研究支持:存在于母乳中的细菌能够在消化中存活并在婴儿肠道中发挥先驱细菌的作用,婴儿肠道微生物区系的组成在一定程度上反映了母乳组成的观点[51]。Boudry等也有类似结论,婴儿每天摄入log5至log7母乳相关细菌,母乳微生物区系是一个连续的共生或益生菌来源,能够在生命的第一阶段定居在婴儿肠道或影响婴儿肠道微生物区系,婴儿肠道微生物和母乳微生物区系之间存在很强的重叠,在元基因组分析中,母乳中发现的物种中有76%存在于婴儿的肠道中,母乳和婴儿肠道之间的共同物种包括启动肠道微生物区系组装的先驱属,尤其包括兼性厌氧菌,如Staphylococcus、Streptococcus、Lactobacillus等,它们有助于产生厌氧环境,并有利于随后植入专性厌氧菌,如Bifidobacterium、Bacteroides等[52]。
Nurrahma的研究表明母乳是婴儿的营养来源,含有大量天然益生菌,可通过母乳传递给婴儿,从母乳中获得的细菌有大肠杆菌(Escherichia coli)、Enter-obacter、Staphylococcus、Bacteroides、Bifidobacterium、Enterococcus和Lactobacillus等[53]。席晓霞的研究发现在胎粪样品中含量最多的细菌门是Firmicutes(76.74%)、Proteobacteria(19.94%)、Bacteroidetes(2.69%)和Actinobacteria(0.33%),这4个菌门的含量共占到了测序序列总数的99.70%。而酸杆菌门(Acidobacteria,0.09%)、栖热菌门(Deinococcus-Thermus,0.01%)、抚微菌门(Verrucomicrobia,0.01%)、软壁菌门(Tenericutes,0.01%)、梭杆菌门(Fusobacteria,0.01%)、氰基细菌(Cyanobacteria,0.002%)等菌的含量依次递减,在母乳样品中含量最多的细菌门是Firmicutes(51.08%)、Proteobacteria(41.07%)、Bacteroidetes(4.97%)和Actinobacteria(1.90%),这4个菌门的含量共占到了测序序 列 总 数 的99.04%。而Fusobacteria(0.20%)、Deinococcus-Thermus(0.16%)、Acidobacteria(0.08%)、Cyanobacteria(0.06%)、Tenericutes(0.05%)等的含量依次递减,研究结果表明母乳微生物与婴儿肠道菌群之间存在着一定的关系[54]。丁梦帆的研究发现婴儿粪便菌群构成和多样性与成熟乳最为相近,通过Cluster聚类分析找出母乳垂直传递至婴儿肠道的菌属,出现率大于50%,菌属相对含量大于0.1%,被认为是可能的优势垂直传递菌属,根据以上标准,主要的传递菌属为Enterococcus、Bifidobacterium(长双歧杆菌亚种(Bifidobacterium-longum-subsp-longum))、Bacteroides、Rotha、Escherichia-Shigelle、Streptococcus、Staphylococcus。还有研究证明了母亲与婴儿之间存在菌群垂直传递关系,婴儿肠道微生物有27.7%来自于母乳,10.3%来自于乳腺皮肤[55]。
Murphy等对10对母婴在出生后前3个月的母乳和婴儿粪便中的细菌群落进行特征分析发现,一些典型的肠道相关属在母乳和婴儿粪便中都是常见的,包 括Bifidobacterium、Bacteroides、Enterococcus、Lactobacillus、Clostridium、球菌(coccus)、Escherichia-Shigella和毛螺菌科(Lachnospiraceae)的成员,这些属为婴儿粪便与母乳共有属,且占婴儿粪便菌群总相对丰度的70%~88%,支持母乳细菌垂直向婴儿肠道转移的假说,此外,从一对母婴的母乳和粪便中分离到了相同的Bifidobacterium Breve和植物乳杆菌(Lactobacillus Plant Arum)菌株,通过母乳喂养的细菌垂直转移可能有助于在发育中的婴儿肠道中初步建立微生物区系。研究还发现母乳或婴儿粪便存在各自所特有的属,母乳所独有的伊丽莎白变形杆菌(Elizabethkingia)和黄杆菌属(Flavobacterium);而在婴儿粪便中,迟缓埃格特菌(Eggerthella)是唯一没有在母乳样本中发现的属,这是导致Actinobacteria相对丰富的原因之一[56]。
有学者采用婴儿肠道微生物与母乳微生物配对的方法来揭示两者之间微生物的相互关系,Lackey等对生活在不同国际地点的妇女的母乳微生物群和她们的婴儿的粪便微生物群进行比较分析发现,婴儿粪便中28个聚集属的相对丰度与母乳样中29个聚集属的相对丰度之间存在一些简单的关系(P≤0.01,0.3≥rs≥0.3),母乳中的冷杆菌(Psychrobacter)和无色菌(Achromobacter)的相对丰度与粪便中Leuconostoc呈正相关,母乳中Lactobacillus的相对丰度与粪便中Lactobacillus的相对丰度呈正相关,在多变量的基础上,聚集的母乳属和聚集的婴儿粪便属之间的典型相关性支持了这些不同和复杂的群落之间的显著关系(r1=0.663,P<0.000 1)。当用队列绘制时,婴儿粪便和母乳分类群之间的关系似乎是特定于队列的,即婴儿的粪便微生物群和他们母亲的乳汁微生物群在队列内比其他队列更相似,尽管队列内妇女和婴儿之间的差异仅略低于队列之间的差异。重要的是,研究的数据为母乳微生物群和母乳喂养婴儿粪便微生物群之间的关系提供了证据,在婴儿粪便中发现的大约70%~88%的属也在母乳中被发现[6]。Fehr等的研究也有类似的结论,在3个月时,实际母婴对的婴儿肠道和母乳微生物区系相似性略高于随机母婴配对的微生物区系(P<0.001),相比之下,3个月母乳和1岁婴儿肠道的实际配对和随机配对之间没有明显的差异。进一步评估了母乳和婴儿肠道中共有细菌的相对丰度之间的相关性,一般来说,在3个月时,母乳中任何给定的扩增序列变异(amplicon sequencing variants ASV)都与婴儿肠道中的相同ASV相关,这些相关性均为正相关,其中8/13值得注意(P(FDR)<0.1)[57]。
相同的,Pannaraj等人的研究也发现在婴儿出生后至少6个月的时间里,婴儿的粪便中可以检测到乳汁细菌,母乳和乳晕皮肤中细菌的贡献率在出生后第一个月最高,母乳和皮肤中的细菌占主要母乳喂养婴儿肠道细菌的近40%,随着婴儿年龄的增长,细菌的贡献率逐渐下降。使用多个距离度量的比较显示,与随机配对相比,真正的母婴配对中婴儿粪便与母乳或乳晕皮肤之间的距离更近,总体而言,与随机配对相比,478对OTU中的26对在母婴配对中共享更显著。寡核苷酸分型分析显示,Streptococcus、Veillonella和Rothia有显著的共同之处。研究中描述了母婴配对中的细菌群落,并提供了数据,表明母亲母乳和乳晕皮肤中的细菌被转移到婴儿的肠道,这一观点的关键支持来自于婴儿肠道中的细菌谱系与其母亲和随机母亲的比较,结果显示正确配对中有更多的共同谱系。研究结果赞成这样的观点,即细菌的传播主要发生在母亲和婴儿之间[32]。
此外,Biagi等对母乳、婴儿口腔和肠道的细菌生态系统的研究发现,母乳的平均微生物区系多样性明显高于婴儿粪便和口腔拭子,即36名登记的母亲的乳汁生态系统比她们孩子的粪便或口腔生态系统更丰富,细菌种类也更相似[14]。Karina等研究发现,分析母乳样品与新生儿粪便样品两者的α多样性发现,Shannon指数(效应值(Effect size)0.745,P<0.001)和辛普森指数(Simpson指数)(Effect size0.584,P=0.006)显示母乳样品的细菌多样性高于新生儿粪便微生物区系,此外,采用微生物来源追踪分析来估计新生儿粪便中来源于母乳细菌的比例,数据显示,新生儿平均67.8%的细菌来自母乳,其余平均32.2%的细菌来自不明来源(P<0.006,Wilcoxon符号秩和检验),他们的研究提供了证据,证明母乳是新生儿出生后最初几天胃肠道细菌的主要来源之一[58]。
还有研究分析了母婴可能传递的细菌种类,刘佳提到有国外学者研究发现,在婴儿粪便中检出的Staphylococcus、Lactobacillus和Bifidobacterium与其母乳中相同,这表明细菌可以通过母乳直接传递到婴儿肠道,母乳是婴儿健康生长的最佳自然选择[59]。有多位学者的研究也有相似的结论,吕宁等的研究中阐述了在母乳和婴儿粪便中有相同的Bifidobacterium、Lactobacillus、Staphylococcus,两者最相似的是Staphylococcus,母乳可能是婴儿肠道微生物的来源[60]。Laursen等对34对母婴母乳样本和婴儿粪便中的微生物区系分析发现,在哺乳期,母乳和婴儿粪便中的微生物群落都发生了显著变化,在5月龄和9月龄时,婴儿粪便中检测到的细菌种类中,分别有33%和23%与相应的母乳共用,其中Streptococcus、Veillonella和Bifidobacterium最常见[61]。
通过以上的研究,我们可以推断母乳微生物与婴儿肠道微生物之间存在着一定的联系,多样性方面母乳微生物多样性高于婴儿肠道微生物多样性,典型的肠道相关属在母乳和婴儿粪便中都是常见菌,此外还发现Bifidobacterium、Staphylococcus和Lactobacillus存在从母乳中转移到婴儿肠道的可能。
4 结语
母乳中除含有大量营养物质外还含有大量的微生物,母乳是婴儿微生物区系组装的最早来源之一,生命早期肠道微生物区系的发育影响免疫系统的成熟、营养吸收以及避免病原体定植。本综述通过对母乳微生物与婴儿肠道微生物的研究,表明母乳与婴儿肠道微生物种类及母乳微生物向婴儿肠道的转移受多种因素包括分娩方式、妊娠时间、泌乳阶段、孕妇身体健康情况、地理位置及环境、喂养方式、母体使用抗生素、益生菌等的影响。此外还总结发现母乳微生物存在向婴儿肠道“垂直转移”的可能,双歧杆菌(Bifidobacterium)、葡萄球菌(Staphylococcus)和乳杆菌(Lactobacillus)从母乳转移到婴儿肠道的可能性较大。通过此项研究,可以进一步探究两者之间的具体关系以及进一步开发利用母乳这一重要菌库筛选益生菌,为改善婴儿肠道生态、维持婴儿肠道健康提供新的方法和策略。
