青岛地区鸡源大肠埃希氏菌的分离鉴定及耐药性分析
2022-12-07任海燕刘旭东郝智慧刘志海
任海燕,刘旭东,赵 莉,郝智慧,刘志海*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830000;2.中国农业大学动物医学院,北京 100089;3.青岛农业大学化学与药学院,山东青岛 266109)
大肠埃希氏菌(Escherichiacoli)是一种常见的革兰氏阴性细菌,它具有分布面广、分离率高、传播途径多样等特点。在畜禽养殖和人类生活中,大肠埃希氏菌常通过粪便排泄等传播途径造成人类或动物细菌性疾病。最易引起大肠杆菌病,病原为禽致病性大肠埃希氏菌(Escherichiacoli)[1],包括引起皮肤、生殖系统和普通呼吸道(气囊炎)感染以及严重的心包炎、肝周炎、输卵管炎、脐炎、败血症等。这些疾病的发生,给畜禽养殖业发展造成了巨大的阻碍[2]。大肠埃希氏菌作为耐药基因及质粒传播的载体,已经成为耐药基因传播扩散的储存库,导致了细菌耐药谱范围不断扩大,多重耐药形势愈加严峻,这给该菌引起的感染性疾病防治带来了困难与挑战[3];更严重的是,现有研究表明畜禽源耐药大肠埃希氏菌正在通过从养殖场到餐桌的食物链条传递给人类,给人类健康安全带来了威胁。山东作为禽肉产业大省,畜禽养殖数量大,患病风险高,同时由于抗菌药物的不规范使用,细菌耐药性问题愈发严重。因此,了解山东青岛地区禽源大肠埃希氏菌的细菌耐药现状和流行特点,对疾病防治具有重要意义。本研究以2019年11月在青岛养殖场中采集的185份鸡泄殖腔拭子作为研究对象,通过细菌分离鉴定、药敏试验、耐药基因检测等试验,对分离的173株菌株进行耐药流行特点分析,研究结果对兽医临床指导用药、预防和控制鸡源大肠杆菌病具有重要意义。
1 材料与方法
1.1 材料
1.1.1 菌株来源 采集山东省青岛地区某规模化养殖场鸡泄殖腔拭子共185份,药敏试验质控菌株(标准菌株ATCC 25922),购自中国工业微生物菌种保藏中心。
1.1.2 培养基和试剂 麦康凯、Mueller-Hinton琼脂培养基,青岛高科技工业园海博生物技术有限公司产品;2×TaqMaster Mix(Dye Plus)、DNA Marker(DL 2 000),南京诺唯赞生物科技有限公司产品;Gold view核酸染料,北京索莱宝科技有限公司产品;亚胺培南(imipenem,IMP)、美罗培南(meropenem,MEM)、阿莫西林(amoxicillin,AMX)、头孢氨苄(cefalexin,CN)、头孢他啶(ceftazidime,CAZ)、头孢噻肟(cefotaxime,CTX)、头孢吡肟(cefepime,FEP)、多黏菌素E(colistin,CT)、四环素(tetracycline,TCY)、替加环素(tigecycline,TGC)、庆大霉素(gentamicin,GEN),武汉威得利化学科技有限公司产品。
1.1.3 主要仪器 PCR仪、凝胶成像仪,美国Bio-Rad公司产品;SW-CJ-2D型超净工作台,苏州净化设备有限公司产品;WGZ-2XJ细菌浊度仪,上海昕瑞仪器仪表有限公司产品;G180DS立式高压蒸汽灭菌器,致微(厦门)仪器有限公司产品;Blue pard生化培养箱,上海一恒科学仪器有限公司产品;冷冻离心机,德国Eppendorf公司产品。
1.2 方法
1.2.1 细菌分离及种属鉴定 2019年9月至12月期间,随机采集鸡泄殖腔拭子样本185份。将样品置于LB肉汤中,37 ℃孵育18 h,再划线于麦康凯培养基上,37 ℃继续培养16 h~24 h后,挑选单克隆(粉红色可疑菌落)富集培养,纯化后菌株采用煮沸法提取细菌DNA模板,通过16S rRNA,PCR扩增后,将阳性产物送去测序,结果在NCBI数据库比对鉴定。16S rRNA引物为27F:5′-AGTTTGATCCTGGCTCAG-3′和1492R:5′-AGGCCCGGGAACGTATTCAC-3′,目的片段长度约1 500 bp。PCR 反应参数:94 ℃ 5min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共30个循环;(72 ℃5 min。运行反应体系为30 μL:DNA模板1 μL,上、下游引物各1 μL,2×Taq聚合酶15 μL,ddH2O补齐至30 μL。
1.2.2 药敏试验 采用美国临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的判定标准[4],使用琼脂稀释法测定11种抗菌药物对大肠埃希氏菌的最低抑菌浓度(minimum inhibitory concentration,MIC),以大肠埃希氏菌ATCC 25922作为质控菌株。
1.2.3 耐药基因检测 对分离得到的173株大肠埃希氏菌用PCR检测5类共23种常见耐药基因,分别为碳青霉烯类(blaNDM、blaVIM、blaIMP、blaKPC);β-内酰胺类(blaCTX-M);AmpC-β内酰胺酶类(blaDHA、blaACC);黏菌素类(mcr-1~5)和四环素类(tetA、tetB、tetC、tetD、tetE、tetG、tetK、tetM、tetO、tetQ、tetX),引物信息根据表1参考文献中对应的试验条件,确定琼脂糖凝胶电泳条件(琼脂糖浓度、电压及运行时间等),PCR产物在凝胶成像系统上观察记录条带位置并拍照。
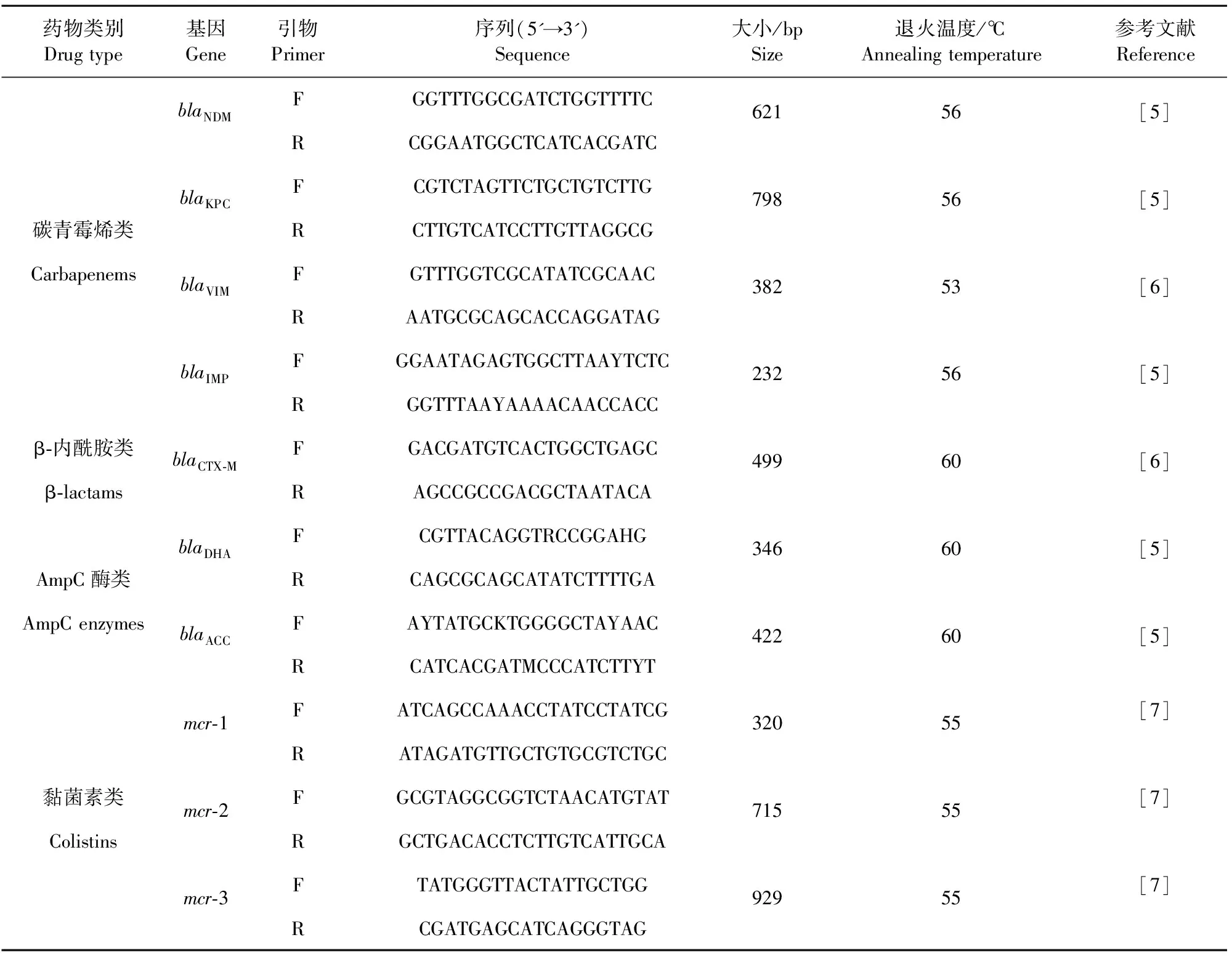
表1 耐药基因引物序列
2 结果
2.1 大肠埃希氏菌分离鉴定结果
185份泄殖腔拭子样本在麦康凯培养基上分离纯化,将疑似样本经16S rRNA测序比对后,共分离出173株大肠埃希氏菌,分离率为93.50%。
2.2 药敏试验结果
173株大肠埃希氏菌对11种抗菌药物的药物敏感性结果显示,所有分离株对阿莫西林、头孢氨苄和四环素均耐药,耐药率100.00%;对头孢吡肟、头孢噻肟、庆大霉素、多黏菌素E和头孢他啶耐药率较高,依次为84.40%(n=146)、83.20%(n=144)、79.80%(n=138)、75.70%(n=131)、61.30%(n=106);对亚胺培南、美罗培南和替加环素的耐药率相对较低,分别为9.80%(n=17)、7.50%(n=13)、0.58%(n=1)(图1)。进一步分析发现,所有分离菌株均表现多重耐药,以耐7种和8种抗菌药物的菌株为主,占比率分别为22.54%和32.94%,最多耐10种抗菌药物(7.51%)(表2)。
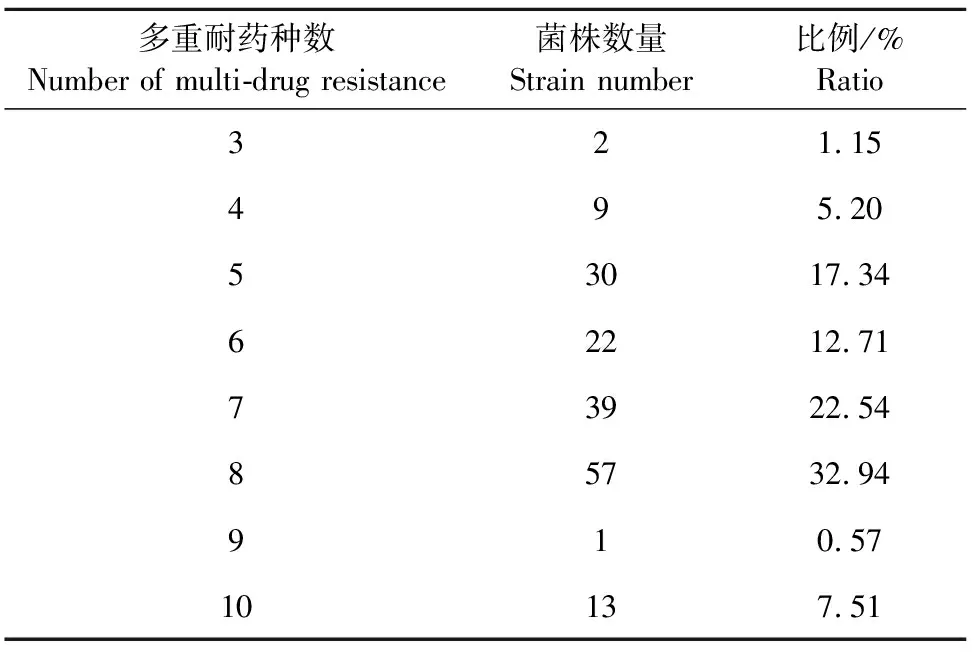
表2 173株大肠埃希氏菌多重耐药情况
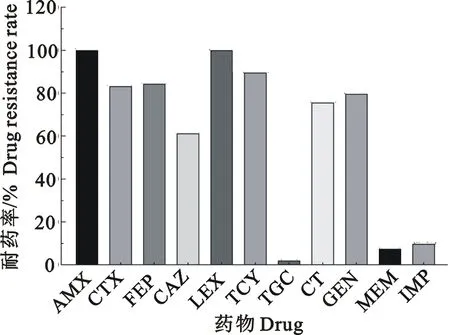
图1 173株大肠埃希氏菌耐药结果
2.3 耐药基因检测
173株大肠埃希氏菌对5类23种抗菌药物耐药基因检测结果见图2。碳青霉烯类耐药基因blaNDM检出率为7.50%(13/173);β-内酰胺类耐药基因blaCTX-M检出率为96.00%(166/173);AmpC-β内酰胺酶类耐药基因blaACC检出率较低,为4.60%(8/173);四环素类耐药基因tetA检出率高达90.80%(157/173),其次为tetM和tetB,检出率依次为15.30%(26/173)和3.50%(6/173);黏菌素类耐药基因mcr-1检出率为37.90%(66/173),其他耐药基因均未检测出,分离菌株部分基因电泳条带见图3。
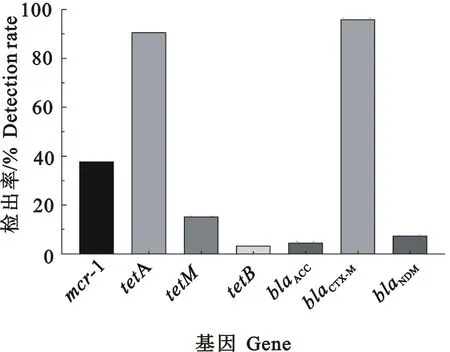
图2 鸡源耐药大肠埃希氏菌耐药基因检出结果
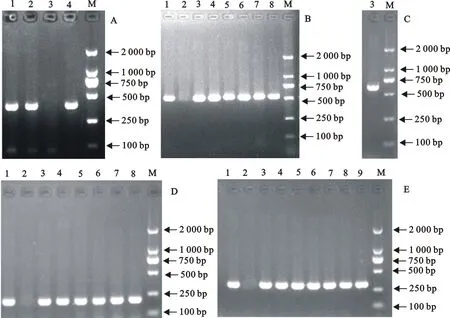
A.blaACC;B.blaCTX-M;C.blaNDM;D.tetA;E.mcr-1;M.DNA 标准DL 2 000;+.阳性对照;-.阴性对照;1~7.分离菌株
2.4 耐药基因共存情况分析
检出的7种耐药基因在鸡泄殖腔中的共存情况见表3,在173株大肠埃希氏菌中,有4个菌株含有最多5个耐药基因,组合形式为tetA-tetM-mcr-1-blaCTX-M-blaACC和tetA-tetM-mcr-1-blaCTX-M-blaNDM,占检测样本的2.31%;有76个菌株含有2个耐药基因,占检测样本43.93%,有72个菌株含有3个耐药基因,占检测样本41.62%,其中tetA-mcr-1-blaCTX-M为最常见耐药基因组合形式;只含有1种耐药基因的样本有11份,为blaCTX-M和tetB,占检测样本的6.36%。

表3 173株大肠埃希氏菌耐药基因共存情况及耐药基因谱型
3 讨论
本次研究从禽养殖场采集185份拭子,最终分离出大肠埃希氏菌173株(分离率为93.50%),与先前报道的山东菏泽地区鸡场分离率96.67%、泰安地区90.00%结果基本一致[1],进一步说明了山东地区鸡源耐药大肠埃希氏菌的流行率较高。
药敏试验显示,本研究在养鸡场分离得到的173株大肠埃希氏菌呈现多重耐药性,11种抗菌药物的耐药率为0.58%~100.00%,耐药情况较为严重。盲目使用抗菌药物是造成细菌耐药的罪魁祸首,抗菌药物对病原菌产生选择性压力,病原菌耐药率比例上升。本研究中的所有大肠埃希氏菌呈现多重耐药,并且菌株主要为7种~8种药物的多重耐药,这与秦春芝等[9]表述的多药耐药现象一致,耐药性较为严重的有阿莫西林、头孢氨苄和四环素,头孢吡肟、头孢噻肟、庆大霉素、多黏菌素E和头孢他啶的耐药也比较高,这也与已报道的河北省肉鸡养殖场和山西病鸡禽源大肠埃希氏菌耐药性研究的结果较为一致[10-11],说明不同地区的禽源大肠埃希氏菌的多药耐药情况已呈现普遍趋势。
此外,禽源大肠埃希氏菌中贮存的耐药基因,使抗菌药物的治疗效果一再降低[12]。本研究中四环素类耐药基因以tetA检出为主(90.75%),黏菌素类以mcr-1为主(37.90%),这与一项青岛地区报道的结果相同[13],表明tetA和mcr-1是造成四环素类和黏菌素类耐药的主要原因。mcr-1和碳青霉烯类耐药基因的共同传播引起了广泛关注,本研究检测到了多株mcr-1与blaNDM共存的菌株,先前国内也有报道检出了mcr-1+blaNDM的革兰氏阴性菌,这与我们的结果也相一致[14-15]。研究中还发现了1株tetA-tetM-mcr-1-blaCTX-M-blaNDM耐药基因共存的菌株,3株tetA-tetM-mcr-1-blaCTX-M-blaACC共存菌株,说明在同一株菌株中,可存在同时介导β内酰胺类、碳青霉烯类、黏菌素类、四环素类的多种耐药基因,反映了青岛地区鸡养殖场中耐药基因传播的复杂性和组合多样性。另外,tetA-mcr-1-blaCTX-M是本次研究中占比较高的耐药基因谱,也是其他多种基因组合的基础基因谱型,这提醒我们在养殖场中应密切关注重视这3种基因的流行情况及耐药情况,从而合理规范用药。此次研究对青岛地区耐药基因情况进行了初步检测,为下一步深入探究blaCTX-M和blaNDM具体分型和耐药传播机制提供方向。
针对本研究结果,建议不同的养殖场对大肠埃希氏菌的药物敏感性应进行动态监测,健全抗菌药物耐药监测体系,阐明耐药基因的储存和传播方式,因地制宜的进行治疗与防范,才能最大程度减少耐药菌。除此之外,多种药物联合治疗,使用中药制剂与抗菌药物的交替使用,对目前防治抗菌药物单用而产生耐药性已产生了较好的效果[16-17]。建立大肠埃希氏菌耐药基因的快速检测,及时跟进和丰富不同地区的耐药流行数据库,也是减少禽类疾病发生的重点手段之一。
