食品中大肠埃希氏菌O26血清型检测方法的建立
2019-02-15林伟新蔡教英林国生王小玉游淑珠陈俊言许喜林
丁 琦,林伟新,蔡教英,林国生,王小玉,游淑珠,陈俊言,许喜林
(1.华南理工大学 食品科学与工程学院,广州 510640;2.珠海出入境检验检疫局,珠海 519000)
大肠埃希氏菌(DiarrheagenicEscherichiacoli)是一类能引起人体以腹泻症状为主的细菌,可经过污染食物引起人类发病。常见的致泻大肠埃希氏菌主要包括肠道致病性大肠埃希氏菌(EPEC)、肠道侵袭性大肠埃希氏菌(EIEC)、产肠毒素大肠埃希氏菌(ETEC)、产志贺毒素大肠埃希氏菌(包括肠道出血性大肠埃希氏菌,STEC/EHEC)和肠道集聚性大肠埃希氏菌(EAEC),虽然类别多样,但都是能够通过传播导致人畜共患病的病原菌[1-2]。据统计,美国近年来除肠道出血性大肠埃希氏菌O157外引起的食源性疾病致病病例中,有71%是由O26、O45、O103、O111、O121和O145血清型所致[3],其中O26的报道较多。肠道出血性大肠埃希氏菌 O26现已经逐渐成为美国、加拿大、澳大利亚及部分欧盟发达国家引起人类食源性疾病的主要病原菌[4-8]。因此,快速检测和鉴别食品中肠道出血性大肠埃希氏菌O26是保障食品质量安全和防止食源性疾病暴发的有效手段。本文主要应用PCR方法,通过设计引物,优化反应条件,建立食品中大肠埃希氏菌O26血清型的PCR检测方法,以便对其进行快速、准确的检测,并有利于克服传统分离鉴定方法耗时费力、步骤繁琐等不足之处。
1 材料与方法
1.1 实验材料
1.1.1 菌株
目标菌株:大肠埃希氏菌ATCC 12795。非目标菌株:大肠埃希氏菌ATCC BAA-2469、大肠埃希氏菌ATCC 23982、大肠埃希氏菌ATCC 35150、大肠埃希氏菌CCTCC AB 200051、大肠埃希氏菌EHEC Stx1、大肠埃希氏菌EHEC Stx2、大肠埃希氏菌NCTC 12900、大肠埃希氏菌EC O104、大肠埃希氏菌ATCC 43887、大肠埃希氏菌ATCC 29552、大肠埃希氏菌ATCC 33780、大肠埃希氏菌ATCC BAA-2190。
1.1.2 主要试剂
营养肉汤(广州环凯);肠道菌增菌肉汤(北京路桥);DNA 提取试剂盒(Tiangen公司);PCR反应预混液、DNA Marker DL2000(TAKARA公司);引物(Invitrogen 公司);细菌基因组DNA提取试剂盒DP302-02 (天根生化科技有限公司);琼脂糖H(生工生物工程(上海)股份有限公司);Premix ExTaq2× (大连宝生物公司)。
1.1.3 主要仪器设备
培养箱(BINDER);高压灭菌锅(HIRAYAMA);超低温冰箱(Thermo);超微量分光光度计(Thermo);高速离心机(艾本德);梯度PCR仪(艾本德);电泳仪(Bio-Rad);凝胶成像系统(Alpha Innotech)。
1.1.4 PCR引物序列
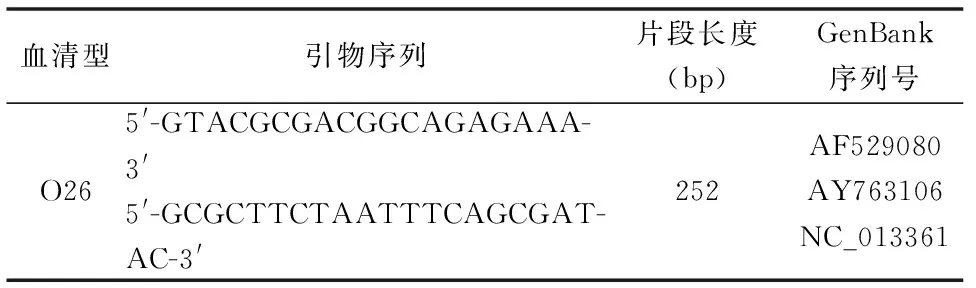
表1 引物序列与相关参数Table 1 Sequences and parameters of the primers
1.2 试验方法
1.2.1 DNA提取、浓度及纯度的测定
采用DNA提取试剂盒(离心柱型)提取DNA,按照试剂盒提供的说明书进行操作。使用超微量分光光度计测DNA的浓度。
1.2.2 PCR反应的建立
反应体系:Premix ExTaq(2×) 12.5 μL,引物对工作液1 μL,加DNA模板2 μL,加ddH2O 9.5 μL至25 μL。反应条件如下:94℃预变性5 min;94℃变性20 s,72℃延伸1 min。我们分别对影响PCR扩增的循环数、引物浓度、退火温度等因素进行探究和优化,以先确定退火时间、退火温度,最后确定循环数的顺序探究。退火时间梯度为30、60、90 s;退火温度梯度为55.2℃、55.8℃、56.7℃、57.8℃、59.1℃、60.4℃、61.7℃、62.9℃、63.9℃及64.6℃;循环数为30、35和40个,分别在不同的退火温度下同时扩增各目标片段。5 V/cm恒压电泳30 min,用凝胶成像分析系统进行分析。
1.2.3 特异性试验
将目标菌株和非目标菌株的DNA作为模板,采用优化好的反应体系和反应条件进行PCR检测,以评价引物的特异性。
1.2.4 灵敏度试验
将经提取的模板DNA,用核酸蛋白分析仪测定其核酸浓度,按照10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8稀释成浓度梯度,每个稀释度分别吸取2 μL用于PCR实验,以ddH2O代替DNA模板作为阴性对照,采用优化好的反应体系和反应条件进行PCR检测,以确定其灵敏度。
2 结果与分析
2.1 PCR反应体系的建立
2.1.1 退火时间的优化
从图1可以看出,在30、60和90 s 3个退火时间都有较清晰条带并且特异性较好,没有杂带;退火时间为90 s的扩增条带有点拖尾,30 s条带稍亮于60 s条带。在没有明显差异时,考虑到退火时间短可以降低非特异性扩增概率,同时考虑检测的快捷原则,所以选择30 s作为PCR反应的退火时间。

M:DL2000 Marker ;1~2:退火时间30 s;3~4:退火时间60 s;5~6:退火时间90 s
图1退火温度对单重PCR的影响
Figure 1 The effect of annealing temperature on PCR
2.1.2 退火温度的优化
从图2可以得知,在10个退火温度梯度都有较清晰条带并且特异性较好,没有杂带。考虑到退火温度在亮度无明显差异时选择较高温度可以避免非特异性结合,选择60.4℃作为PCR反应条件的退火温度。
M:2000 bp Marker;O26退火温度,1~10分别为55.2℃、55.8℃、56.7℃、57.8℃、59.1℃、60.4℃、61.7℃、62.9℃、63.9℃和64.6℃
图2退火温度对单重PCR的影响
Figure 2 The effect of annealing temperature on PCR
2.1.3 循环数的摸索
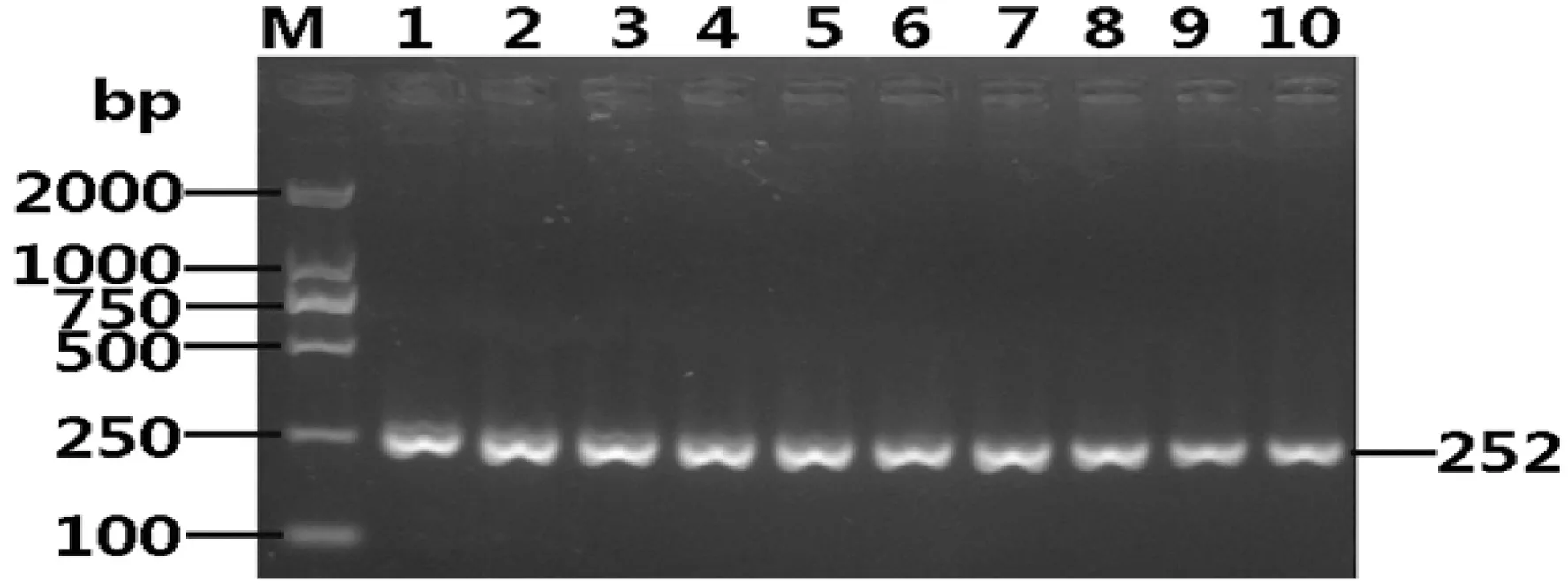
从图3可以得知,O26菌株在30、35、40这3种循环数下扩增都有较清晰条带并且特异性较好,没有杂带;所以我们选择35个循环作为单重PCR的反应条件。
M:2000 bp Marker;O26循环数,1~2为30个循环;3~4为35个循环;5~6为40个循环
图3循环数对PCR的影响
Figure 3 The effect of recurring number on PCR
综上所述,确定PCR体系:Premix ExTaq2×12.5 μL ,引物对工作液1 μL,加DNA模板2 μL,加ddH2O补至25 μL。反应条件为:94℃预变性5 min;94℃变性20 s ,60.4℃退火30 s,35个循环;72℃延伸1 min。
2.2 特异性试验
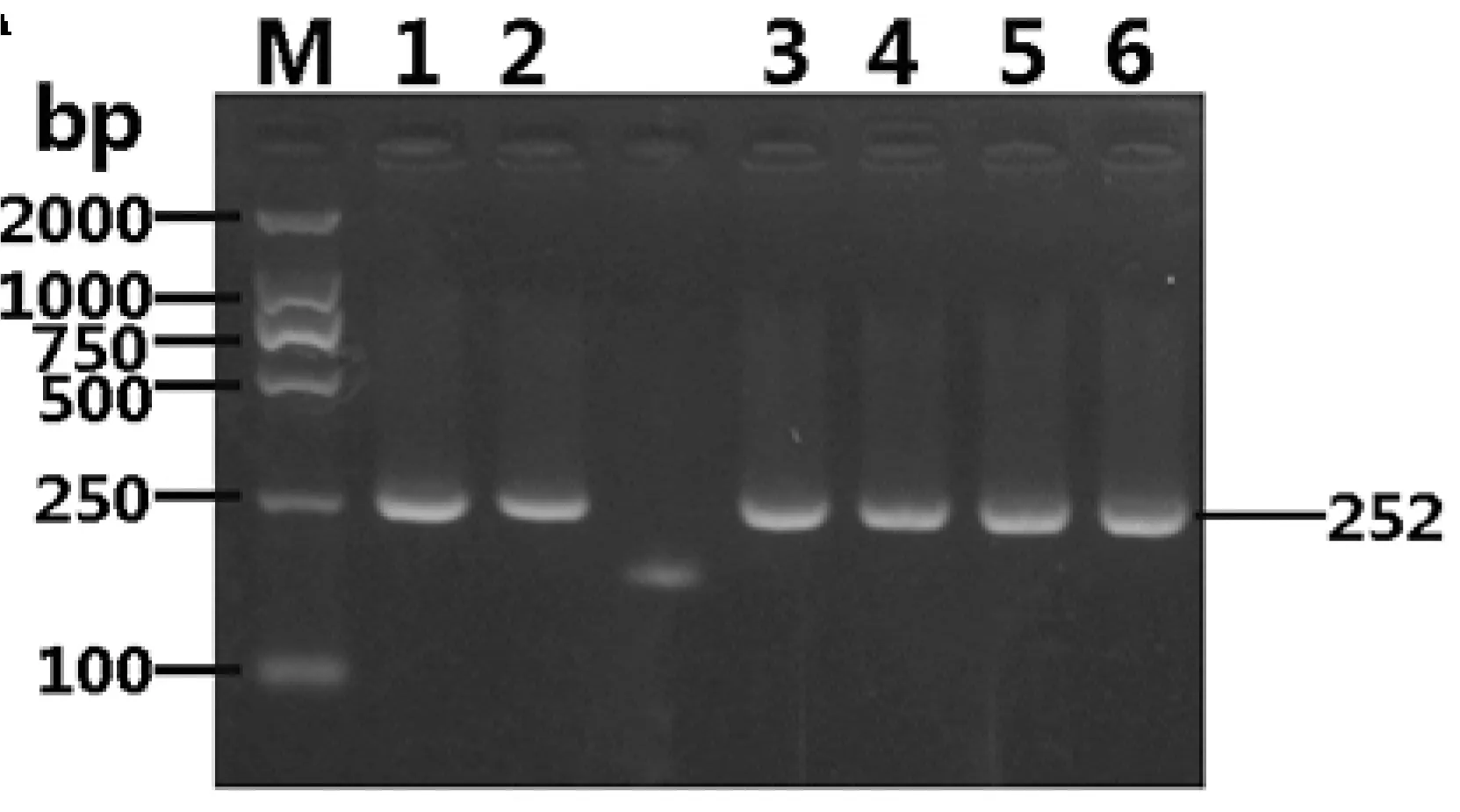
将所有菌株的DNA分别吸取2 μL用于PCR实验,在同一反应体系中加入大肠埃希氏菌ATCC 12795核酸模板1 μL作为阳性对照,采用优化好的反应体系和反应条件进行PCR检测O26血清型特异基因,以确定其特异性,所有菌株扩增结果与预期结果完全一致,扩增电泳图如图4。

M:DNA Marker DL2000;1:大肠埃希氏菌ATCC 12795;2:大肠埃希氏菌ATCC 12795;3:大肠埃希氏菌ATCC BAA-2469;4:大肠埃希氏菌ATCC 23982;5:大肠埃希氏菌ATCC 35150;6:大肠埃希氏菌CCTCC AB 200051;7:大肠埃希氏菌EHEC Stx1;8:大肠埃希氏菌EHEC Stx2;9:大肠埃希氏菌NCTC 12900;10:大肠埃希氏菌EC O104;11:大肠埃希氏菌ATCC 43887;12:大肠埃希氏菌ATCC 29552;13:大肠埃希氏菌ATCC 33780;14:大肠埃希氏菌ATCC BAA-2190
图4 PCR特异性试验
Figure 4 Specificity test of PCR reaction
2.3 灵敏度试验
将浓度为100 ng/μL的核酸逐步进行10倍稀释后分别进行PCR反应通过试验发现,核酸经过10-8倍稀释后,普通PCR 产物经过琼脂糖电泳染色后能观测到1 pg/μL浓度的条带,结果见图5。这说明该反应的灵敏度能达到1 pg/μL。
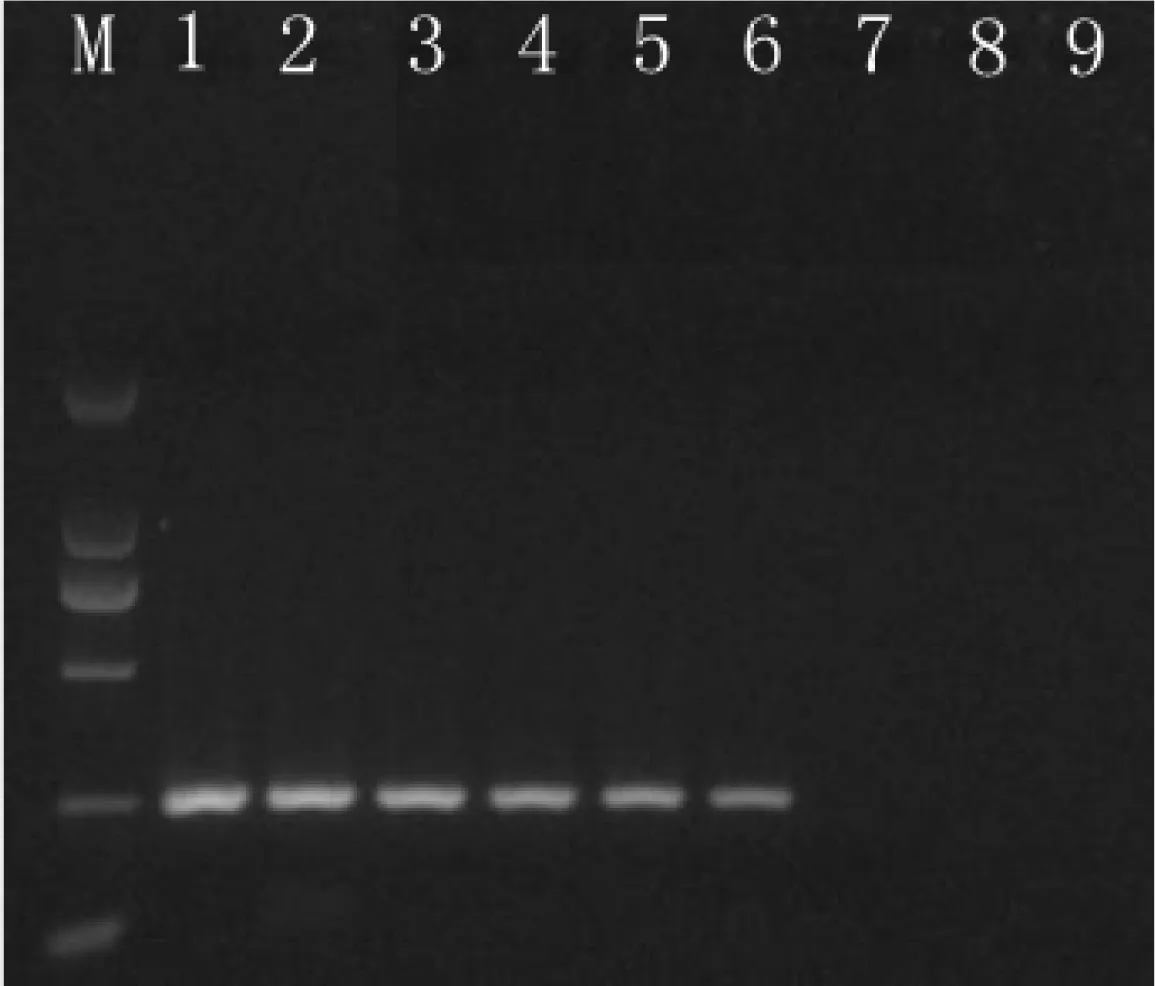
M:DNA Marker DL2000;1~9:大肠埃希氏菌ATCC 12795核酸100~10-8稀释物各2 μL
图5扩增灵敏度试验
Figure 5 sensitivity test of PCR reaction
2.4 样品加标试验
将新鲜培养的目标菌制成约0.35 McF浓度的菌悬液,10倍递增稀释至10-7稀释度,此时样品菌悬液浓度为10 CFU/mL的菌悬液用于样品加标试验。无菌取25 g食品样品至225 mL EC肉汤,分别添加对应目标菌株10 CFU/mL的菌悬液1 mL加至食品样品肉汤制备成10 CFU/25 g的加标样品,拍击式均质器均质2 min。将上述EC肉汤置36℃增菌24 h,分别采用普通PCR进行检测。各浓度添加样品试验结果与预期一致,其检测灵敏度可达10 CFU/25 g。
3 讨论
目前对于食品中大肠埃希氏菌的检测,基本上采用的是传统的微生物培养方法,检验步骤繁杂,周期长[9]。而PCR比传统微生物检验更快速,比核酸探针检测法更廉价。本研究建立的方法比特异性高,灵敏度高,适用于临床诊断、食品卫生监控及进出口食品安全检测,具有较强的实际应用价值,可推广使用。根据实验结果发现,使用该引物可以对大肠埃希氏菌O26进行特异性扩增以达到检测目的。大肠杆菌作为较常见的污染致病菌,虽然国内外都有使用PCR检测大肠杆菌的相关研究,但大多是检测大肠杆菌O157:H7,并且多与沙门氏菌、金黄色葡萄球菌联同检测[10]。近两年国外有少量以大肠埃希氏菌O26为对象的研究[11-13],国内针对大肠埃希氏菌O26的研究较少,这也就是本论文研究的必要性。通过本文的实验数据,一方面可以丰富大肠埃希氏菌主干研究内容,为其检测和应用提供可能性;另一方面可以为食源性污染提供快速检测方法,降低生活中食源性疾病暴发的可能性。
