金丽假交替单胞菌的分离鉴定与益生活性检测
2022-12-07张皓杰张文娟王丽荣蔡秀磊
沈 煜,张皓杰,张文娟,王丽荣,蔡秀磊*,单 虎
(1.青岛农业大学动物医学院,山东青岛 266109;2.山东碧蓝生物科技有限公司,山东泰安 271411)
近年来,随着动物养殖模式的集约化和规模化发展,养殖密度大大增加,动物疫病的传播和流行也随之加剧。细菌感染作为动物疫病中的重要组成部分,往往极易引发混合感染或继发感染[1]。长期以来应对细菌感染主要依靠抗生素治疗,但生产中抗生素滥用现象十分普遍,带来了严重的细菌耐药问题[2],尤其是多重耐药菌株的增加,不仅使临床治疗失败的现象增多,而且不规范用药也使得动物性食品中的药物残留超标[3],既影响了动物性食品的出口、威胁到社会公共卫生安全,又破坏了健康养殖生态平衡和自然中的微生物生态平衡[4],不符合健康可持续发展的理念。随着我国“禁抗令”[5]的颁布和实施,含有饲用抗生素的饲料全面停售,养殖业的“后抗生素”时代全面来临,寻找新的抗生素替代品以保障养殖安全变得尤为重要。海洋微生物以其丰富的生物多样性日益受到关注[6],目前已有大量的海洋源细菌被报道具有抑菌活性,且已鉴定的抑菌活性代谢产物约600余种[7]。细菌的密度感应系统[8]是细菌个体之间信息交流的主要工具,在调控细菌毒力因子的表达、耐药性方面发挥重要作用。密度感应淬灭则通过淬灭细胞间的信号分子,阻断病原菌之间的交流,从而有效干扰致病菌毒力因子的表达,降低甚至消除致病菌的致病性。本研究通过对分离得到的菌株进行鉴定,并检测其抑菌活性与密度感应淬灭活性,可为后续更好地开展对该菌及其抑菌活性产物的研究和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 报告菌紫色色杆菌(Chromobacteriumviolaceum)CV026和VIR24,大肠埃希氏菌(Escherichiacoli)E1、E2、E3、E4株,金黄色葡萄球菌(Staphylococcusaureus)PMJ4-1、PMJ10-1、PMJ30-2、TTB1-1、TTB2-1、QTB1-1株,沙门氏菌(Salmonella)QS1株,链球菌(Streptococcus)SS-1、SS-2、SS-7、SS-9株,铜绿假单胞菌(Pseudomonasaeruginosa)PA1、PA2株,志贺氏菌(Shigellacastellani)T3株,鳗弧菌(Vibrioanguillarum)VIB72,河流弧菌(Vibriofluvialis)VIB292,东方弧菌(Vibrioorientalis)VIB303,哈维氏弧菌(Vibrioharveyi)VIB295,短小芽孢杆菌(Bacilluspumilus)FYB01,均由青岛农业大学预防兽医实验室保存。
1.1.2 主要试剂 2216E海洋细菌培养基,美国BD公司上海有限公司产品;rTaq酶,宝日医生物技术(北京)有限公司产品;N-酰基高丝氨酸内酯(N-acylhomoserine lactones,AHL)信号分子C6-HSL、3-oxo-C6-HSL、C8-HSL,美国开曼生物公司产品;AHL信号分子3-oxo-C8-HSL、C10-HSL、3-oxo-C10-HSL、C12-HSL、3-oxo-C14-HSL,美国西格玛化学品公司产品;LB培养基和琼脂,青岛海博生物技术有限公司产品;氨苄青霉素(Amp)10 μg、卡那霉素(Kan)30 μg和四环素(Tet)30 μg药敏片,北京索莱宝科技有限公司产品。
1.1.3 主要仪器 高压灭菌锅(MLS-3751L),日本松下公司产品;电热恒温培养箱(DNP-9082),上海精宏实验设备有限公司产品;全温振荡培养箱(HZQ-FX)和生物安全柜(BSC-1100-LIA2),北京东联哈尔仪器制造有限公司产品;PCR仪(T100),美国Bio-Rad公司产品;核酸电泳(JY600),北京君意东方电泳设备有限公司产品;核酸电泳凝胶成像系统(GenoSens1850),上海勤翔科学仪器有限公司。
1.2 方法
1.2.1 细菌分离与纯化及形态学观察 将新鲜的健康斑节对虾产品样品进行研磨、稀释后,涂布于海洋细菌培养基2216E平板上,28 ℃恒温过夜培养获得若干菌株。将分离所得的菌株进一步纯化培养后,挑取各菌株的单菌落点种于涂有鳗弧菌VIB72的平板上,28 ℃过夜培养。能在平板上产生抑菌圈的菌株命名为DL1,并进行革兰氏染色与镜检。
1.2.2 菌株DL1的16S rRNA的扩增与测序 将菌株DL1划线接种于2216E斜面,28 ℃培养过夜后,取2 mL灭菌双蒸水洗涤菌苔并收集于离心管中,高速离心弃去上清液,收集菌体沉淀。采用酚-氯仿抽提法[9]提取菌株DL1的基因组总DNA作为PCR反应模板,以27F/1492R通用引物进行PCR扩增[10]。PCR扩增后的产物经琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序,将测序所得的16S rRNA核苷酸序列在NCBI(www.ncbi.nlm.nih.gov)中的Blastn进行序列比对,应用序列综合分析软件MEGA5.1中Clustal W比对后,用phylogeny以NJ、ML和MP法构建菌株DL1的系统发育树。
1.2.3 不同培养时间的生物量、抑菌活性、胞外蛋白含量 取20 μL复苏后的菌液DL1转接至2 mL 2216E液体培养基中进行培养(28 ℃、170 r/min),在培养24、48、72、96 h后,分别用酶标仪测定OD 600 nm值,并以牛津杯法测定各样品对VIB72的抑菌活性强弱;将各个时期收集的菌液低温高速条件下离心(4 ℃,12 000 r/min,10 min)收集上清液,经0.22 μm孔径滤器除菌后,测定不同样品的OD 595 nm值,以表征各样品中蛋白的含量。
1.2.4 抑菌试验 用牛津杯法测定菌株DL1对23株常见病原菌的抑制效果。23株病原菌经活化后分别接种于LB和2216E液体培养基,振荡培养过夜后,将待测菌液与LB半固体培养基混合(比例1∶100)倒板,每孔中添加DL1菌液50 μL。培养24 h后测量菌株DL1对不同病原菌所产生的透明圈直径[11],同时检测阳性对照抗生素(Amp、Kan和Tet)药敏纸片的抑菌效果。
1.2.5 密度感应淬灭活性检测 采用平板检测法测DL1对不同AHL类信号分子的淬灭活性。报告菌CV026和VIR24分别用于检测短链(C4~C8)和长链(C8~C14)AHL信号分子,报告菌接种于LB培养基并28 ℃培养活化后备用。将培养好的DL1菌液、PIPES缓冲液(1 mol/L,pH 6.7)以及AHL类信号分子(1 mmol/L)按10∶1∶0.1的比例混匀后[12],在28 ℃孵育24 h,即为制备的反应液。报告菌按3%接种量加入到温度为45 ℃左右的半固体LB培养基中,迅速混匀后倒板,待凝固后在板上打孔,取上述反应液10 μL加入检测孔,同时设置阳性对照(ddH2O、PIPES缓冲液与各类信号分子按比例10∶1∶0.1配置),正置于28 ℃培养箱中培养过夜,观察蓝色或紫色晕圈的出现。
1.2.6 统计学分析 T-text用于两组之间的比较,使用One-Way ANOVA进行多次比较。统计学设定“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01),“ns”表示差异不显著(P>0.05)。
2 结果
2.1 形态学特征和16S rRNA序列分析
分离菌株在2216E培养基上生长良好,培养48 h,菌落呈黄色,边缘整齐、光滑,革兰氏阴性杆菌,端生鞭毛。PCR产物经测序后获得一段1 444 bp长的序列,测序结果用Blastn进行比对,该基因与金丽假交替单胞菌(Pseudoalteromonasflavipulchra)NCIMB 2033T同源性高达100%,用序列综合分析软件MEGA5.1对菌株DL1与相近菌株的16S rRNA序列进行系统发育分析(图1),结果显示菌株DL1与金丽假交替单胞菌(P.flavipulchra)NCIMB 2033T亲缘关系最近,结合形态学特征,将菌株DL1鉴定为金丽假交替单胞菌。
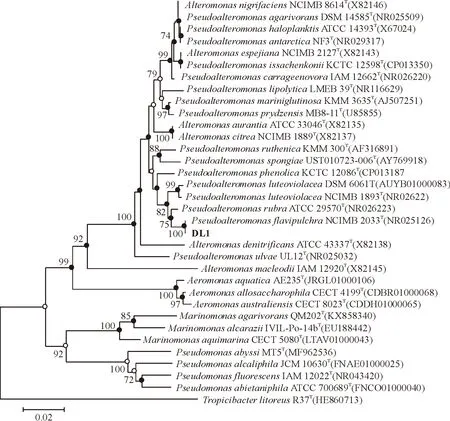
●.该节点与采用ML、MP法的结果一致;○.该节点与采用ML法的结果一致
2.2 不同培养时间生物量、抑菌活性及胞外蛋白的含量结果
由图2A可知,菌株DL1的生物量在48 h、72 h和96 h极显著高于24 h(P<0.01),48 h极显著高于72 h(P<0.01),48 h和72 h极显著高于96 h(P<0.01),菌株DL1在培养48 h后,其生物量到达最高值,随后随着培养时间的延长生物量开始下降,这表明培养48 h时,菌株DL1已经进入了生长稳定期,此时菌的数量保持相对稳定并达到最高水平。图2B可知,菌株DL1对VIB72的抑菌活性在48 h、72 h和96 h极显著高于24 h(P<0.01),48 h极显著高于72 h(P<0.01),48 h和72 h极显著高于96 h(P<0.01),48 h时该菌对VIB72的抑菌活性最强。对其不同培养时间的胞外产物中蛋白含量的影响,由图2C可知,48 h、72 h和96 h极显著高于24 h(P<0.01),48 h极显著高于72 h(P<0.01),48 h和72 h极显著高于96 h(P<0.01)。培养48 h时胞外产物中蛋白的含量达到最高,随后蛋白浓度随着培养时间延长而显著降低。因此,确定在后续开展对该菌的抑菌活性检测及活性产物分离纯化时,均采用培养48 h这个培养条件。
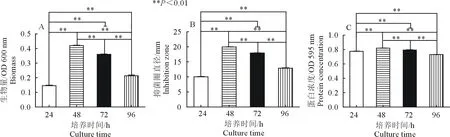
A.不同培养时间的生物量;B.不同培养时间胞外产物的抑菌圈;C.不同培养时间的胞外蛋白总量
2.3 抑菌试验结果
采用牛津杯法检测菌株DL1对23株常见病原菌的抑菌活性,结果显示菌株DL1对其中的21株病原菌具有较强的抑制作用,抑菌圈直径在10 mm以上。其中,菌株DL1对金黄色葡萄球菌PMJ4-1、QTB1-1、TTB2-1的拮抗作用最强,对金黄色葡萄球菌TTB1-1、鳗弧菌VIB72、东方弧菌VIB303的拮抗作用次之,但是对金黄色葡萄菌PMJ30-2和链球菌SS-2无抑菌效果,具体结果见表1。本研究中采用的Amp、Kan和Tet药敏纸片均无法抑制本试验中的所有病原菌,表明这23株病原菌均具有一定的耐药性,菌株DL1对指示菌的抑菌强度明显强于所用的药敏纸片,可见菌株DL1具有较为广泛的抑菌活性。
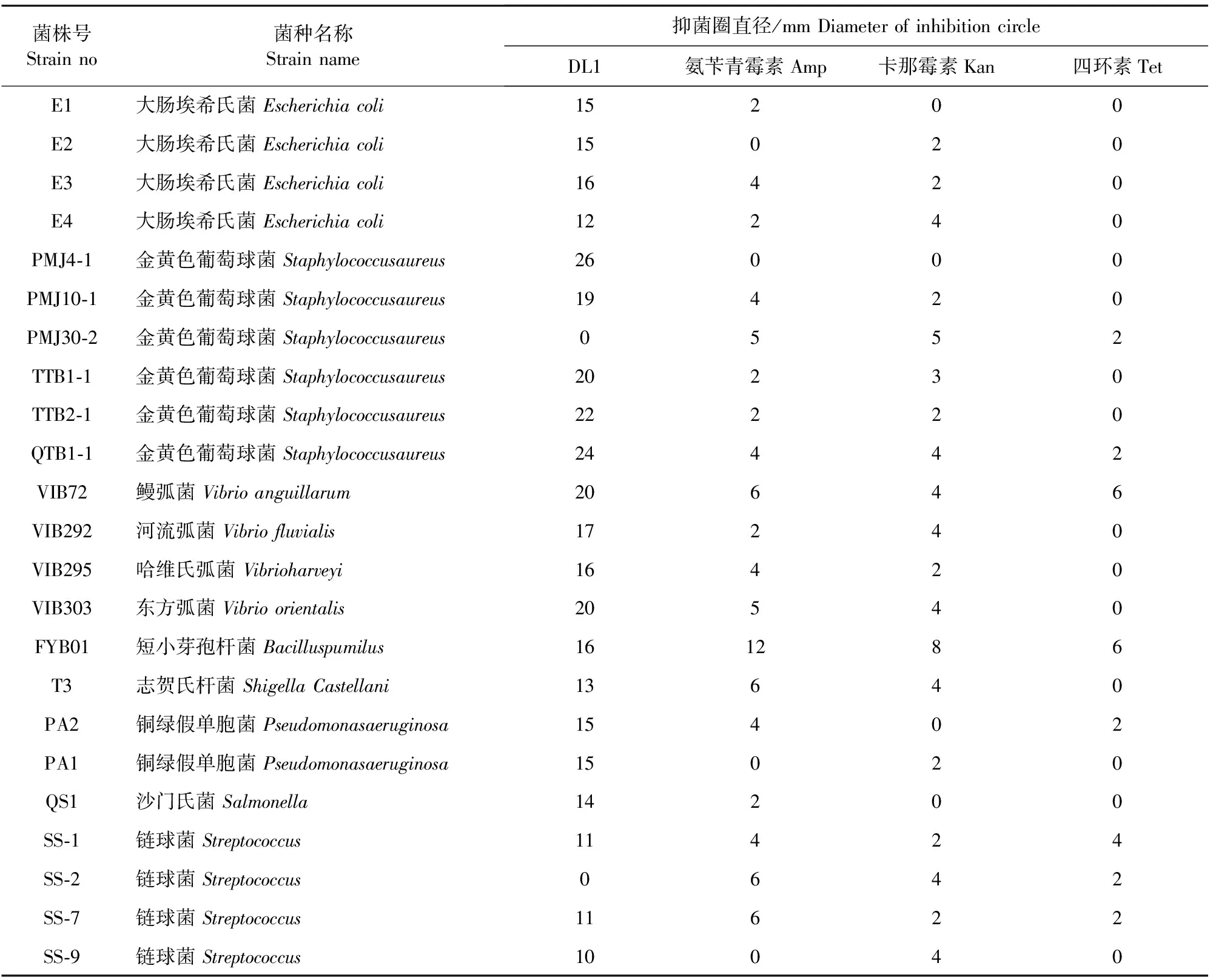
表1 菌株DL1对不同病原菌的抑菌试验结果
2.4 密度感应淬灭活性检测结果
根据检测孔与阳性对照孔的显色结果,发现菌株DL1对本试验中所用到的AHL类信号分子均具有淬灭活性(图3)。其中,菌株DL1对3-oxo-C6-HSL、C8-HSL、C10-HSL、C12-HSL、3-oxo-C14-HSL具有非常强的淬灭活性,其检测孔完全不显色,与阳性对照对比非常明显;而对3-oxo-C8-HSL、3-oxo-C10-HSL的淬灭活性相对较弱,未完全淬灭该信号分子,检测孔仍可见模糊的紫色;菌株DL1对C6-HSL的淬灭活性较弱,虽然检测孔的紫色晕圈直径略有缩小,但仍有非常明显的紫色显示,表示检测孔中仍有大量的C6-HSL未被淬灭。

(+).ddH2O、PIPES缓冲液与各类信号分子所配置的反应液
3 讨论
假交替单胞菌是20世纪90年代由Gaulthier等[13]首次报道的一个属,该属细菌已经有游海假交替单胞菌、柠檬假交替单胞菌、金丽假交替单胞菌等41个种被鉴定[14]。已有研究结果显示该属细菌的多个种均具有较强的抑菌活性,可以在不同的环境中保持竞争优势,因此广泛存在于海洋深处、极地等环境中。假交替单胞菌能产生多种抑菌活性物质,主要包括生物碱、聚酮类、肽[15]、胞外酶[16]和胞外多糖[17]等。
本研究对分离纯化的菌株DL1进行了16S rRNA核苷酸序列测定和系统进化分析,鉴定为金丽假交替单胞菌。抑菌活性结果显示,菌株DL1可以广泛抑制本试验中所检测的90%以上的动物病原菌,且抑菌活性明显强于3种抗生素;经密度感应淬灭活性检测,菌株DL1对短链和长链AHL类信号分子均具有较强的密度感应淬灭活性,尤其是对3-oxo-C6-HSL、C8-HSL、C10-HSL、C12-HSL、3-oxo-C14-HSL等信号分子的淬灭活性较强。此前,于敏[18]报道金丽假交替单胞菌JG1具有抑菌活性和密度感应淬灭活性,本试验结果与之相似,且自菌株JG1中分离鉴定了5种小分子抑菌化合物和密度感应淬灭酶PfaP,系统阐述了JG1的抑菌机制。Wang H等[19]发现了1株金丽假交替单胞菌CDM8,对多种弧菌和芽孢杆菌具有较好的抑菌活性,经扫描电镜观察发现该菌可以在外表面形成囊状/丝状结构,参与了其抑菌活性,是CDM8的一种新的抗菌机制。至今,关于金丽假交替单胞菌的密度感应淬灭活性相关报道甚少。基于菌株DL1的抑菌活性和密度感应淬灭活性检测结果,该菌具有作为有益菌应用的潜质,可以进一步开展该菌株及其活性代谢产物的应用研究。
本研究分离得到的金丽假交替单胞菌DL1具有较强的抑菌活性和密度感应淬灭活性,今后可以对菌株的活性产物进行分离纯化和重组表达,深入开展该菌及其产物的功能和应用研究,探索其在动物细菌性病害防控中的应用途径和策略。
